生物处理技术和生物修复技术因高效、经济、生态友好等特点,成为近年来废水处理领域研究的热点〔12〕。目前,从自然界筛选微生物来处理不同环境污染的研究已屡见不鲜。M. K. Awasth等〔13〕用嗜热菌处理油性食物废料,可将体积分数为2%的植物油降解65%;E. H. Lee等〔14-15〕采用Rhodococcus sp.完全降解体积分数为1%的环己烷;H. S. Joo等〔16〕从石油污染土壤中筛选出念球菌,对体积分数为2%的柴油的降解率为65%;M. M. A. A. El-Gendy等〔17〕用Nocar-diopsis sp. MORSY1948处理100 mL实际废水,可100%吸附降解Ni2+和Cr6+。生物技术已成为治理和修复环境污染的最佳手段之一。但对高浓度餐饮含油废水的生物降解研究仍然较少;在已有研究中,筛选出的微生物对油脂的降解处理存在降解效率低、降解周期长等缺陷。针对以上问题,笔者对降解高浓度油脂微生物的筛选、分离及降解特性进行了研究,最终分离出多株高效降解油脂的菌株,其中LYC46-2菌株表现出较好的生长和降解活性,同时进行了一系列相关实验,以期为今后的实践应用提供理论依据和技术支撑。
1 材料与方法
1.1 实验材料
筛选油脂降解菌所用实验样品来自太原理工大学明向校区餐厅排污下水道的油性污泥。实验用植物油主要于市面采购,包括金龙鱼花生调和油、花生油、大豆油、菜籽油、芝麻香油、亚麻籽油和葵花籽油,地沟油由实验室自行收集。将不同油脂于121 ℃灭菌,室温下保存备用。Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程股份有限公司),用于细菌基因组提取。
MBSM培养基配方〔18〕:1.0 g NH4NO3,0.5 g KH2PO4,5.24 g K2HPO4·3H2O,0.2 g MgSO4·7H2O,2.0 mL 1%(质量分数,下同)CaCl2,200 μL 5%NaCl,200 μL 1%FeCl3,5.0 mL 1%酵母提取物,5.0 mL微量离子溶液,蒸馏水1 000 mL,121 ℃灭菌30 min。
1.2 实验方法
1.2.1 油脂降解菌株的筛选与分离
初筛:称取0.3 g油性污泥样品于30.0 mL MBSM培养基中,加入1.0 mL金龙鱼花生调和油(此油在日常餐饮中应用较普遍,由花生油、芝麻油、玉米油、葵花籽油、菜籽油、大豆油、亚麻籽油、红花籽油等调和而成,可增加非特异油脂降解微生物筛选的比例)作为唯一碳源,在30 ℃、200 r/min的摇床中培养72 h。移取2.0 mL富集液于新鲜MBSM培养基中(之后每次培养基中的油脂添加量较之前多1.0 mL),连续富集培养3次,通过稀释涂布平板法进行初筛。
复筛:将初筛得到的菌落种子液分别接种于含有2%(体积比)金龙鱼花生调和油的10.0 mL MBSM培养基中,在30 ℃、200 r/min的摇床中培养12 h,考察初筛菌落对花生调和油的降解率,选择降解率>35%的优势菌落。
分离纯化:对复筛得到的优势菌落进行多次平板划线分离纯化,最终得到单一菌株,依次进行编号。
1.2.2 菌种鉴定
用Ezup柱式细菌基因组DNA抽提试剂盒分别对6株菌的基因组进行提取,通过细菌16SrDNA通用引物(上游引物27F:5’-AGAGTTTGATCCTG- GCTCAG-3’和下游引物1492R:5’-GGTTACCTT- GTTACGACTT-3’)进行PCR扩增,PCR条件:5.0 μL 10×Taq缓冲液、1.0 μL上下游引物、1.0 μL模板DNA、1.0 μL dNTP和1.0 μL DNA聚合酶,最后加40.0 μL无菌水补足至50 μL,在以下条件下进行PCR:95 ℃预变性5 min,95 ℃变性30 s、55 ℃退火30 s、72 ℃引物延伸1.5 min循环30次,72 ℃延伸10 min。最后将PCR纯化产物送至上海生工生物工程股份有限公司进行测序,将测序产物在NCBI基因文库中进行序列比对与登记。
1.2.3 菌株的细胞密度与乳化能力测试
移取1.0 mL菌株种子液(OD600=1.0)接种至含2%金龙鱼花生调和油的50.0 mL MBSM培养基中,30 ℃、200 r/min下震荡培养72 h,在波长600 nm处用紫外分光光度计测其吸光度即为细胞密度。将培养好的反应液于10 000g离心15 min,取1.0 mL上清液与5.2 mL的磷酸钾缓冲液(pH 7.0)和0.2 mL的油脂混合,震荡2 min后静置10 min,在540 nm处测其吸光度即为菌株的乳化油脂能力〔16〕。
1.2.4 油脂降解率的测定
将培养24 h的菌株种子液于10 000 g下离心15 min,用质量分数为0.85%的NaCl溶液冲洗沉淀细胞2次以洗去残余碳源,然后用MBSM培养基将细胞沉淀制成OD600=1.0的细胞悬液。取1.0 mL细胞悬液接种于含有一定浓度油脂的50 mL MBSM培养基中,在30 ℃、200 r/min的摇床中培养72 h。以正己烷为溶剂,萃取培养基里残余的油脂,用旋转蒸发仪于35 ℃下蒸发,真空干燥后收集剩余油脂,冷却至室温后称重。以同步不接种菌株的MBSM培养基为空白对照,降解率按式(1)计算。
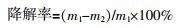
式中:m1——对照组的残余油脂质量,g;
m2——接种菌株的残余油脂质量,g。
1.3 油脂降解菌株降解特性研究
1.3.1 分离纯化的6株菌株的油脂降解能力测试
分别取1.0 mL(OD600=1.0)6株单一菌株的细胞悬液置于含2%(体积比)金龙鱼花生调和油的50.0 mL MBSM培养基中,在30 ℃、200 r/min条件下震荡培养72 h,测量其残余油脂质量。
1.3.2 LYC46-2降解油脂能力的影响因素
分析了不同因素(培养基初始pH、培养温度、培养时间、油脂浓度及油脂种类)对菌株降解率的影响:(1)用10.0 mol/L的HCl溶液和NaOH溶液分别调节50.0 mL MBSM培养基的pH至4.0、6.0、8.0、10.0(原MBSM培养基pH为7.1±0.5),接种OD600=1.0的LYC46-2菌株细胞悬液于不同初始pH的50.0 mL含花生调和油(体积比2%)的MBSM培养基中,30 ℃、200 r/min下震荡培养72 h,测量残余油脂质量。(2)将接种LYC46-2菌株悬液(OD600=1.0)的50.0 mL含2%(体积比)花生调和油MBSM培养基(pH为7.0)置于摇床中,分别设置摇床温度为20、25、30、35、40、45 ℃,在200 r/min下震荡培养72 h,测量残余油脂质量。(3)将接种LYC46-2菌株的50.0 mL含2%(体积比)花生调和油的MBSM培养基(pH为7.0)在30 ℃、200 r/min摇床中连续培养,培养时间分别为6、12、18、24、30、36、48、72 h,取样测量残余油脂质量,计算降解率。(4)在50.0 mL MBSM培养基(pH为7.0)中分别加入2%、4%、6%、8%、10%(体积比)的花生调和油,然后接种OD600=1.0的LYC46-2菌株细胞悬液,在30 ℃、200 r/min摇床中震荡培养72 h,测量残余油脂质量。(5)分别添加体积比为2%的花生油、地沟油、大豆油、菜籽油、芝麻香油、亚麻籽油和葵花籽油于50.0 mL MBSM培养基(pH为7.0)中,然后接种OD600=1.0的LYC46-2菌株细胞悬液,在30 ℃、200 r/min摇床中震荡培养72 h,测量残余油脂质量。
2 结果与讨论
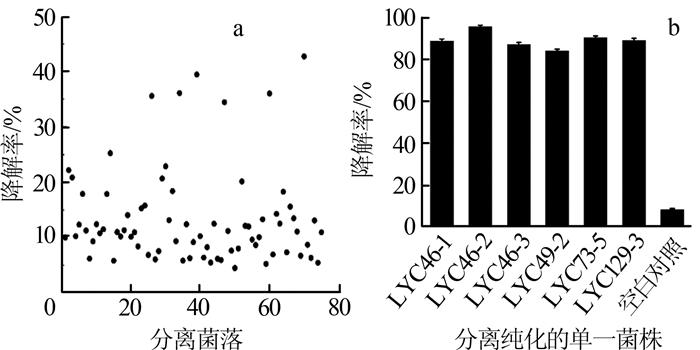
2.1 菌株油脂降解能力分析
图1
图1
菌落和单一菌株对2%金龙鱼花生调和油的降解率
(a)初筛得到的75个菌落对调和油的降解率(30 ℃、200 r/min摇床中培养12 h);(b)分离纯化的6株单一菌株对调和油的降解率(30 ℃、200 r/min摇床中震荡培养72 h)。
2.2 菌株鉴定
对分离纯化出的6株菌株进行16S rDNA序列测序并与NCBI基因库进行比对,结果如表1所示。
表1 分离菌株的鉴定结果
| 分离菌株 | 菌株(一致性) | NCBI序列号 |
| LYC46-1 | Acinetobacter dijkshoorniae (99%) | MH880843 |
| LYC46-2 | Acinetobacter dijkshoorniae (99%) | MH880844 |
| LYC46-3 | Acinetobacter dijkshoorniae (99%) | MH880845 |
| LYC49-2 | Acinetobacter dijkshoorniae (99%) | MH880846 |
| LYC73-5 | Acinetobacter dijkshoorniae (99%) | MH880847 |
| LYC129-3 | Acinetobacter dijkshoorniae (99%) | MH880848 |
由表1可见,6株菌均与不动杆菌属(Acinetobacte sp.)中的莴苣不动杆菌(Acinetobacter dijkshoorniae)有99%的相似性,可基本认定此6株菌均为莴苣不动杆菌(Acinetobacter dijkshoorniae)。
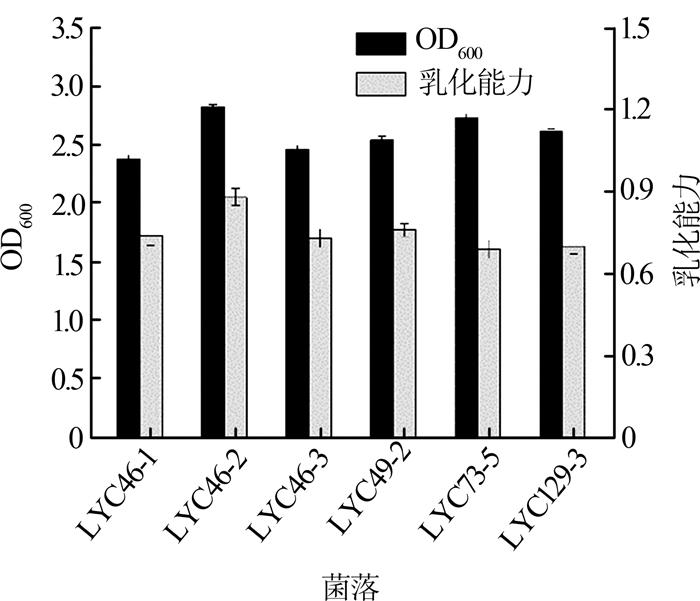
2.3 油脂降解菌的细胞密度及乳化能力测试
用紫外分光光度计分别在波长600、540 nm处测量6株单一菌株的细胞密度及乳化能力,如图2所示。
图2
由图2可见,6株不动杆菌属可在MBSM培养基中较好地生长,OD600高达2.4~2.9,乳化能力可达0.72~0.88,这一结果与H. S. Joo等的研究结果一致,且比文献报道的乳化能力更强〔13, 16〕。LYC46-2菌株的细胞密度及乳化能力较其他菌株都高,与其表现出的对油脂的降解能力一致(见图1)。本研究筛选的莴苣不动杆菌(Acinetobacter dijkshoorniae)具有很高的油脂降解活力,与不动杆菌属具有降解油脂能力的相关研究相符。且与D. Sugimori等研究的Acinetobacte sp.降解油脂特性相比,Acinetobacter dijkshoorniae LYC46-2显示出更高的降解活性(见表2)〔19-22〕。因此,后续实验中主要针对LYC46-2进行研究。
表2 不同菌株的油脂降解能力
| 菌株 | 油脂与质量浓度 | 温度与时间 | 降解率/% | 参考文献 |
| Acinetobocter sp. Strain SOD-1 | 色拉油,3 000 mg/L | 35 ℃,24h | 83 | 〔20〕 |
| Acinetobocter sp. | 食用油,8 000 mg/L | 28 ℃,72h | 60~65 | 〔21〕 |
| Acinetobocter sp. SS-192 | 混合油,3 000 mg/L | 37 ℃,24h | 77.5 | 〔19〕 |
| Acinetobocter sp. UD—4 | 食用油,10 000 mg/L | 25 ℃,168h | 60~96 | 〔22〕 |
| Bocteriol consortium(BC) | 植物油,2%(体积比) | 55 ℃,72h | 65.47 | 〔13〕 |
| JAT inoculum | 花生油,2%(质量比) | 30 ℃,168h | 57 | 〔23〕 |
| Acinetobacter dijkshoorniae LYC46-2 | 调和油,2%(体积比) | 30 ℃,30h | > 90 | 本研究 |
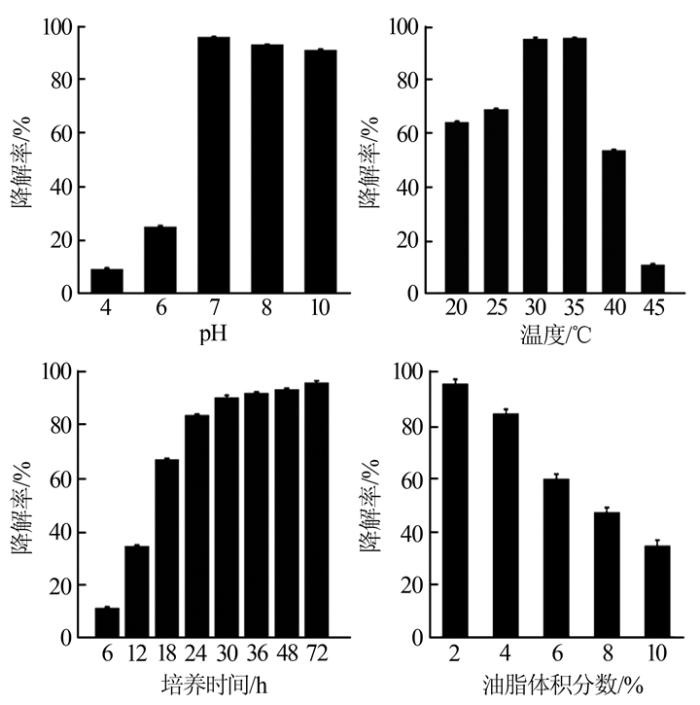
2.4 反应条件对LYC46-2油脂降解率的影响
图3
分别得到以下结论:(1)pH为4.0~6.0时,菌株对油脂的降解率<30%,当pH为7.0~10.0时,油脂降解率>90%,降解活性几乎不受pH影响。这是由于酸性条件限制了细胞生长,导致菌株在酸性条件下活性较弱;但在碱性条件下菌株活性依然较强,说明其具有抗碱性特点,这一结论与M. K. Awasthi等的研究一致〔13, 23〕。(2)培养温度为30~35 ℃时,菌株对油脂的降解率最高达95%;低于30 ℃时,油脂降解率<70%;高于40 ℃时,降解率降低至15%~45%。(3)培养6 h时,培养基中的油脂几乎未被菌株降解;培养18 h时,65%的油脂被降解;反应30 h时,超过90%的油脂被菌株降解。随着培养时间的增加,菌株对油脂的降解率不断提高;培养30 h后,油脂降解趋势变化缓慢。由此推测培养30 h左右时油脂基本被菌株降解完全。由表2看出,当油质量浓度为3 000 mg/L、培养24 h时,Acinetobacter sp.菌株对油脂的降解效果仍低于85%;采用Acinetobacter sp.降解质量浓度为8 000~10 000 mg/L的植物油时,培养时间超过72 h微生物依然不能将油脂完全降解。对于2%的金龙鱼花生调和油,LYC46-2菌株降解24 h后的降解率高达85%;反应时间为30 h时,油脂几乎被完全降解。本研究分离出的莴苣不动杆菌LYC46-2在降解速率上有极大优势〔19-22〕。(4)培养基中的植物油为2%时,菌株LYC46-2可以降解95%的油脂;增加油脂至4%、培养72 h后,该菌株对油脂的降解率仍高达85%左右;但当培养基中的油脂增至8%~10%时,菌株对油脂的降解率低于50%。随着油脂含量的增加,LYC46-2菌株的油脂降解率逐渐降低。这可能是由于油脂增加导致培养基表面形成的油膜厚度增加,阻断了微生物生长所需氧气的摄入。这一结果与M. K. Awasthi等的研究一致〔13〕。由表2可知:K. Tano-Debrah等采用混合菌株对2%的油脂进行降解,反应时间为72~168 h时降解率最高才达到65%。而本研究中当油脂为6%、反应72 h时,单一菌株Acinetobacterdijkshoorniae LYC46-2的降解率可以达到60%。显然,筛选出的LYC46-2菌株在处理较高浓度含油脂废水方面具有更明显的优势〔13, 23〕。
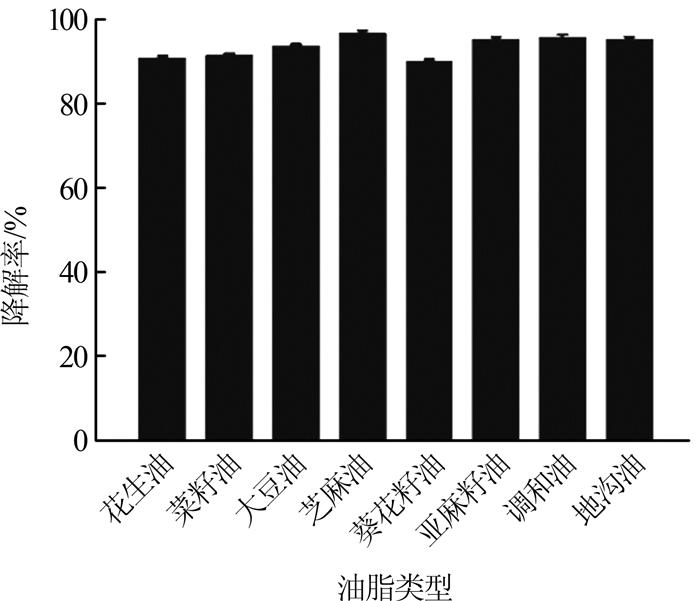
2.5 菌株LYC46-2对不同类型油脂的降解
由于各种食用油在不饱和脂肪酸含量及化学组成方面存在差别,且油脂对微生物的敏感程度也不同,因此研究菌株LYC46-2对不同种类植物油的降解率是必要的。K. Tano-Debrah等研究了9种常见油脂对JAT混合菌株降解效果的影响,当油脂为2%、反应时间168 h时,JAT混合菌株对花生油、菜籽油、混合油脂的降解率分别为57%、56%、70.5%。在本研究中,当油脂为2%、培养时间为72 h时,菌株LYC46-2对芝麻油、亚麻籽油、调和油的降解率都高达95%(见图4);对另外5种油脂(花生油、菜籽油、大豆油、葵花籽油和地沟油)的降解率也均可达到90%以上。这些降解差异可归因于参与脂类降解的酶的底物特性,如菌株分泌产生的脂肪酶与β-氧化酶、胞外分泌的脂肪酶对不同油脂的可获得性不同〔19〕,即菌株LYC46-2分泌的酶对芝麻油、亚麻籽油、调和油的可获得性较花生油、菜籽油、大豆油、葵花籽油和地沟油的高;其次,各种油脂对微生物降解的敏感性不同〔23〕,芝麻油、亚麻籽油、调和油对菌株LYC46-2的降解敏感性较其他5种油强。但总体来看,LYC46-2菌株对2%不同类型油脂降解率均高于90%,且高于其他菌种的降解率,这可能是由于该菌的乳化能力高于其他菌种。从图2可知,相同条件下测得的LYC46-2乳化能力为0.9(540 nm处的吸光度即乳化能力),较D. Sugimori等筛选的菌株Ba-S2-Brevibacillus agri、Bc-S6-Bacillus cereus、Bl-S9-Bacillus licheniformis和Candidacatenulate CM1的乳化能力(540 nm处的吸光度为0.4~0.5)高将近1倍〔19-20〕。据报道,乳化能力与表面活性密切相关,可以降低液体的表面张力,使大油滴破碎分散成小油滴更易溶于水中,增加了油脂与微生物的接触,从而使油脂更容易被菌株吸收代谢〔24〕。从菌株LYC46-2对不同类型油脂的降解结果可以看出,菌株LYC46-2对油脂的选择性较弱,对大部分油脂的降解活性都较高。
图4
3 结论
(1)从油性污泥中筛选、分离、纯化出6株油脂降解菌株,经16S rDNA测序比对鉴定出这6株菌均为莴苣不动杆菌(Acinetobacter dijkshoorniae),最终选择1株降解率最高、生长状态最好的菌株LYC46-2研究微生物的降解油脂特性。
(2) LYC46-2降解油脂过程中受不同条件(培养基初始pH、培养温度、培养时间及油脂浓度)的影响。在pH为7.0~10.0、温度为30~35 ℃、摇床转速为200 r/min的条件下培养72 h,该菌株对2%金龙鱼花生调和油的降解率可达95.7%。
(3)当金龙鱼花生调和油为4%时,菌株LYC46- 2对油脂的降解率可达84.5%;进一步提升油脂到6%,降解率可达59.7%。该菌株对2%芝麻油、亚麻籽油的降解率可达95%以上,对花生油、菜籽油、大豆油、葵花籽油和地沟油的降解率也在90%以上。
综上,筛选获得的Acinetobacter dijkshoorniae LYC46-2具有油脂降解效率高,能处理高浓度不同类型油脂餐饮废水的特性。
参考文献
Degradation and modification of fats, oils and grease by commercial microbial supplements
[J].
餐饮业废水的处理方法分析
[J].DOI:10.3963/j.issn.1674-6066.2005.03.021 [本文引用: 1]
Microscopic characterization of oil droplets removed by flocs after coagulation of oil-water emulsions
[J].DOI:10.1081/ESE-120002577 [本文引用: 1]
Recovery of residual emulsifiable oil from waste water by flotation
[J].
Oil recovery from oil in water emulsions using a flotation column
[J].DOI:10.1002/cjce.5450680611 [本文引用: 1]
高效处理含油废水微生物的筛选与驯化
[J].DOI:10.3321/j.issn:1005-3026.2007.05.029 [本文引用: 1]
Biodegradation of waste-lubricating petroleum oil in a tropical alfisol as mediated by animal droppings
[J].DOI:10.1016/j.biortech.2007.10.031
Applied models to biodegradation kinetics of lubricant and vegetable oils in wastewater
[J].
Treatment of oily bilge water from small fishing vessels by PUF-immobilized gordonia Sp. JC11
[J].
Bio-degradation of oily food waste employing thermophilic bacterial strains
[J].DOI:10.1016/j.biortech.2017.06.115 [本文引用: 6]
Characterization of cyclohexane and hexane degradation by Rhodococcus Sp. EC1
[J].DOI:10.1016/j.chemosphere.2007.12.009 [本文引用: 1]
Degradation of hexane and other recalcitrant hydrocarbons by a novel Isolate, Rhodococcus Sp. EH831
[J].DOI:10.1007/s11356-009-0238-x [本文引用: 1]
Bioremediation of oil-contaminated soil using Candida catenulata and food waste
[J].
Evaluation and enhancement of heavy metals bioremediation in aqueous solutions by Nocardiopsis Sp. MORSY1948, and Nocardia Sp. MORSY2014
[J].DOI:10.1016/j.bjm.2016.04.029 [本文引用: 1]
Characterization and biotechnological potential of petroleum-degrading bacteria isolated from oil-contaminated soils
[J].DOI:10.1016/j.biortech.2010.05.060 [本文引用: 1]
A study of the efficiency of edible oils degraded in alkaline conditions by Pseudomonas aeruginosa SS-219 and Acinetobacter Sp. SS-192 bacteria isolated from Japanese soil
[J].DOI:10.1007/s11274-011-0880-6 [本文引用: 5]
Microbial degradation of lipid Byacinetobacter sp. strain SOD-1
[J].DOI:10.1271/bbb.66.1579 [本文引用: 2]
An investigation into microbial removal of fats, oils and greases
[J].DOI:10.1016/S0960-8524(96)00134-4 [本文引用: 1]
Takashima M, Mizuta A, et al. Acinetobacter Sp. ud-4 efficiently degrades both edible and mineral oils:isolation and characterization
[J].DOI:10.1007/s00284-009-9525-5 [本文引用: 3]
An inoculum for the aerobic treatment of wastewaters with high concentrations of fats and oils
[J].DOI:10.1016/S0960-8524(98)00181-3 [本文引用: 4]





 津公网安备 12010602120337号
津公网安备 12010602120337号