含酚工业废水中的焦化废水含有酚类、杂环化合物、多环化合物、苯系物等有机物,所含酚的浓度较高〔1〕,脱酚处理后COD仍高达1 500~4 500 mg/L,挥发酚为300~500 mg/L〔2〕,经过生物处理以后依然存在间甲酚、苯系物、卤代烃等有机物〔3〕。焦化废水水质特征为B/C较低,营养结构失衡,酚类、还原性无机物及含氮杂环化合物、多环芳烃对微生物具有毒性抑制作用〔4-6〕,并且酚类化合物的水解酸化速率较慢〔7〕,这也是生物法处理焦化废水效果不佳的原因。在厌氧处理过程时,酚类在低负荷情况下绝大部分都可以被去除,但如果进水中酚浓度增加,出水中会出现间甲酚〔8〕。由于酚类有机物的厌氧降解与甲基取代基紧密相关,而且间甲酚远不如对甲酚、苯二酚及苯酚的厌氧降解性能好〔9〕,所以生物法处理废水中间甲酚的可行性不高。
在本实验中,选择Fe(Ⅵ)作为氧化剂,以间甲酚作为目标污染物,研究了Fe(Ⅵ)投加量、溶液pH、磷酸盐缓冲液和温度对间甲酚降解动力学的影响,以期为含有高浓度酚类化合物的焦化废水的实际处理提供参考。
1 材料与方法
1.1 试剂与仪器
试剂:间甲酚,分析纯,99%,上海麦克林生化科技有限公司;甲醇,液相色谱纯;高铁酸钾(K2FeO4),分析纯,95%,购自上海易恩化学技术有限公司;亚硫酸钠、磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、硼砂、硼酸、氢氧化钠、盐酸等试剂均为分析纯,购自太原津昌华科贸有限公司。
仪器:电子天平;六联磁力搅拌器;pHS-3C型pH计,上海雷磁仪器厂;HPLC高效液相色谱仪,大连依利特分析仪器有限公司。
液相色谱检测条件:色谱柱为Agilent Zorbax XDB色谱柱,部件号990967-902,流动相组成为60%(体积分数)甲醇和40%(体积分数)水,流速为1 mL/min,紫外检测器的波长为227 nm。
1.2 实验方法
取193 μL间甲酚溶于超纯水中,用超纯水定容至100 mL,得到2 g/L的间甲酚储备液,4 ℃冷藏避光保存,每过1周重新配制。取5 mL间甲酚储备液,稀释至100 mL,得到100 mg/L的间甲酚反应液,置于200 mL烧杯中。加入一定量的高铁酸钾固体并开始计时,用磁力搅拌器混合,在反应过程中将2.5 mL反应上清液移入试管中,试管中预先加入过量的终止剂亚硫酸钠溶液,静置后,经0.22 μm的滤膜过滤,用HPLC测定反应中间甲酚的浓度。
1.3 反应动力学分析
整体反应为前30 s的初始快速反应阶段和30 s至180 s的慢速反应阶段。由于快速反应阶段产生了大量的中间产物,使得进一步反应更加复杂,所以第二阶段的反应速率变慢〔18〕。
式(1)为Fe(Ⅵ)氧化降解间甲酚的动力学方程:
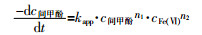
式中:kapp——表观反应速率常数;
c间甲酚、cFe(Ⅵ)——分别为间甲酚和Fe(Ⅵ)的平衡质量浓度,mg/L;
n1、n2——分别为间甲酚和Fe(Ⅵ)的反应级数,总反应级数为n= n1+n2。
当体系中Fe(Ⅵ)的浓度远大于间甲酚的浓度时,式(1)可简化为式(2)。
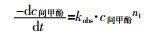
式中:kobs——反应速率常数,kobs= kapp· cFe(Ⅵ)n2。
2 结果与讨论
2.1 Fe(Ⅵ)投加量的影响
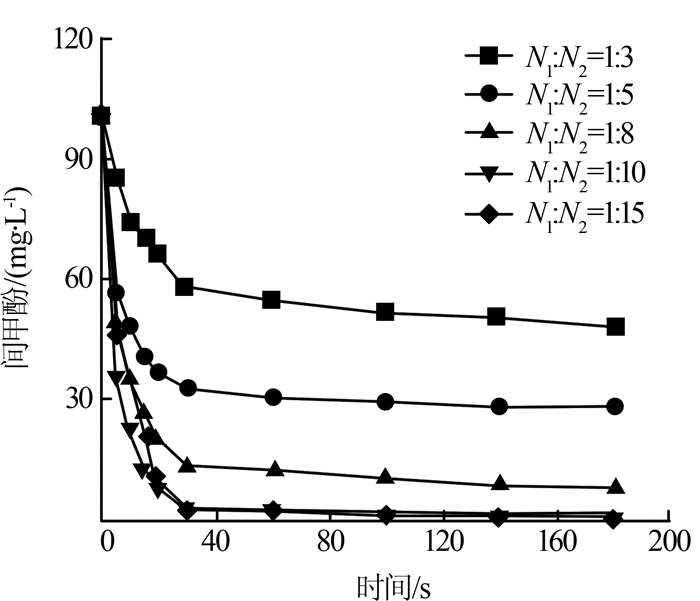
图1
表1 不同Fe(Ⅵ)投加量下的反应动力学参数
| [Fe(Ⅵ)]0/(mmol·L-1) | 动力学方程 | R2 | kobs/s-1 |
| 3.235 | y=-0.020 27x | 0.974 42 | 0.020 27 |
| 4.621 | y=-0.046 79x | 0.921 55 | 0.046 79 |
| 7.394 | y=-0.076 29x | 0.966 94 | 0.076 29 |
| 9.242 | y=-0.126 12x | 0.989 69 | 0.126 12 |
| 13.863 | y=-0.112 52x | 0.996 49 | 0.112 52 |
由图1可知,随着Fe(Ⅵ)投加量的加大,间甲酚的去除率从52.00%增加到99.83%。然而,当Fe(Ⅵ)投加量从1:10增至N1:N2=1:15时,间甲酚的去除率仅仅增加了0.94%。这可能是过量的Fe(Ⅵ)促进了自分解反应,对间甲酚的氧化降解效果造成不利影响〔19〕,这和Q. Han等〔20〕实验结果一致。虽然Fe(Ⅵ)增多会使反应进行得更彻底,但结合实际经济成本,当N1:N2=1:8时,间甲酚的去除率可达94.87%,可以满足实际需要。通过对原始数据的计算,可知n1=1,n2=1。所以Fe(Ⅵ)与间甲酚的总反应级数n等于2,即该反应符合二级反应动力学模型。相关文献报道了Fe(Ⅵ)与许多有机化合物(X)的反应性显示总体二级,与本研究的结果一致〔21〕。
2.2 pH的影响
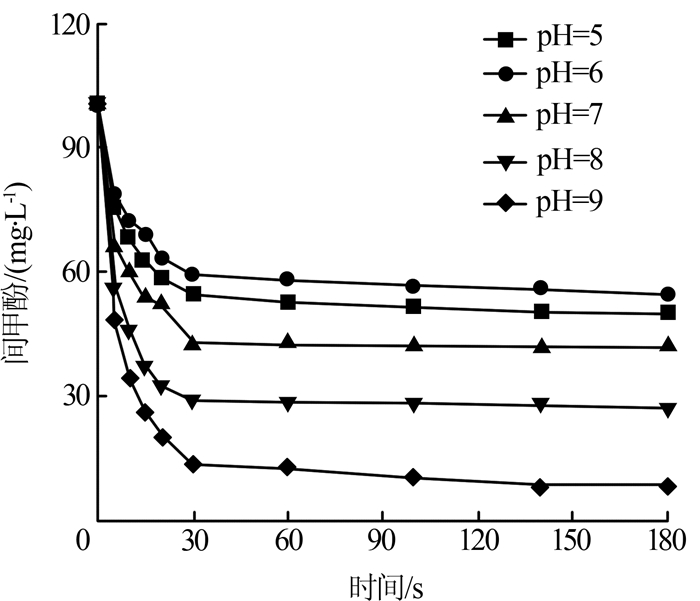
图2
表2 不同pH下的反应动力学参数
| pH | 动力学方程 | R2 | kobs/s-1 |
| 5 | y=-0.024 72x | 0.933 21 | 0.024 72 |
| 6 | y=-0.020 92x | 0.938 56 | 0.020 92 |
| 7 | y=-0.033 09x | 0.932 69 | 0.033 09 |
| 8 | y=-0.051 14x | 0.932 61 | 0.051 14 |
| 9 | y=-0.076 29x | 0.966 94 | 0.076 29 |
综上,Fe(Ⅵ)氧化间甲酚的最佳pH=9,这和C. Li等〔25〕的研究结果相符。
2.3 缓冲液的影响
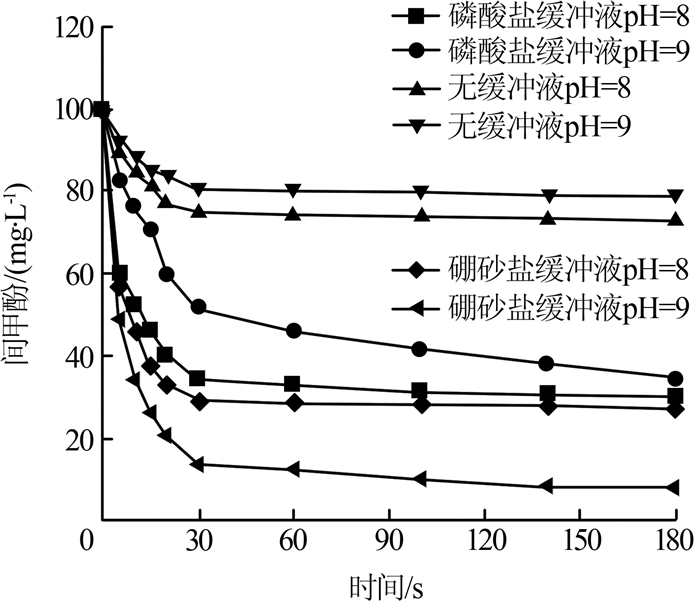
图3
表3 不同缓冲液配制方式下的反应动力学参数
| pH环境 | 动力学方程 | R2 | kobs/s-1 |
| 磷酸盐pH=8 | y=-0.042 73x | 0.935 98 | 0.042 73 |
| 磷酸盐pH=9 | y=-0.023 54x | 0.988 27 | 0.023 54 |
| 硼砂盐pH=8 | y=-0.051 14x | 0.932 61 | 0.051 14 |
| 硼砂盐pH=9 | y=-0.076 29x | 0.966 94 | 0.076 29 |
| 无缓冲溶液pH=8 | y=-0.011 70x | 0.956 23 | 0.011 70 |
| 无缓冲溶液pH=9 | y=-0.008 33x | 0.955 86 | 0.008 33 |
由表3可知,用磷酸盐缓冲液、硼砂盐缓冲液和无缓冲液调节的不同pH下间甲酚的氧化降解符合准一级反应动力学模型。在pH为8、9时,采用硼砂盐缓冲溶液配制的间甲酚氧化降解反应的准一级反应速率常数大于采用磷酸盐缓冲溶液配制的间甲酚反应速率常数,这与B. B. Shao等〔29〕的实验结果一致。一方面,磷酸盐可以被Fe(Ⅵ)有效去除,其吸附在由Fe(Ⅵ)自发形成的铁(Ⅲ)氧化物/羟基氧化物纳米颗粒的表面上,这会使得用来氧化降解间甲酚的Fe(Ⅵ)减少〔30〕。另一方面,C. Li等〔25〕研究发现,Fe(Ⅴ)和Fe(Ⅳ)转化反应生成了Fe(Ⅲ)、H2O2或O2,这使得Fe(Ⅴ)和Fe(Ⅳ)的氧化降解间甲酚的能力下降。此外,在用磷酸盐作为缓冲剂的降解间甲酚的实验中,反应结束时的淡黄色溶液有可能含有磷酸铁(Ⅲ)络合物〔31〕。因此,推断Fe(Ⅵ)在磷酸盐缓冲液中的氧化能力可能受到抑制〔22〕。
实验结果表明,磷酸盐可以对间甲酚的高铁酸盐氧化产生抑制作用,并且pH对高铁酸盐氧化间甲酚的影响作用比磷酸盐大。
2.4 温度的影响
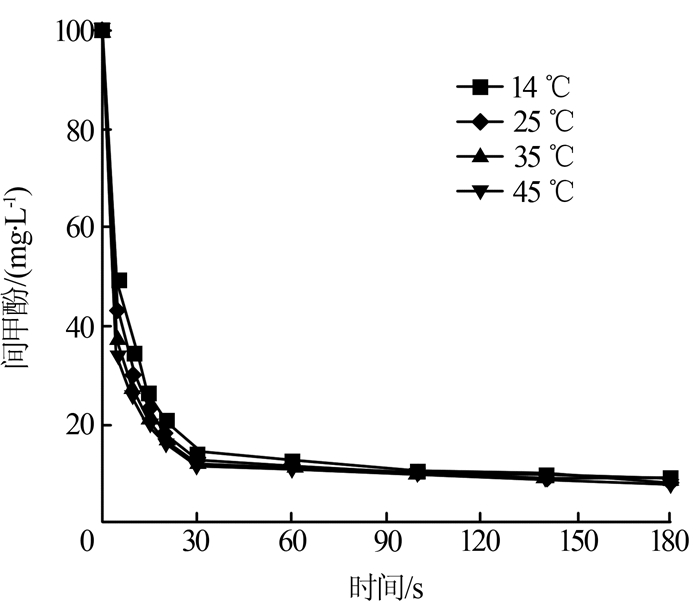
图4
表4 不同温度下的反应动力学参数
| 温度/℃ | 动力学方程 | R2 | kobs/s-1 |
| 14 | y=-0.076 30x | 0.966 91 | 0.076 30 |
| 25 | y=-0.081 67x | 0.952 92 | 0.081 67 |
| 35 | y=-0.085 51x | 0.936 96 | 0.085 51 |
| 45 | y=-0.088 66x | 0.932 11 | 0.088 66 |
lnkapp和1 000/T之间存在良好的线性关系,拟合方程为y=-0.442 79x-3.026 77。依据阿仑尼乌斯方程,在pH=9时的活化能计算为3.77 kJ/mol,这说明Fe(Ⅵ)与间甲酚的反应极易发生,反应速率非常快。
ln(kapp/T)和1/T之间存在良好的线性关系,拟合方程为y=-140.82x-9.7378,根据Eying公式,该反应的焓变ΔH为16.94 kJ/mol,熵变ΔS为-278.51 J/(mol·K),这说明间甲酚和Fe(Ⅵ)的反应是吸热反应。
3 结论
(1)通过单因素实验,得到Fe(Ⅵ)氧化降解间甲酚的最佳条件。在最佳条件为pH=9,间甲酚和Fe(Ⅵ)的物质的量比为1:8,温度为14 ℃时,反应180 s后间甲酚的去除率为91.84%。前30 s快速反应阶段,间甲酚的降解速率符合准一级反应动力学模型,Fe(Ⅵ)与间甲酚的反应符合二级反应动力学模型。
(2)在Fe(Ⅵ)投加量不同的条件下,随着Fe(Ⅵ)用量的增加,间甲酚的去除率及Fe(Ⅵ)与间甲酚的准一级反应动力学常数均呈非线性增加。使用硼砂盐缓冲溶液调节的pH对Fe(Ⅵ)氧化降解间甲酚的影响较大,在碱性条件下比酸性及中性条件下的准一级反应速率常数大。
(3)在使用硼砂盐、磷酸盐和无缓冲液调节反应液pH为8、9的条件下,进行Fe(Ⅵ)氧化降解间甲酚的实验,结果表明,磷酸盐可以对间甲酚的Fe(Ⅵ)氧化产生抑制作用,这对更大地发挥Fe(Ⅵ)对实际含酚工业废水的处理效果具有一定参考作用。
(4)Fe(Ⅵ)与间甲酚的反应过程的活化能为3.77 kJ/mol,表明反应很容易发生。随着温度的增加,准一级反应动力学常数变大,间甲酚的去除率略有下降。
参考文献
工业含酚废水的处理研究
[J].DOI:10.3969/j.issn.1001-9677.2014.08.010 [本文引用: 1]
焦化废水水质组成及其环境学与生物学特性分析
[J].DOI:10.3321/j.issn:0253-2468.2007.07.004 [本文引用: 1]
Rapid removal of organic pollutants by activation sulfite with ferrate
[J].DOI:10.1016/j.chemosphere.2017.07.102 [本文引用: 1]
Inhibition of pure cultures of methanogens by benzene ring compounds
[J].DOI:10.1128/AEM.57.10.2969-2974.1991
Aerobic degradation of phenolics and aromatic hydrocarbons in presence of cyanide
[J].DOI:10.1016/j.biortech.2012.06.039 [本文引用: 1]
Anaerobic biogranulation using phenol as the sole carbon source
[J].DOI:10.2175/106143000X137275 [本文引用: 1]
Anaerobic treatment of phenolic coal conversion wastewater in semicontinuous cultures
[J].
Review on high valent FeⅥ (Ferrate):A sustainable Green oxidant in organic chemistry and transformation of pharmaceuticals
[J].
Formation and toxicity of brominated disinfection byproducts during chlorination and chloramination of water:A review
[J].DOI:10.1080/03601234.2014.858576 [本文引用: 1]
Oxidation of inorganic contaminants by ferrates (Ⅵ, Ⅴ, and Ⅳ)-kinetics and mechanisms:A review
[J].DOI:10.1016/j.jenvman.2010.11.026 [本文引用: 1]
Mechanism for the oxidation of phenol by sulfatoferrate(Ⅵ):Comparison with various oxidants
[J].
Kinetic investigations of quinoline oxidation by ferrate(Ⅵ)
[J].DOI:10.1080/09593330.2015.1111424 [本文引用: 1]
Oxidation of inorganic compounds by aqueous permanganate:Kinetics and initial electron transfer steps
[J].DOI:10.1016/j.seppur.2017.04.015 [本文引用: 1]
Transformation of substituted anilines by ferrate(Ⅵ):Kinetics, pathways, and effect of dissolved organic matter
[J].DOI:10.1016/j.cej.2017.08.116 [本文引用: 1]
Impact of phosphate on ferrate oxidation of organic compounds:an underestimated oxidant
[J].
Factors affecting stability of aqueous potassium ferrate(Ⅵ) solutions
[J].DOI:10.1021/ac60069a037 [本文引用: 1]
Degradation of bisphenol A by ferrate(Ⅵ) oxidation:Kinetics, products and toxicity assessment
[J].DOI:10.1016/j.cej.2014.09.071 [本文引用: 1]
Ferrate(Ⅵ) and ferrate(Ⅴ) oxidation of organic compounds:Kinetics and mechanism
[J].DOI:10.1016/j.ccr.2012.04.014 [本文引用: 2]
The heat, free energy and entropy of the ferrate(Ⅵ) ion
[J].DOI:10.1021/ja01542a002 [本文引用: 4]
Mossbauer characterization and in situ monitoring of thermal decomposition of potassium ferrate(Ⅵ), K2FeO4 in static air conditions
[J].DOI:10.1021/jp068272x [本文引用: 1]
Reaction of ferrate(Ⅵ) with ABTS and self-decay of ferrate(Ⅵ):kinetics and mechanisms
[J].
A study of the preparation and reactivity of potassium ferrate
[J].DOI:10.1016/j.chemosphere.2005.02.027 [本文引用: 3]
Studies of the diiron(Ⅵ) intermediate in ferrate-dependent oxygen evolution from water
[J].DOI:10.1021/ja304786s [本文引用: 1]
Ferrate(Ⅵ) and ferrate(Ⅴ) oxidation of cyanide, Thiocyanate, and copper(Ⅰ) cyanide
[J].DOI:10.1016/j.radphyschem.2007.11.004 [本文引用: 1]
Oxidation of inorganic contaminants by ferrates (Ⅵ):A review
[J].
Role of ferrate(Ⅳ) and ferrate (Ⅴ) in activating ferrate(Ⅵ) by calcium sulfite for enhanced oxidation of organic contaminants
[J].
Remarkable efficiency of phosphate removal:Ferrate(Ⅵ)-induced in situ sorption on coreshell nanoparticles
[J].DOI:10.1016/j.watres.2016.07.021 [本文引用: 1]
Mechanism of water oxidation by ferrate(Ⅵ) at ph 7-9
[J].DOI:10.1002/chem.201803757 [本文引用: 1]
Mechanism of isotopic oxygen exchange and reduction of ferrate(Ⅵ) ion (FeO42-)
[J].DOI:10.1021/ja00752a016 [本文引用: 1]
Factors affecting stability of aqueous potassium ferrate(Ⅵ) solutions
[J].DOI:10.1021/ac60069a037 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号