Preparation of silver nanoparticles/polydopamine functionalized polyacrylonitrile fiber paper and its catalytic activity for the reduction 4-nitrophenol
1
2017
... 地下水的溶解氧(DO)水平是控制污染地下水原位生物修复的关键参数.由于地下水溶解氧含量较低,在自然条件下很难发生好氧微生物降解,污染严重的地区常常出现厌氧条件.为了加速工业污染场地的原位生物修复,经常需要向受污染区域提供氧气〔1〕.部分固体氧化剂(Na2CO3·1.5H2O2、CaO2、MgO2等)可以在水中缓慢溶解,并落入反应受限的区域,这些组分迅速在其表面释放氧,表现出受溶解过程的化学动力学控制〔2〕.过氧化钙(CaO2)与其他金属过氧化物(MgO2、ZnO2)相比,在水和土壤中使用相对绿色安全,对环境影响较小. ...
Kinetics and stoichiometry of oxygen release from solid peroxides
1
1999
... 地下水的溶解氧(DO)水平是控制污染地下水原位生物修复的关键参数.由于地下水溶解氧含量较低,在自然条件下很难发生好氧微生物降解,污染严重的地区常常出现厌氧条件.为了加速工业污染场地的原位生物修复,经常需要向受污染区域提供氧气〔1〕.部分固体氧化剂(Na2CO3·1.5H2O2、CaO2、MgO2等)可以在水中缓慢溶解,并落入反应受限的区域,这些组分迅速在其表面释放氧,表现出受溶解过程的化学动力学控制〔2〕.过氧化钙(CaO2)与其他金属过氧化物(MgO2、ZnO2)相比,在水和土壤中使用相对绿色安全,对环境影响较小. ...
Application of calcium peroxide in water and soil treatment:a review
5
2017
... 过氧化钙在水中的溶解度很低,与水反应很慢,是最稳定的无机过氧化物之一,与含水介质接触时能以可控速率缓慢与水反应并释放出氧气,为土壤和地下水连续供氧.过氧化钙可通过H2O2与石灰反应制得,在现场很容易制备,成本低廉,操作简便〔3〕,因此成为地下水污染生物修复中好氧微生物的新供氧源.过氧化钙与水反应的产物H2O2还能进一步分解为羟基自由基(·OH)〔4〕,是一种非选择性强氧化剂,能氧化分解水体中的多种有机物〔5〕.但过氧化钙缓释技术实际应用于地下水污染修复工程还面临着需进一步延长氧气释放时间,克服试剂直接注入时pH升高过快等诸多局限. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 过氧化钙进行纳米改性可以显著降低其粒径,提高比表面积,优化过氧化钙的性能.纳米过氧化钙的改性方法分为物理法和化学法.其中物理方法是以机械接地单元为基础制备Ca(OH)2纳米粒子,并与H2O2发生后续反应〔3〕.化学方法则使用化学稳定剂来避免钙化合物前驱体〔如Ca(OH)2、CaCl2和Ca(NO3)2〕与H2O2反应生成纳米粒子的不可逆团聚〔21〕.纳米过氧化钙较常规具有以下特点:(1)高反应性,过氧化钙的巨大比表面积增加了过氧化钙与污染物的反应位点,使得过氧化钙去除污染物的速率非常快,大大缩短了环境修复时间〔22〕;(2)良好的分散性和迁移性,改性后的纳米CaO2颗粒直径和粒径均匀分布,因而颗粒分散性和迁移性更好,不会出现严重的团聚现象;(3)吸附性〔23〕,纳米CaO2具有巨大的比表面积,污染物更容易吸附在其表面. ...
... 经过多年的实验室研究,改性过氧化钙已被用于实际污染场地的修复.Guoxin Huang等〔11〕提出了一种过氧化钙释氧微球和斜沸石为填料的PRB系统,用于去除地下水中的铵态氮.实验中氨氮几乎完全耗尽,NH4+-N主要转化为NO3--N,少量转化为NO2--N,说明生物硝化作用对NH4+-N的去除起主导作用.在此基础上将该系统用于全尺寸连续式PRB墙体系统,在实际应用中取得良好的效果.ORIN公司直接向被石油污染的地下水中注入纳米过氧化钙,通过增强的生物修复化学成功修复了被石油污染的土壤和地下水.4个月时间内,不饱和污染物水平从2 900 mg/L降至低于检测值〔3〕.ORIN公司还尝试使用专用的高压泵向污染土壤、地下水注入硫酸钠和纳米过氧化钙混合试剂,在注入修复剂过程中监测到羽状流井中的关键地下水参数(如DO、pH、氧化还原电位、电导率)增加,4个月内污染物从4 700 μg/L降至1.8 μg/L〔38〕.与传统的修复方法相比,使用纳米过氧化钙化学注射不仅修复效率高,而且更加快捷、便宜.Aztech技术公司〔3〕在原位化学氧化中使用过氧化钙产生自由基氧化石油污染场地的污染物,过氧化钙缓慢溶解释放的过氧化氢在合适的催化剂(如溶解的铁)的存在下,发生改良Fenton化学反应,施用修复剂后现场监测井中的溶解氧、比电导和氧化还原电位都有上升,达到预期的修复效果. ...
... 〔3〕在原位化学氧化中使用过氧化钙产生自由基氧化石油污染场地的污染物,过氧化钙缓慢溶解释放的过氧化氢在合适的催化剂(如溶解的铁)的存在下,发生改良Fenton化学反应,施用修复剂后现场监测井中的溶解氧、比电导和氧化还原电位都有上升,达到预期的修复效果. ...
Fenton-like degradation of 2, 4-dichlorophenol using calcium peroxide particles:performance and mechanisms
1
2017
... 过氧化钙在水中的溶解度很低,与水反应很慢,是最稳定的无机过氧化物之一,与含水介质接触时能以可控速率缓慢与水反应并释放出氧气,为土壤和地下水连续供氧.过氧化钙可通过H2O2与石灰反应制得,在现场很容易制备,成本低廉,操作简便〔3〕,因此成为地下水污染生物修复中好氧微生物的新供氧源.过氧化钙与水反应的产物H2O2还能进一步分解为羟基自由基(·OH)〔4〕,是一种非选择性强氧化剂,能氧化分解水体中的多种有机物〔5〕.但过氧化钙缓释技术实际应用于地下水污染修复工程还面临着需进一步延长氧气释放时间,克服试剂直接注入时pH升高过快等诸多局限. ...
Study on the generation mechanism of reactive oxygen species on calcium peroxide by chemiluminescence and UV-visible spectra
3
2007
... 过氧化钙在水中的溶解度很低,与水反应很慢,是最稳定的无机过氧化物之一,与含水介质接触时能以可控速率缓慢与水反应并释放出氧气,为土壤和地下水连续供氧.过氧化钙可通过H2O2与石灰反应制得,在现场很容易制备,成本低廉,操作简便〔3〕,因此成为地下水污染生物修复中好氧微生物的新供氧源.过氧化钙与水反应的产物H2O2还能进一步分解为羟基自由基(·OH)〔4〕,是一种非选择性强氧化剂,能氧化分解水体中的多种有机物〔5〕.但过氧化钙缓释技术实际应用于地下水污染修复工程还面临着需进一步延长氧气释放时间,克服试剂直接注入时pH升高过快等诸多局限. ...
... 关于过氧化钙的自由基释放机理仍存在争议,许多研究对过氧化钙产生自由基的机理提出了不同解释.S. Qin等〔34〕假设过氧化钙上存在自由基,并在细胞反应实验中检测到自由基(·OH)的产生.J. Ramo等〔35〕发现过氧化钙上过氧化氢阴离子(HOO-)的产生,但并没有进一步研究.P. Christel等〔36〕处理过氧化钙得到过氧化钙和过氧化氢的结晶CaO2·2H2O2,发光光谱表明CaO2·2H2O2可以释放单线态氧(1O2).Yong Ma等〔5〕证明了过氧化钙表面活性氧还包括另一种超氧阴离子(O2·-).显然,过氧化钙产生的自由基是CaO2降解污染物的主要因素,但目前尚未明确其自由基释放机制,需要进一步研究. ...
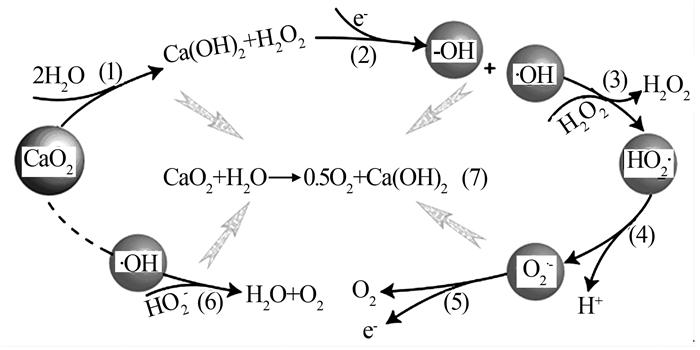
... Yong Ma等〔5〕通过化学发光法、UV-Vis光谱和特殊的自由基有效清除剂测定了各种自由基清除剂对氯离子释放强度的影响,探讨了自由基(·OH、O2·-等)在氧化钙上可能的生成机制(如图 2所示).以往研究发现,过氧化钙能在潮湿的空气中发生缓慢的分解反应(1),CaO2与H2O反应可以缓慢生成H2O2,因而CaO2有“固体过氧化氢”的称号〔27〕,通过在碱土金属过氧化物的悬浮液中获得单电子,H2O2能够容易地经历氧化还原以提供·OH,随后系统进行反应(3)和(4);自由基存在时间很短(如·OH~10-6 s;O2·-~0.1 s),很快被反应(5)和(6)消耗,基于以上讨论提出了CaO2与水的总反应作为反应(7).对于不同的碱土金属过氧化物,悬浮液的条件(如溶解度和pH)相同,自由基的形成过程也可能相似.不同碱土金属过氧化物生成自由基的主要区别在于每一步的反应速度.例如·OH是MgO2的主要自由基,因为其反应(2)的速度比反应(3)的快;而O2·-是BaO2反应生成的主要自由基,反应过程中反应(3)的反应速度比反应(2)的速度快.1%CaO2水溶液的pH约为12,在强碱性条件下HO2·容易转化为O2·-,故CaO2反应形成的主要自由基为O2·-.这项研究不仅证实了过氧化钙能释放·OH,而且还证实它也能释放O2·-.·OH和O2·-是CaO2的主要自由基,与其性质相似的碱土金属过氧化物(MgO2仅释放·OH,BaO2仅释放O2·-)相比,可以同时释放·OH和O2·-的CaO2表现出良好的转化性能. ...
1
... 与其他过氧化物或化学氧化剂相比,过氧化钙具有更好的热稳定性,更长的释放时间和可接受的成本,无二次污染,在实验室大量研究基础上成功应用于现场修复.在工程应用中,过氧化钙以粉末状或浆状被引入地下水和土壤中〔6〕,为提高过氧化钙在复杂地下水环境条件下的释氧能力,技术人员对过氧化钙进行了改性操作,主要包括可控释放和材料的纳米化. ...
Laboratory column study for remediation of MTBE-contaminated groundwater using a biological two-layer permeable barrier
2
2006
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Evaluating a novel permeable reactive bio-barrier to remediate PAH-contaminated groundwater
2
2019
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Naphthalene remediation form groundwater by calcium peroxide(CaO2) nanoparticles in permeable reactive barrier(PRB)
1
2018
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Improvement of oxygen release from calcium peroxide-polyvinyl alcohol beads by adding low-cost bamboo biochar and its application in bioremediation
4
2015
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 〔
10〕
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等.将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时,蓄水层渗透性显著降低.包封过氧化钙的复合材料中也常加入pH缓冲液,以控制过氧化钙在应用过程中pH升高.在地下水中添加过氧化钙通常会使环境pH迅速提高到10~12,虽然地下水有缓冲能力,可抵消pH变化,但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕.一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕.改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH快速升高的现象. ...
Removal of ammonium-nitrogen from groundwater using a fully passive permeable reactive barrier with oxygen-releasing compound and clinoptilolite
3
2015
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 经过多年的实验室研究,改性过氧化钙已被用于实际污染场地的修复.Guoxin Huang等〔11〕提出了一种过氧化钙释氧微球和斜沸石为填料的PRB系统,用于去除地下水中的铵态氮.实验中氨氮几乎完全耗尽,NH4+-N主要转化为NO3--N,少量转化为NO2--N,说明生物硝化作用对NH4+-N的去除起主导作用.在此基础上将该系统用于全尺寸连续式PRB墙体系统,在实际应用中取得良好的效果.ORIN公司直接向被石油污染的地下水中注入纳米过氧化钙,通过增强的生物修复化学成功修复了被石油污染的土壤和地下水.4个月时间内,不饱和污染物水平从2 900 mg/L降至低于检测值〔3〕.ORIN公司还尝试使用专用的高压泵向污染土壤、地下水注入硫酸钠和纳米过氧化钙混合试剂,在注入修复剂过程中监测到羽状流井中的关键地下水参数(如DO、pH、氧化还原电位、电导率)增加,4个月内污染物从4 700 μg/L降至1.8 μg/L〔38〕.与传统的修复方法相比,使用纳米过氧化钙化学注射不仅修复效率高,而且更加快捷、便宜.Aztech技术公司〔3〕在原位化学氧化中使用过氧化钙产生自由基氧化石油污染场地的污染物,过氧化钙缓慢溶解释放的过氧化氢在合适的催化剂(如溶解的铁)的存在下,发生改良Fenton化学反应,施用修复剂后现场监测井中的溶解氧、比电导和氧化还原电位都有上升,达到预期的修复效果. ...
Remediation of PCE-contaminated aquifer by an in situ two-layer biobarrier:laboratory batch and column studies
3
2003
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等.将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时,蓄水层渗透性显著降低.包封过氧化钙的复合材料中也常加入pH缓冲液,以控制过氧化钙在应用过程中pH升高.在地下水中添加过氧化钙通常会使环境pH迅速提高到10~12,虽然地下水有缓冲能力,可抵消pH变化,但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕.一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕.改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH快速升高的现象. ...
Fabrication of novel oxygen-releasing alginate beads as an efficient oxygen carrier for the enhancement of aerobic bioremediation of 1, 4-dioxane contaminated groundwater
2
2014
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等.将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时,蓄水层渗透性显著降低.包封过氧化钙的复合材料中也常加入pH缓冲液,以控制过氧化钙在应用过程中pH升高.在地下水中添加过氧化钙通常会使环境pH迅速提高到10~12,虽然地下水有缓冲能力,可抵消pH变化,但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕.一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕.改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH快速升高的现象. ...
Bioremediation of benzene from groundwater by calcium peroxide(CaO2) nanoparticles encapsulated in sodium alginate
2
2017
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
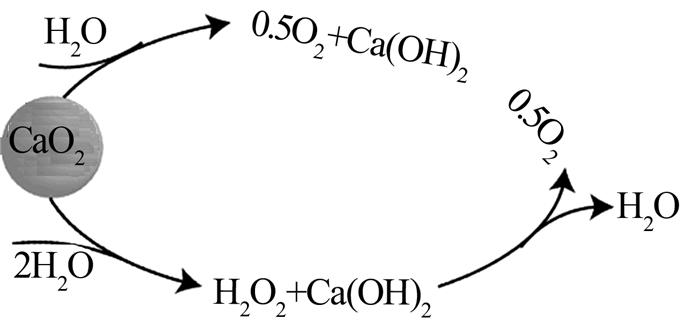
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Preparation and application of oxygen slow-releasing materials for in situ manganese removal from groundwater
1
2019
... 受控过氧化钙缓释技术研究
| 名称 | 主要组分 | 目标污染物 | 效果 | 参考文献 |
| 生物渗透屏障 | 过氧化钙、KH2PO4、(NH4)2SO4和膨胀珍珠岩颗粒包裹的微生物 | 地下水中的甲基叔丁基醚(MTBE) | 800 h内约50%的MTBE被有效去除 | 〔7〕 |
| 透水反应屏障 | 椰子壳生物炭、硅藻土、过氧化钙 | 地下水中多环芳烃 | 多环芳烃基本被去除 | 〔8〕 |
| 透水反应屏障 | 叠氮化钠、过氧化钙、沙子、浮石 | 地下水中萘 | 50 d内基本除去萘
100 d持续释放氧气 | 〔9〕 |
| 被动渗透反应性屏障 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的苯系物(BETX) | 104 d内持续释放氧气 | 〔10〕 |
| 透水反应屏障 | 释氧化合物(ORC)微球、斜沸石、河砂 | 地下水中的铵态氮 | 氨氮几乎完全耗尽,转化为NO3--N、NO2--N | 〔11〕 |
| 混凝土立方块 | 过氧化钙、水泥、砂、粉煤灰、氯化铵、磷酸钾和水质量比为1.5:1.4:0.7:1.3:0.7:0.8:2 | 地下水中的四氯乙烯(PCE) | 100 d内持续释放氧气,50 d内去除大多数的PCE | 〔12〕 |
| 生物炭球 | 过氧化钙、柠檬酸盐、聚乙烯醇和竹子生物炭的质量比为20:2.2:9.2:31.5 | 地下水中的BETX | 104 d内持续释放氧气,可快速去除99%甲苯 | 〔10〕 |
| 新型释氧藻酸盐珠 | 过氧化钙、海藻酸钠、三氯化铝 | 地下水中的1,4-二氧环己烷 | 10 d内去除99%的1,4-二氧环己烷 | 〔13〕 |
| 释氧剂球 | 海藻酸钠包裹过氧化钙和硫酸亚铁 | 地下水中的苯 | 60 d完全去除地下水中的苯,70 d内持续释放氧气 | 〔14〕 |
| 过氧化钙/石蜡释氧剂 | 过氧化钙:石蜡:高岭土:河砂质量比为1.67:50:2:30 | 地下水中的锰 | 7 d内持续释放氧气,能有效去除地下水中锰 | 〔15〕 |
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Chemistry and microbiology of permeable reactive barriers for in situ groundwater clean up
1
2000
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Permeable reactive barrier for groundwater remediation
1
2008
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
Degradation of trichloroethylene in aqueous solution by calcium peroxide activated with ferrous ion
1
2015
... 渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触,其氧释放速率可通过混凝土压块的大小来控制〔3〕.在PRB中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法.在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕.Cuicui Liu等〔8〕通过透水反应屏障修复PAH污染的地下水,实验发现100 d内加入50 g过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L.此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力,能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果.与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点. ...
A permeable reactive barrier for the bioremediation of BTEX-contaminated groundwater:microbial community distribution and removal efficiencies
1
2010
... 用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等.将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时,蓄水层渗透性显著降低.包封过氧化钙的复合材料中也常加入pH缓冲液,以控制过氧化钙在应用过程中pH升高.在地下水中添加过氧化钙通常会使环境pH迅速提高到10~12,虽然地下水有缓冲能力,可抵消pH变化,但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕.一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕.改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH快速升高的现象. ...
Examination of the disinfecting properties of calcium peroxide and its suitability for improving hydrodynamic characteristics of surface water bodies
1
2012
... 用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等.将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时,蓄水层渗透性显著降低.包封过氧化钙的复合材料中也常加入pH缓冲液,以控制过氧化钙在应用过程中pH升高.在地下水中添加过氧化钙通常会使环境pH迅速提高到10~12,虽然地下水有缓冲能力,可抵消pH变化,但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕.一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕.改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH快速升高的现象. ...
Multicatalytic properties of nanoparticle CaO2 synthesized by a novel, simple and economical method for wastewater treatment
1
2016
... 过氧化钙进行纳米改性可以显著降低其粒径,提高比表面积,优化过氧化钙的性能.纳米过氧化钙的改性方法分为物理法和化学法.其中物理方法是以机械接地单元为基础制备Ca(OH)2纳米粒子,并与H2O2发生后续反应〔3〕.化学方法则使用化学稳定剂来避免钙化合物前驱体〔如Ca(OH)2、CaCl2和Ca(NO3)2〕与H2O2反应生成纳米粒子的不可逆团聚〔21〕.纳米过氧化钙较常规具有以下特点:(1)高反应性,过氧化钙的巨大比表面积增加了过氧化钙与污染物的反应位点,使得过氧化钙去除污染物的速率非常快,大大缩短了环境修复时间〔22〕;(2)良好的分散性和迁移性,改性后的纳米CaO2颗粒直径和粒径均匀分布,因而颗粒分散性和迁移性更好,不会出现严重的团聚现象;(3)吸附性〔23〕,纳米CaO2具有巨大的比表面积,污染物更容易吸附在其表面. ...
1
... 过氧化钙进行纳米改性可以显著降低其粒径,提高比表面积,优化过氧化钙的性能.纳米过氧化钙的改性方法分为物理法和化学法.其中物理方法是以机械接地单元为基础制备Ca(OH)2纳米粒子,并与H2O2发生后续反应〔3〕.化学方法则使用化学稳定剂来避免钙化合物前驱体〔如Ca(OH)2、CaCl2和Ca(NO3)2〕与H2O2反应生成纳米粒子的不可逆团聚〔21〕.纳米过氧化钙较常规具有以下特点:(1)高反应性,过氧化钙的巨大比表面积增加了过氧化钙与污染物的反应位点,使得过氧化钙去除污染物的速率非常快,大大缩短了环境修复时间〔22〕;(2)良好的分散性和迁移性,改性后的纳米CaO2颗粒直径和粒径均匀分布,因而颗粒分散性和迁移性更好,不会出现严重的团聚现象;(3)吸附性〔23〕,纳米CaO2具有巨大的比表面积,污染物更容易吸附在其表面. ...
Development of a cost-effective technique to remove the arsenic contamination from aqueous solutions by calcium peroxide nanoparticles
1
2012
... 过氧化钙进行纳米改性可以显著降低其粒径,提高比表面积,优化过氧化钙的性能.纳米过氧化钙的改性方法分为物理法和化学法.其中物理方法是以机械接地单元为基础制备Ca(OH)2纳米粒子,并与H2O2发生后续反应〔3〕.化学方法则使用化学稳定剂来避免钙化合物前驱体〔如Ca(OH)2、CaCl2和Ca(NO3)2〕与H2O2反应生成纳米粒子的不可逆团聚〔21〕.纳米过氧化钙较常规具有以下特点:(1)高反应性,过氧化钙的巨大比表面积增加了过氧化钙与污染物的反应位点,使得过氧化钙去除污染物的速率非常快,大大缩短了环境修复时间〔22〕;(2)良好的分散性和迁移性,改性后的纳米CaO2颗粒直径和粒径均匀分布,因而颗粒分散性和迁移性更好,不会出现严重的团聚现象;(3)吸附性〔23〕,纳米CaO2具有巨大的比表面积,污染物更容易吸附在其表面. ...
Feasibility study of using calcium peroxide nanoparticles in arsenic removal from polluted water in agriculture and it's effect on the irrigation quality parameters
2
2012
... 实验室研究表明,纳米过氧化钙的添加对地下水无明显不良影响,并具有高效去除地下水中As(Ⅲ)〔24〕和有机污染物的潜力〔25〕.Yajie Qian等〔26-27〕降解2,4-DCP时发现,用相同质量浓度(10 mg/L)的nCaO2和CaO2降解30 mg/L 2,4-DCP,nCaO2可在5 d内完全降解2,4-DCP,而CaO2的降解率只有75%.nCaO2的比表面积为62.23 m2/g,几乎是CaO2的3倍(24.08 m2/g),能提供更多的反应位点.纳米过氧化钙颗粒的粒度小、比表面积大,在土壤和地下水中能很好地分布和迁移,其强吸附性、高反应性可以加快颗粒与污染物的反应,缩短反应时间,达到更加快速、有效去除污染物的目的.表 2总结了纳米过氧化钙在地下水污染修复中的研究进展. ...
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Benzene-contaminated groundwater remediation using calcium peroxide nanoparticles:synthesis and process optimization
2
2017
... 实验室研究表明,纳米过氧化钙的添加对地下水无明显不良影响,并具有高效去除地下水中As(Ⅲ)〔24〕和有机污染物的潜力〔25〕.Yajie Qian等〔26-27〕降解2,4-DCP时发现,用相同质量浓度(10 mg/L)的nCaO2和CaO2降解30 mg/L 2,4-DCP,nCaO2可在5 d内完全降解2,4-DCP,而CaO2的降解率只有75%.nCaO2的比表面积为62.23 m2/g,几乎是CaO2的3倍(24.08 m2/g),能提供更多的反应位点.纳米过氧化钙颗粒的粒度小、比表面积大,在土壤和地下水中能很好地分布和迁移,其强吸附性、高反应性可以加快颗粒与污染物的反应,缩短反应时间,达到更加快速、有效去除污染物的目的.表 2总结了纳米过氧化钙在地下水污染修复中的研究进展. ...
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Degradation of 2, 4-dichlorophenol by nanoscale calcium peroxide:implication for groundwater remediation
2
2016
... 实验室研究表明,纳米过氧化钙的添加对地下水无明显不良影响,并具有高效去除地下水中As(Ⅲ)〔24〕和有机污染物的潜力〔25〕.Yajie Qian等〔26-27〕降解2,4-DCP时发现,用相同质量浓度(10 mg/L)的nCaO2和CaO2降解30 mg/L 2,4-DCP,nCaO2可在5 d内完全降解2,4-DCP,而CaO2的降解率只有75%.nCaO2的比表面积为62.23 m2/g,几乎是CaO2的3倍(24.08 m2/g),能提供更多的反应位点.纳米过氧化钙颗粒的粒度小、比表面积大,在土壤和地下水中能很好地分布和迁移,其强吸附性、高反应性可以加快颗粒与污染物的反应,缩短反应时间,达到更加快速、有效去除污染物的目的.表 2总结了纳米过氧化钙在地下水污染修复中的研究进展. ...
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Performance and properties of nanoscale calcium peroxide for toluene removal
3
2013
... 实验室研究表明,纳米过氧化钙的添加对地下水无明显不良影响,并具有高效去除地下水中As(Ⅲ)〔24〕和有机污染物的潜力〔25〕.Yajie Qian等〔26-27〕降解2,4-DCP时发现,用相同质量浓度(10 mg/L)的nCaO2和CaO2降解30 mg/L 2,4-DCP,nCaO2可在5 d内完全降解2,4-DCP,而CaO2的降解率只有75%.nCaO2的比表面积为62.23 m2/g,几乎是CaO2的3倍(24.08 m2/g),能提供更多的反应位点.纳米过氧化钙颗粒的粒度小、比表面积大,在土壤和地下水中能很好地分布和迁移,其强吸附性、高反应性可以加快颗粒与污染物的反应,缩短反应时间,达到更加快速、有效去除污染物的目的.表 2总结了纳米过氧化钙在地下水污染修复中的研究进展. ...
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
... Yong Ma等〔5〕通过化学发光法、UV-Vis光谱和特殊的自由基有效清除剂测定了各种自由基清除剂对氯离子释放强度的影响,探讨了自由基(·OH、O2·-等)在氧化钙上可能的生成机制(如图 2所示).以往研究发现,过氧化钙能在潮湿的空气中发生缓慢的分解反应(1),CaO2与H2O反应可以缓慢生成H2O2,因而CaO2有“固体过氧化氢”的称号〔27〕,通过在碱土金属过氧化物的悬浮液中获得单电子,H2O2能够容易地经历氧化还原以提供·OH,随后系统进行反应(3)和(4);自由基存在时间很短(如·OH~10-6 s;O2·-~0.1 s),很快被反应(5)和(6)消耗,基于以上讨论提出了CaO2与水的总反应作为反应(7).对于不同的碱土金属过氧化物,悬浮液的条件(如溶解度和pH)相同,自由基的形成过程也可能相似.不同碱土金属过氧化物生成自由基的主要区别在于每一步的反应速度.例如·OH是MgO2的主要自由基,因为其反应(2)的速度比反应(3)的快;而O2·-是BaO2反应生成的主要自由基,反应过程中反应(3)的反应速度比反应(2)的速度快.1%CaO2水溶液的pH约为12,在强碱性条件下HO2·容易转化为O2·-,故CaO2反应形成的主要自由基为O2·-.这项研究不仅证实了过氧化钙能释放·OH,而且还证实它也能释放O2·-.·OH和O2·-是CaO2的主要自由基,与其性质相似的碱土金属过氧化物(MgO2仅释放·OH,BaO2仅释放O2·-)相比,可以同时释放·OH和O2·-的CaO2表现出良好的转化性能. ...
1
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Degradation of trichloroethylene in aqueous solution by nanoscale calcium peroxide in the Fe(Ⅱ)-based catalytic environments
1
2019
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Bioremediation of benzene-contaminated groundwater by calcium peroxide(CaO2) nanoparticles:continuous-flow and biodiversity studies
1
2019
... 纳米过氧化钙在地下水污染修复中应用研究进展
| 污染物 | 纳米粒子大小 | 合成方法 | 去除性能 | 参考文献 |
| As(Ⅲ) | 25~50 nm | 化学沉淀法 | 对水中的重要参数没有任何不良影响,能去除水中88%As(Ⅲ) | 〔24〕 |
| 碳氢化合物 | 120 nm | 机械法 | 高达800 mg/L的苯被完全氧化,溶液中的汽油污染物在24 h内显着减少 | 〔28〕 |
| 2,4-二氯苯酚、甲苯 | <150 nm | 化学法 | 在5 d内基本降解2,4-二氯苯酚,3 d内完全降解甲苯 | 〔26〕~〔27〕 |
| 苯 | 50 nm | 化学沉淀法 | 70 d内纳米颗粒能够连续向水中释放氧气,在生物条件下施用400 mg/L CaO2能够在60 d后从地下水中完全去除苯 | 〔25〕 |
| 苯、石油烃 | 50 nm | 化学沉淀法 | Fe2+存在情况下,CaO2对污染物的去除能力更高,4 d后从地下水中完全去除苯 | 〔14〕 |
| 三氯乙烯 | 50~200 nm | 化学法 | 180 min内可去除86.1%三氯乙烯 | 〔29〕 |
| 苯 | 50 nm | 化学沉淀法 | 过氧化钙纳米粒子能大幅提高苯的去除效率和浮游细菌的数量,但会略微降低微生物种群的丰富度 | 〔30〕 |
2 过氧化钙缓释过程机制及主要影响因素2.1 氧气的释放过氧化钙持续释放氧的能力为给水体、土壤连续供给氧气提供了可能.随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图 1所示. ...
Stimulated growth of aerobic microbes using calcium peroxide
1
2006
... 根据化学计量学,过氧化钙的含氧量为0.222 2 g/g.Shejiang Liu等〔31〕以开发好氧微生物供氧技术为主要目的,采用间歇实验法研究了不同条件下过氧化钙的释氧速率、过氧化钙添加量对pH的影响,研究发现过氧化钙(0.45~2.5 g/L)的释氧过程包括3个阶段:第1阶段在15 min内完成,其中溶解氧迅速增加到溶解氧最大值的30%~50%(约为7.2~12 mg/h),不同浓度的过氧化钙对此阶段氧的释放速率有明显影响;在第2阶段(15 min~12 h),溶解氧的增加速率比第1阶段慢,过氧化钙浓度的变化对氧的平均释放速率影响不大,释氧速率约为0.48 mg/h,随着溶解氧含量的增加,过氧化钙与水的反应进一步受限;第3阶段(12~48 h),氧气的释放速率为0.084 mg/h,此阶段不同浓度过氧化钙的溶解氧浓度均达到最大值并保持稳定,因此氧释放速率与过氧化钙的浓度无关.整个过程中水体pH在5 min内迅速升高到最大值,然后pH随时间变化几乎保持不变,随着过氧化钙浓度的增加,最大pH也随之增加. ...
Oxygen release kinetics from solid phase oxygen in Arctic Alaska
2
1999
... 关于过氧化钙是先生成H2O2再由H2O2释放氧气,还是过氧化钙直接反应生成氧气,目前的文献报道仍存在争议〔32-33〕.T. Schmidtke等〔32〕比较了催化剂对土壤有机反应和无机反应的催化作用,结果表明不加入催化剂时没有氧气产生,加入过氧化氢酶作催化剂的实验ORC释放了大量氧气,猜测ORC氧气的释放与催化剂及H2O2形成有关.但其他研究表明CaO2可直接产生O2,并不通过中间体H2O2产生〔33〕.Hefei Wang等〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性,认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物.因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加,而在实验后期H2O2和O2的浓度几乎不随时间增加.表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性,在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致.此外,从氧气释放速率随时间的变化情况可知,只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高.随着反应进行,氧化还原速率不断降低.当H2O2浓度达到最大值时,O2释放率降低到非常小的值.可见CaO2直接产生O2,并不通过中间体H2O2来产生. ...
... 〔32〕比较了催化剂对土壤有机反应和无机反应的催化作用,结果表明不加入催化剂时没有氧气产生,加入过氧化氢酶作催化剂的实验ORC释放了大量氧气,猜测ORC氧气的释放与催化剂及H2O2形成有关.但其他研究表明CaO2可直接产生O2,并不通过中间体H2O2产生〔33〕.Hefei Wang等〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性,认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物.因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加,而在实验后期H2O2和O2的浓度几乎不随时间增加.表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性,在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致.此外,从氧气释放速率随时间的变化情况可知,只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高.随着反应进行,氧化还原速率不断降低.当H2O2浓度达到最大值时,O2释放率降低到非常小的值.可见CaO2直接产生O2,并不通过中间体H2O2来产生. ...
Properties of calcium peroxide for release of hydrogen peroxide and oxygen:a kinetics study
5
2016
... 关于过氧化钙是先生成H2O2再由H2O2释放氧气,还是过氧化钙直接反应生成氧气,目前的文献报道仍存在争议〔32-33〕.T. Schmidtke等〔32〕比较了催化剂对土壤有机反应和无机反应的催化作用,结果表明不加入催化剂时没有氧气产生,加入过氧化氢酶作催化剂的实验ORC释放了大量氧气,猜测ORC氧气的释放与催化剂及H2O2形成有关.但其他研究表明CaO2可直接产生O2,并不通过中间体H2O2产生〔33〕.Hefei Wang等〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性,认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物.因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加,而在实验后期H2O2和O2的浓度几乎不随时间增加.表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性,在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致.此外,从氧气释放速率随时间的变化情况可知,只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高.随着反应进行,氧化还原速率不断降低.当H2O2浓度达到最大值时,O2释放率降低到非常小的值.可见CaO2直接产生O2,并不通过中间体H2O2来产生. ...
... 〔33〕.Hefei Wang等〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性,认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物.因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加,而在实验后期H2O2和O2的浓度几乎不随时间增加.表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性,在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致.此外,从氧气释放速率随时间的变化情况可知,只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高.随着反应进行,氧化还原速率不断降低.当H2O2浓度达到最大值时,O2释放率降低到非常小的值.可见CaO2直接产生O2,并不通过中间体H2O2来产生. ...
... 〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性,认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物.因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加,而在实验后期H2O2和O2的浓度几乎不随时间增加.表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性,在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致.此外,从氧气释放速率随时间的变化情况可知,只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高.随着反应进行,氧化还原速率不断降低.当H2O2浓度达到最大值时,O2释放率降低到非常小的值.可见CaO2直接产生O2,并不通过中间体H2O2来产生. ...
... 在过氧化钙转化为O2的过程中,O2和H2O2释放的2条途径形成了一个具有竞争关系的平行反应体系.提高温度和pH可以降低H2O2的产率,提高O2产率.Hefei Wang等〔33〕研究过氧化钙转化为过氧化氢和氧气的机理时发现,在固定(10、20、35 ℃)温度下,降低pH可降低O2的产量,提高H2O2产量.在固定pH(4~9.5)下,温度升高能降低过氧化氢的生成量,提高O2的产量,这与之前的研究一致〔37〕.释放的过氧化氢和氧气总量与理论上使用的过氧化钙相符.pH和温度对最终生成H2O2、O2的影响相反.这是因为H2O2和O2都是从CaO2中释放出来的,2种释放途径是相互竞争的. ...
... 表 3为Hefei Wang等〔33〕测定的不同pH、温度下过氧化氢和氧气的释放速率. ...
Bruton's tyrosine kinase is essential for hydrogen peroxide-induced calcium signaling
1
2001
... 关于过氧化钙的自由基释放机理仍存在争议,许多研究对过氧化钙产生自由基的机理提出了不同解释.S. Qin等〔34〕假设过氧化钙上存在自由基,并在细胞反应实验中检测到自由基(·OH)的产生.J. Ramo等〔35〕发现过氧化钙上过氧化氢阴离子(HOO-)的产生,但并没有进一步研究.P. Christel等〔36〕处理过氧化钙得到过氧化钙和过氧化氢的结晶CaO2·2H2O2,发光光谱表明CaO2·2H2O2可以释放单线态氧(1O2).Yong Ma等〔5〕证明了过氧化钙表面活性氧还包括另一种超氧阴离子(O2·-).显然,过氧化钙产生的自由基是CaO2降解污染物的主要因素,但目前尚未明确其自由基释放机制,需要进一步研究. ...
Uniform corrosion of titanium in alkaline hydrogen peroxide conditions:influence of transition metals and inhibitors calcium and silicate
1
2002
... 关于过氧化钙的自由基释放机理仍存在争议,许多研究对过氧化钙产生自由基的机理提出了不同解释.S. Qin等〔34〕假设过氧化钙上存在自由基,并在细胞反应实验中检测到自由基(·OH)的产生.J. Ramo等〔35〕发现过氧化钙上过氧化氢阴离子(HOO-)的产生,但并没有进一步研究.P. Christel等〔36〕处理过氧化钙得到过氧化钙和过氧化氢的结晶CaO2·2H2O2,发光光谱表明CaO2·2H2O2可以释放单线态氧(1O2).Yong Ma等〔5〕证明了过氧化钙表面活性氧还包括另一种超氧阴离子(O2·-).显然,过氧化钙产生的自由基是CaO2降解污染物的主要因素,但目前尚未明确其自由基释放机制,需要进一步研究. ...
Calcium peroxide diperoxohydrate as a storable chemical generator of singlet oxygen for organic synthesis
1
2002
... 关于过氧化钙的自由基释放机理仍存在争议,许多研究对过氧化钙产生自由基的机理提出了不同解释.S. Qin等〔34〕假设过氧化钙上存在自由基,并在细胞反应实验中检测到自由基(·OH)的产生.J. Ramo等〔35〕发现过氧化钙上过氧化氢阴离子(HOO-)的产生,但并没有进一步研究.P. Christel等〔36〕处理过氧化钙得到过氧化钙和过氧化氢的结晶CaO2·2H2O2,发光光谱表明CaO2·2H2O2可以释放单线态氧(1O2).Yong Ma等〔5〕证明了过氧化钙表面活性氧还包括另一种超氧阴离子(O2·-).显然,过氧化钙产生的自由基是CaO2降解污染物的主要因素,但目前尚未明确其自由基释放机制,需要进一步研究. ...
Use of calcium peroxide to provide oxygen for contaminant biodegradation in a saturated soil
1
1999
... 在过氧化钙转化为O2的过程中,O2和H2O2释放的2条途径形成了一个具有竞争关系的平行反应体系.提高温度和pH可以降低H2O2的产率,提高O2产率.Hefei Wang等〔33〕研究过氧化钙转化为过氧化氢和氧气的机理时发现,在固定(10、20、35 ℃)温度下,降低pH可降低O2的产量,提高H2O2产量.在固定pH(4~9.5)下,温度升高能降低过氧化氢的生成量,提高O2的产量,这与之前的研究一致〔37〕.释放的过氧化氢和氧气总量与理论上使用的过氧化钙相符.pH和温度对最终生成H2O2、O2的影响相反.这是因为H2O2和O2都是从CaO2中释放出来的,2种释放途径是相互竞争的. ...
1
... 经过多年的实验室研究,改性过氧化钙已被用于实际污染场地的修复.Guoxin Huang等〔11〕提出了一种过氧化钙释氧微球和斜沸石为填料的PRB系统,用于去除地下水中的铵态氮.实验中氨氮几乎完全耗尽,NH4+-N主要转化为NO3--N,少量转化为NO2--N,说明生物硝化作用对NH4+-N的去除起主导作用.在此基础上将该系统用于全尺寸连续式PRB墙体系统,在实际应用中取得良好的效果.ORIN公司直接向被石油污染的地下水中注入纳米过氧化钙,通过增强的生物修复化学成功修复了被石油污染的土壤和地下水.4个月时间内,不饱和污染物水平从2 900 mg/L降至低于检测值〔3〕.ORIN公司还尝试使用专用的高压泵向污染土壤、地下水注入硫酸钠和纳米过氧化钙混合试剂,在注入修复剂过程中监测到羽状流井中的关键地下水参数(如DO、pH、氧化还原电位、电导率)增加,4个月内污染物从4 700 μg/L降至1.8 μg/L〔38〕.与传统的修复方法相比,使用纳米过氧化钙化学注射不仅修复效率高,而且更加快捷、便宜.Aztech技术公司〔3〕在原位化学氧化中使用过氧化钙产生自由基氧化石油污染场地的污染物,过氧化钙缓慢溶解释放的过氧化氢在合适的催化剂(如溶解的铁)的存在下,发生改良Fenton化学反应,施用修复剂后现场监测井中的溶解氧、比电导和氧化还原电位都有上升,达到预期的修复效果. ...





 津公网安备 12010602120337号
津公网安备 12010602120337号