马铃薯过氧化物酶催化氧化快速降解双酚A
王鑫鑫 , 1 , 李鑫 1 , 张树林 , 1 , 丛方地 1 , 2 , 李涛 2 , 张达娟 1 , 李玉颖 1 , 梁恩瑞 1 , 胡静波 1
Rapid degradation bisphenol A by catalyzing oxidation of potato peroxidase
Wang Xinxin , 1 , Li Xin 1 , Zhang Shulin , 1 , Cong Fangdi 1 , 2 , Li Tao 2 , Zhang Dajuan 1 , Li Yuying 1 , Liang Enrui 1 , Hu Jingbo 1
通讯作者: 张树林, 博士, 教授。E-mail:shulin63@sina.com
收稿日期: 2020-11-22
基金资助:
天津市自然科学基金重点项目 . 18JCZDJC97800 天津市自然科学基金项目 . 19JCYBJC30000 大学生创新创业训练计划项目 . 201810061072
Abstract
A two-phase aqueous extraction system was established to extract peroxidase from potato starch wastewater, and then the enzyme was obtained by dialysis and freeze-drying. The obtained enzyme was used to catalyze the oxidation of bisphenol A(BPA) by H2 O2 . The results showed that 200 U/mL of potato peroxidase catalyzed the oxidation of 0.8 mmol/L bisphenol A with 1.0 mmol/L H2 O2 at room temperature and pH 6. After 10 min, the degradation rate of bisphenol A was up to 99%. It shows great potential application value for repairing water body.
Keywords:
potato peroxidase bisphenol A degradation
本文引用格式
王鑫鑫, 李鑫, 张树林, 丛方地, 李涛, 张达娟, 李玉颖, 梁恩瑞, 胡静波. 马铃薯过氧化物酶催化氧化快速降解双酚A . 工业水处理 [J], 2021, 41(1): 93-97 doi:10.11894/iwt.2020-0234
Wang Xinxin. Rapid degradation bisphenol A by catalyzing oxidation of potato peroxidase . Industrial Water Treatment
双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 。其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 。若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题。目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等。相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景。
过氧化物酶(POD)广泛存在于动植物和微生物体内,是一类可催化氧化有害有机污染物的生物酶,在环境修复领域具有巨大的潜在应用价值。其作用原理是催化过氧化物(一般为H2 O2 ),产生羟基自由基,氧化降解酚类物质,生成不溶性沉聚物,进而达到分离去除的目的。国内外主要用于降解酚类研究的POD有辣根POD、大豆POD和木质素POD等〔6 〕 。这些酶因含量低,如果直接从原料制备而使用,其实用成本较高,所以应选择廉价原料制备酶活力较高的POD,用于催化氧化降解酚类污染物。
POD在生物界分布广泛,而酶蛋白通常是水溶性的,如果能从生物原料加工的废液中收集酶蛋白,将是一条低成本获取酶催化剂的途径。马铃薯通常被大量用作加工淀粉的原料,生产马铃薯淀粉时有大量的废水排出,其中含有大量蛋白质,包含POD〔7 〕 。有研究发现,马铃薯POD(PPOD)酶活较高,稳定性较好〔8 〕 。本试验旨在实验室模拟制备马铃薯淀粉废水,并从中分离出PPOD,并催化H2 O2 氧化降解目标酚类污染物BPA,研究PPOD催化氧化BPA的效果,以期为水环境的修复提供一种快速有效的方法。
1 材料与方法
1.1 材料与试剂
新鲜马铃薯袁购于天津市侯台农贸市场。BPA、愈创木酚、盐酸、天津市北方天医化学试剂厂;4-氨基安替比林、磷酸氢二钠、聚乙二醇6000(PEG 6000)、H2 O2 (30%),天津市光复精细化工研究所;铁氰化钾、磷酸二氢钠、氢氧化钠、(NH4 )2 SO4 ,天津市风船化学试剂科技有限公司;考马斯亮蓝,南京建成生物工程研究所,以上试剂均为分析纯。
1.2 仪器与设备
主要仪器与设备:T6型紫外分光光度仪,北京普析通用仪器公司;HI98190型pH计,哈纳水环境工程(上海)有限公司;Avanti JXN-26型超速离心机,美国贝克曼库尔特公司;DJ13E-Q1型豆浆机,九阳股份有限公司;GOLD-SIM型冷冻干燥机,美国金西蒙国际公司;IKA RET型磁力搅拌器,上海右一仪器有限公司。
1.3 酶活力与蛋白含量的测定
PPOD活力的测定:在50 mL 0.1 mol/L的磷酸缓冲液(pH为6.0)中,加入28 μL愈创木酚,于40 ℃加热搅拌,至愈创木酚全溶,溶液冷至室温,加入19 μL H2 O2 (30%),混合均匀,作反应液,于4 ℃保存。在5 mL比色皿中测定酶活力〔1个酶活力(U)单位为吸光度值每分钟增加0.01所需要的酶量〕,参照样为3 mL反应液和100 μL磷酸缓冲液的混合液;测定样为3 mL反应液和100 μL酶液的混合液。测定波长为470 nm,每隔30 s读取吸光度1次。
蛋白含量的测定:采用Bradford法测样品蛋白质含量,以牛血清白蛋白为标准品。
1.4 模拟制备马铃薯淀粉加工废水
新鲜马铃薯去皮洗净后切成小块,放入豆浆机中,按照质量体积比为1:1加入0.05 mol/L pH为7.2的磷酸缓冲液,匀浆。匀浆液用多层纱布过滤,清液于4 ℃放置4 h。10 000 r/min、4 ℃条件下离心30 min,用上清液模拟马铃薯淀粉加工废水,为粗酶液。
1.5 不同体系中PPOD活力的测定
(1) 将不同浓度的PEG 6000与10 mL粗酶液等体积充分混合,于4 ℃静置20 min后测PPOD活力,与参照样,即0.05 mol/L pH为7.2的磷酸缓冲液与粗酶液的混合液相比较,得到相对酶活力。
(2) 将不同浓度的(NH4 )2 SO4 溶液与10 mL粗酶液等体积充分混合,于4 ℃静置20 min后测PPOD活力,与上述参照样相比较,得到相对酶活力。
(3) 在9组100 mL粗酶液中分别加入(NH4 )2 SO4 和PEG 6000,前者最终质量分数分别为10%、12%、15%,后者最终质量分数分别为12%、15%、20%。室温下,以350 r/min搅拌10 min,转至离心管中,以6 000 r/min离心5 min,测PEG上相、盐下相的酶活力,与粗酶液酶活力比较,得到相对酶活力,并计算双相体积比(R ),R =V 下相 /V 上相 、酶活力分配系数(K ),K =U 下相 /U 上相 、酶活力回收率(Y ),Y =RK /(1+RK )。
(4) 调节双水相体系〔12%(NH4 )2 SO4 和15%PEG 6000〕的pH,测算相对酶活力。
1.6 PPOD的萃取分离与纯化
室温下,在1 L粗酶液中,分次加入PEG 6000和(NH4 )2 SO4 ,以350 r/min搅拌,使其终质量分数分别为15%和12%。混合液转移至分液漏斗,静置1 h,收集下相液体。收集液装入透析袋(截留相对分子质量为8 000~14 000),浸入1 L蒸馏水中,每隔4 h更换1次蒸馏水,于4 ℃透析24 h至无盐(用1%氯化钡溶液检测至无白色沉淀生成)。于4 ℃、4 000 r/min的条件下离心10 min,收集上清液。上清液放入平皿,于-80 ℃冷冻至固体,再于-40 ℃真空干燥8 h,得到固体酶粉,待降解用。
1.7 PPOD催化H2 O2 氧化去除BPA
制作标准曲线:在4 mL离心管中加入不同体积的0.1 mol/L BPA溶液、200 μL 83.4 mmol/L铁氰化钾溶液、200 μL 20.8 mmol/L 4-氨基安替比林溶液,并用0.1 mol/L pH为6的磷酸缓冲液调整反应体系体积为2 mL,反应10 min,取样1 mL,在波长为510 nm处测吸光度,绘制吸光度-浓度标准曲线,以此计算降解体系中BPA的残余量。
BPA降解率:降解反应后的样品在4 ℃、4 000 r/min条件下离心3 min,取上清液50 μL于4 mL离心管中,并加入1 550 μL 0.1 mol/L pH为6的磷酸缓冲液、200 μL 83.4 mmol/L铁氰化钾溶液、200 μL 20.8 mmol/L 4-氨基安替比林溶液,调整反应体系体积为2 mL,室温静置10 min,颜色稳定无变化,取样1 mL,在波长为510 nm处测吸光度。根据标准曲线,可得t 时刻降解体系中BPA的浓度c t c 0 ,降解率(η )按照η =〔(c 0 -c t c 0 〕×100%计算。
酶促降解反应:设置降解体系为1 mL,以BPA为降解的目标污染物,H2 O2 为氧化剂,制备的PPOD固体酶粉为催化剂,0.1 mol/L磷酸缓冲溶液为溶剂。在分别改变PPOD活力、H2 O2 浓度、pH、温度和BPA浓度中1个条件而其他条件恒定不变的情况下,静置催化降解反应,反应后,样品离心,取样分析,计算BPA的降解率。
(1) 在H2 O2 为1.0 mmol/L,pH为6,温度为25 ℃,BPA初始浓度为1.0 mmol/L的条件下,PPOD酶活力分别为0、50、100、200、400 U/mL时,降解一定时间后,样品离心,取样分析,计算BPA降解率;(2)在PPOD为200 U/mL,温度为25 ℃,H2 O2 为1.0 mmol/L,BPA初始浓度为1.0 mmol/L的条件下,pH分别为3、4、5、6、7、8、9时,降解10 min,分析计算BPA降解率;(3)在PPOD为200 U/mL,pH为6,H2 O2 为1.0 mmol/L,BPA初始浓度为1.0 mmol/L的条件下,温度分别为10、20、30、40、50 ℃时,降解10 min,分析计算BPA降解率;(4)在PPOD为200 U/mL,pH为6,室温,BPA初始浓度为1.0 mmol/L的条件下,H2 O2 分别为0.5、1.0、1.2、1.5、2.0 mmol/L时,降解10 min,分析计算BPA降解率;(5)在PPOD为200 U/mL,pH为6,室温,H2 O2 为1.0 mmol/L的条件下,BPA初始浓度分别为0.2、0.5、0.8、1.0、1.2、1.5、2.0 mmol/L时,降解10 min,分析计算BPA降解率。
2 结果与讨论
2.1 PPOD制备方法的建立
PPOD粗酶液的蛋白质量浓度为1 g/L,PPOD酶活力为450 U/mL。可选用双水相萃取法从粗酶液中进一步分离纯化PPOD,相对于等电点沉淀、有机溶剂沉淀和盐析法等,双水相萃取收集酶蛋白因具有条件温和、蛋白不易失活、操作简单、节能省时等特点而较适合工业生产〔9 〕 。另外,从植物中提取酶蛋白时,通常有色素存在,且植物匀浆常会褐变,会对后续纯化实验造成影响,而在双水相萃取时,色素和褐变物等较多分散于上相PEG层,便于与蛋白分离〔10 〕 。
为构建用于萃取PPOD较好的双水相条件,首先分别研究了单水相中PEG 6000和(NH4 )2 SO4 质量分数对PPOD活力的影响,结果见图 1 。
图1
图1
PEG 6000和(NH4 )2 SO4 对PPOD酶活力影响
由图 1 可知,随着PEG 6000质量分数的增加,PPOD相对酶活力呈现先升后降的趋势,PEG 6000质量分数为15%时,酶活力最高,PEG 6000质量分数超过15%时,酶活力快速下降,PEG 6000质量分数为10%~15%时,酶活力相对较高;(NH4 )2 SO4 质量分数在5%~20%范围内,PPOD相对酶活力均在90%以上,当(NH4 )2 SO4 质量分数超过20%时,酶活力快速下降,(NH4 )2 SO4 质量分数为12%~20%时,相对酶活力较高。进而,由不同质量分数的PEG 6000、(NH4 )2 SO4 组合构建9个双水相萃取体系,其PPOD酶活力回收率及酶活力分配系数见图 2 。
图2
图2
不同双水相中的PPOD酶活力回收率和酶活力分配系数
由图 2 可知,PPOD酶活力分配系数和回收率在PEG 6000质量分数为15%时最大,且PEG 6000质量分数相同时,(NH4 )2 SO4 质量分数为12%时最佳,因此,选择15%PEG 6000-12%(NH4 )2 SO4 双水相体系对PPOD萃取的效果较好,其酶活力回收率为96.4%、酶活力分配系数为26.7,萃取效果优于从白萝卜中提取的POD〔11 〕 。
溶液pH一般会影响蛋白质的解离程度,改变其带电性,从而影响其在双水相中的分配。在pH为5~9的双水相体系中分别萃取PPOD,结果表明,pH对其酶活力分配系数影响不大,在pH为6时酶活力分配系数相对最大。说明,PPOD在较宽的pH范围内活性稳定,具有植物POD对pH稳定的特点〔12 〕 。对于马铃薯淀粉加工废水,可在pH为6的15%PEG 6000-12%(NH4 )2 SO4 双水相体系中萃取分离,再经过盐析和冻干得固体酶粉。
2.2 PPOD催化H2 O2 降解BPA的机理研究
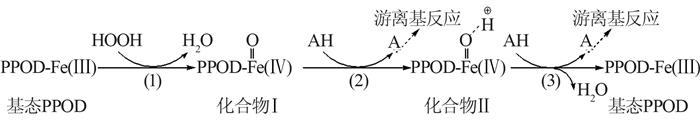
参考相关研究〔6 〕 ,PPOD催化H2 O2 降解BPA的机理可理解为3步循化反应,首先是基态酶活性中心铁卟啉中心的铁结合过氧化氢形成高活性的游离基正离子化合物Ⅰ,随后引发酚类物质发生2步游离基反应,酚类物质被快速降解,酶返回到基态,反应机理见图 3 。
图3
图3
PPOD催化H2 O2 氧化降解酚类(AH)化合物的机理
2.2.1 BPA的标准曲线
BPA浓度在0.01~0.20 mmol/L范围内,与铁氰化钾、4-氨基安替比林快速反应,生成的橙红色吲哚酚安替比林染料在510 nm有特征吸收,在这个波长下,反应后溶液的吸光度A 510 nm 与BPA浓度c 呈线性关系,用Origin 8.5对坐标点(A 510 nm ,c )进行线性拟合得到BPA标准曲线,结果见图 4 。
图4
2.2.2 PPOD活力和反应时间对BPA降解率的影响
在酶促H2 O2 氧化降解BPA的体系中,按照1.7部分的设计,改变PPOD浓度,随着时间的延长,考察PPOD酶活力和反应时间对BPA降解效果的影响,结果见图 5 。
图5
图5
PPOD酶活力和反应时间对BPA降解效果的影响
由图 5 可知,随着PPOD活力增加,BPA降解率随之升高,在10 min时,含200 U/mL和400 U/mL PPOD的体系中,BPA降解率较高,分别为91.5%和94.5%,二者相差仅3%,且随着时间的延续,二者的转化率没有明显的升高。所以,降解体系的PPOD活力可固定为200 U/mL,降解时间为10 min。参考文献〔13 〕表明,润楠POD虽然其对BPA的降解率也达90%以上,但需要2 h的降解时间,而PPOD仅需10 min即可使BPA降解率达到91%,表明PPOD能更快速地有效催化H2 O2 氧化降解BPA。
2.2.3 pH和温度对BPA降解率的影响
按1.7部分设计,改变体系的pH和温度,降解10 min,考察pH、温度对降解率的影响,结果表明,当pH 4~6时,BPA降解率约92%,说明PPOD有效催化氧化降解BPA有一定的pH范围,是一个弱酸性范围。pH小于4或大于6时,降解率明显降低,不适于PPOD催化氧化BPA。这种pH对PPOD催化降解BPA的影响类似于辣根POD〔14 〕 。由此可见,PPOD催化氧化降解BPA体系的pH设为6比较适宜,强酸性和偏碱性的pH环境不适于PPOD的催化氧化降解作用。
结果还表明,虽然温度为30 ℃时BPA降解率最高,为93.9%,但在10~50 ℃,BPA降解率都在90%以上,由此可见温度对BPA降解率的影响较小,表明PPOD有较宽的温度适应范围,PPOD催化活性对温度的稳定性优于莲藕POD〔12 〕 ,为方便起见,降解反应可在室温下进行。
2.2.4 H2 O2 和BPA浓度对BPA降解率的影响
按1.7部分的设计,改变H2 O2 或BPA浓度,降解10 min,考察H2 O2 和BPA浓度对降解率的影响,结果见图 6 。
图6
图6
H2 O2 浓度和BPA浓度对BPA降解率的影响
由图 6 可知,H2 O2 浓度低于1.0 mmol/L时,BPA降解率明显较低,这显然是因为氧化剂不足。H2 O2 浓度为1.0 mmol/L时,BPA降解率最高,达到91.9%。随着H2 O2 浓度继续升高,BPA降解率却略有下降,这可能是浓度过高的H2 O2 抑制了PPOD的活性,导致BPA降解率下降,说明氧化剂H2 O2 浓度并非越大越好,本研究体系中H2 O2 最佳添加浓度为1.0 mmol/L。
由图 6 还可知,BPA初始浓度为0.2~0.8 mmol/L时,降解率达99%以上,BPA浓度大于1 mmol/L时,降解率略有下降,可能是H2 O2 不足的原因。本研究体系中BPA初始浓度应控制在0.8 mmol/L。在此条件下,PPOD酶促氧化降解BPA体系的效率达到最佳效果,降解率达99%。
3 结论与展望
(1) PPOD催化H2 O2 降解BPA的最佳条件:PPOD酶活力为200 U/mL,BPA为0.8 mmol/L,H2 O2 为1.0 mmol/L,pH为6.0,室温,时间为10 min。此条件下,BPA的降解率达99.0%。表明PPOD在修复水环境方面具有较大的潜在应用价值。
(2) 为简化操作,将来可以研究通过絮凝技术从马铃薯淀粉加工废水中富集酶蛋白。为提高PPOD的使用效率,可制备固定化PPOD,提高使用频次。
参考文献
View Option
[1]
Robinson C D , Brown E , Craft J A , et al . Effects of sewage effluent and ethynyl oestradiol upon molecular markers of oestrogenic exposure, maturation and reproductive success in the sand goby(Pomatoschistus minutus, Pallas)
[J]. Aquatic Toxicology(Amsterdam) , 2003 , 62 (2 ): 119 - 134 .
DOI:10.1016/S0166-445X(02)00079-6
[本文引用: 1]
[2]
Yang Ming , Qiu Wenhui , Chen Bei , et al . The in vitro immune modulatory effect of bisphenol A on fish macrophages via estrogen receptor α and nuclear factor-κB signaling
[J]. Environmental Science & Technology , 2015 , 49 (3 ): 1888 - 1895 .
[本文引用: 1]
[3]
赵荧 , 李媛 , 陈永柏 . 双酚A和酞酸酯对鱼类内分泌干扰效应及繁殖毒性研究
[J]. 水生态学杂志 , 2017 , 38 (6 ): 1 - 10 .
URL
[本文引用: 1]
[4]
戴菀萱 , 刘颖 , 丁珊珊 , 等 . 光催化降解水环境中多环芳烃的研究进展
[J]. 水资源保护 , 2018 , 34 (5 ): 63 - 68 .
URL
[本文引用: 1]
[5]
陈春茂 , 刘知远 , 吴百春 , 等 . 泥炭土强化厌氧生物处理含酚废水研究
[J]. 工业水处理 , 2019 , 39 (12 ): 19 - 22 .
URL
[本文引用: 1]
[6]
郑桂钦.辣根过氧化物酶的分子包埋及其去除环境激素中的应用[D].深圳: 深圳大学, 2018.
[本文引用: 2]
[7]
Kurnik K , Krzyzyński , M , Treder K , et al . Study on utilizing solid food industry waste with brewers' spent grain and potato pulp as possible peroxidase sources
[J]. Journal of Food Biochemistry , 2017 , 42 (1 ): e12446 .
[本文引用: 1]
[8]
姚佳.马铃薯蛋白高效提取分离技术及其功能特性的研究[D].吉林: 吉林农业大学, 2013.
[本文引用: 1]
[9]
郑楠 , 刘杰 . 双水相萃取技术分离纯化蛋白质的研究
[J]. 化学与生物工程 , 2006 , (10 ): 7 - 9 .
URL
[本文引用: 1]
[10]
周向军 , 高义霞 , 汪之波 , 等 . "黑美人"马铃薯过氧化物酶的特性研究
[J]. 食品与发酵工业 , 2010 , (8 ): 55 - 58 .
URL
[本文引用: 1]
[11]
黄燕华 , 贾楠 , 严岩 , 等 . 双水相萃取法应用于从白萝卜中快速提取过氧化物酶
[J]. 广东化工 , 2006 , (1 ): 31 - 32 .
URL
[本文引用: 1]
[12]
阙瑞琦.莲藕过氧化物酶的分离纯化、性质研究及固定化初探[D].重庆: 西南大学, 2008.
[本文引用: 2]
[13]
高艳芳 , 王楠 , 王雨雪 , 等 . 润楠过氧化物酶对水环境中双酚A的清除
[J]. 中国林副特产 , 2018 , 155 (4 ): 5 - 8 .
URL
[本文引用: 1]
[14]
Yamada K , Ikeda N , Takano Y , et al . Determination of optimum process parameters for peroxidase-catalysed treatment of bisphenol A and application to the removal of bisphenol derivatives
[J]. Environmental Technology , 2010 , 31 (3 ): 243 - 256 .
[本文引用: 1]
Effects of sewage effluent and ethynyl oestradiol upon molecular markers of oestrogenic exposure, maturation and reproductive success in the sand goby(Pomatoschistus minutus, Pallas)
1
2003
... 双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 .其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 .若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题.目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等.相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景. ...
The in vitro immune modulatory effect of bisphenol A on fish macrophages via estrogen receptor α and nuclear factor-κB signaling
1
2015
... 双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 .其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 .若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题.目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等.相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景. ...
双酚A和酞酸酯对鱼类内分泌干扰效应及繁殖毒性研究
1
2017
... 双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 .其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 .若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题.目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等.相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景. ...
光催化降解水环境中多环芳烃的研究进展
1
2018
... 双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 .其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 .若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题.目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等.相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景. ...
泥炭土强化厌氧生物处理含酚废水研究
1
2019
... 双酚A(BPA)是一种被优先控制的工业污染物〔1 〕 .其性质稳定,难降解,易于流失到江河湖泊等广泛的水体中,对水生生物的生殖、神经、免疫及内分泌系统造成严重的危害,导致其发生某些病变、癌变和畸变〔2 〕 .若BPA经食物链在生物体内富集,最终将影响人类的健康,因此快速有效去除水中BPA是全世界研究关注的热点问题.目前,去除BPA常用的方法有物理吸附法〔3 〕 、化学氧化法〔4 〕 和生物转化法〔5 〕 等.相对而言,酶催化氧化降解酚类污染物因具有效率高、速度快、条件温和、绿色安全等特点而具有良好的前景. ...
2
... 过氧化物酶(POD)广泛存在于动植物和微生物体内,是一类可催化氧化有害有机污染物的生物酶,在环境修复领域具有巨大的潜在应用价值.其作用原理是催化过氧化物(一般为H2 O2 ),产生羟基自由基,氧化降解酚类物质,生成不溶性沉聚物,进而达到分离去除的目的.国内外主要用于降解酚类研究的POD有辣根POD、大豆POD和木质素POD等〔6 〕 .这些酶因含量低,如果直接从原料制备而使用,其实用成本较高,所以应选择廉价原料制备酶活力较高的POD,用于催化氧化降解酚类污染物. ...
... 参考相关研究〔6 〕 ,PPOD催化H2 O2 降解BPA的机理可理解为3步循化反应,首先是基态酶活性中心铁卟啉中心的铁结合过氧化氢形成高活性的游离基正离子化合物Ⅰ,随后引发酚类物质发生2步游离基反应,酚类物质被快速降解,酶返回到基态,反应机理见图 3 . ...
Study on utilizing solid food industry waste with brewers' spent grain and potato pulp as possible peroxidase sources
1
2017
... POD在生物界分布广泛,而酶蛋白通常是水溶性的,如果能从生物原料加工的废液中收集酶蛋白,将是一条低成本获取酶催化剂的途径.马铃薯通常被大量用作加工淀粉的原料,生产马铃薯淀粉时有大量的废水排出,其中含有大量蛋白质,包含POD〔7 〕 .有研究发现,马铃薯POD(PPOD)酶活较高,稳定性较好〔8 〕 .本试验旨在实验室模拟制备马铃薯淀粉废水,并从中分离出PPOD,并催化H2 O2 氧化降解目标酚类污染物BPA,研究PPOD催化氧化BPA的效果,以期为水环境的修复提供一种快速有效的方法. ...
1
... POD在生物界分布广泛,而酶蛋白通常是水溶性的,如果能从生物原料加工的废液中收集酶蛋白,将是一条低成本获取酶催化剂的途径.马铃薯通常被大量用作加工淀粉的原料,生产马铃薯淀粉时有大量的废水排出,其中含有大量蛋白质,包含POD〔7 〕 .有研究发现,马铃薯POD(PPOD)酶活较高,稳定性较好〔8 〕 .本试验旨在实验室模拟制备马铃薯淀粉废水,并从中分离出PPOD,并催化H2 O2 氧化降解目标酚类污染物BPA,研究PPOD催化氧化BPA的效果,以期为水环境的修复提供一种快速有效的方法. ...
双水相萃取技术分离纯化蛋白质的研究
1
2006
... PPOD粗酶液的蛋白质量浓度为1 g/L,PPOD酶活力为450 U/mL.可选用双水相萃取法从粗酶液中进一步分离纯化PPOD,相对于等电点沉淀、有机溶剂沉淀和盐析法等,双水相萃取收集酶蛋白因具有条件温和、蛋白不易失活、操作简单、节能省时等特点而较适合工业生产〔9 〕 .另外,从植物中提取酶蛋白时,通常有色素存在,且植物匀浆常会褐变,会对后续纯化实验造成影响,而在双水相萃取时,色素和褐变物等较多分散于上相PEG层,便于与蛋白分离〔10 〕 . ...
"黑美人"马铃薯过氧化物酶的特性研究
1
2010
... PPOD粗酶液的蛋白质量浓度为1 g/L,PPOD酶活力为450 U/mL.可选用双水相萃取法从粗酶液中进一步分离纯化PPOD,相对于等电点沉淀、有机溶剂沉淀和盐析法等,双水相萃取收集酶蛋白因具有条件温和、蛋白不易失活、操作简单、节能省时等特点而较适合工业生产〔9 〕 .另外,从植物中提取酶蛋白时,通常有色素存在,且植物匀浆常会褐变,会对后续纯化实验造成影响,而在双水相萃取时,色素和褐变物等较多分散于上相PEG层,便于与蛋白分离〔10 〕 . ...
双水相萃取法应用于从白萝卜中快速提取过氧化物酶
1
2006
... 由图 2 可知,PPOD酶活力分配系数和回收率在PEG 6000质量分数为15%时最大,且PEG 6000质量分数相同时,(NH4 )2 SO4 质量分数为12%时最佳,因此,选择15%PEG 6000-12%(NH4 )2 SO4 双水相体系对PPOD萃取的效果较好,其酶活力回收率为96.4%、酶活力分配系数为26.7,萃取效果优于从白萝卜中提取的POD〔11 〕 . ...
2
... 溶液pH一般会影响蛋白质的解离程度,改变其带电性,从而影响其在双水相中的分配.在pH为5~9的双水相体系中分别萃取PPOD,结果表明,pH对其酶活力分配系数影响不大,在pH为6时酶活力分配系数相对最大.说明,PPOD在较宽的pH范围内活性稳定,具有植物POD对pH稳定的特点〔12 〕 .对于马铃薯淀粉加工废水,可在pH为6的15%PEG 6000-12%(NH4 )2 SO4 双水相体系中萃取分离,再经过盐析和冻干得固体酶粉. ...
... 结果还表明,虽然温度为30 ℃时BPA降解率最高,为93.9%,但在10~50 ℃,BPA降解率都在90%以上,由此可见温度对BPA降解率的影响较小,表明PPOD有较宽的温度适应范围,PPOD催化活性对温度的稳定性优于莲藕POD〔12 〕 ,为方便起见,降解反应可在室温下进行. ...
润楠过氧化物酶对水环境中双酚A的清除
1
2018
... 由图 5 可知,随着PPOD活力增加,BPA降解率随之升高,在10 min时,含200 U/mL和400 U/mL PPOD的体系中,BPA降解率较高,分别为91.5%和94.5%,二者相差仅3%,且随着时间的延续,二者的转化率没有明显的升高.所以,降解体系的PPOD活力可固定为200 U/mL,降解时间为10 min.参考文献〔13 〕表明,润楠POD虽然其对BPA的降解率也达90%以上,但需要2 h的降解时间,而PPOD仅需10 min即可使BPA降解率达到91%,表明PPOD能更快速地有效催化H2 O2 氧化降解BPA. ...
Determination of optimum process parameters for peroxidase-catalysed treatment of bisphenol A and application to the removal of bisphenol derivatives
1
2010
... 按1.7部分设计,改变体系的pH和温度,降解10 min,考察pH、温度对降解率的影响,结果表明,当pH 4~6时,BPA降解率约92%,说明PPOD有效催化氧化降解BPA有一定的pH范围,是一个弱酸性范围.pH小于4或大于6时,降解率明显降低,不适于PPOD催化氧化BPA.这种pH对PPOD催化降解BPA的影响类似于辣根POD〔14 〕 .由此可见,PPOD催化氧化降解BPA体系的pH设为6比较适宜,强酸性和偏碱性的pH环境不适于PPOD的催化氧化降解作用. ...










 津公网安备 12010602120337号
津公网安备 12010602120337号