磺胺嘧啶(SDZ)是一种重要的抗生素,广泛用于临床医疗、畜牧业和水产养殖业。SDZ在生物体内仅有10%~50%被吸收,剩下的通过排泄方式进入环境,较难降解,广泛存在于水体、土壤和沉积物中。水体中的SDZ浓度虽然很低(ng/L~μg/L范围)〔1〕,但会危害环境和人类健康,因此环境中抗生素的降解受到人们的关注。
笔者研究了厌氧生物法对SDZ的降解性能,在此基础上考察SDZ初始浓度、SO42-浓度、pH和外加碳源对降解效果的影响,并对降解途径进行分析。
1 实验部分
1.1 试剂与装置
SDZ(纯度>98%),购于阿拉丁试剂公司,其他试剂均为分析纯。模拟废水组成:SDZ 20 mg/L、NaHCO3 100 mg/L、KH2PO4 20 mg/L、NH4Cl 60 mg/L、Na2SO4 80 mg/L、Na2HPO4 80 mg/L〔5〕,模拟废水pH调至6.0。
厌氧反应器采用有机玻璃制作,尺寸16 cm×15 cm×7 cm,最大容积为1.7 L,实际有效容积1.1 L。
1.2 污泥来源与驯化
污泥取自天津污水处理厂厌氧处理单元的浓缩污泥,含水率96%,MLSS为2 000 mg/L。将污泥和模拟废水置于厌氧反应器中,以碳酸氢钠和SDZ为碳源进行驯化,每隔3天换一次基质,经过2个月的培养SDZ降解率趋于稳定。
1.3 检测方法
采用紫外分光光度计于600 nm处测定其吸光度,根据OD600值判断降解菌菌量。将样品在10 000 r/min下离心7 min,过0.45 mm膜后测定SDZ、TOC。SDZ采用TU-1810PC紫外分光光度计(北京普析通用仪器有限责任公司)测定,检测波长为265 nm;TOC采用TOC-L总有机碳分析仪(日本岛津)测定;pH由pHSJ-3F型pH计测定。
用Q-TOF飞行时间质谱仪(美国Waters)分析SDZ降解产物。色谱条件:C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相为乙腈(A)、0.1%甲酸(B),进样量10 mL〔6〕。
2 结果与讨论
2.1 SDZ初始质量浓度对降解率的影响
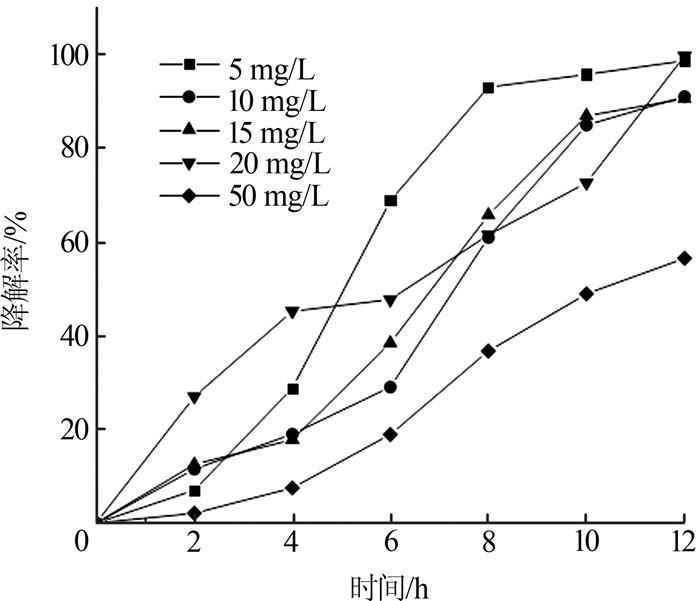
在温度为25 ℃、pH为6.0的条件下,考察SDZ初始质量浓度对降解率的影响,结果如图 1所示。
图1
不同初始质量浓度下(5、10、15、20 mg/L),SDZ的降解过程符合零级反应动力学特征,降解速率常数分别为0.418 8、0.864 7、1.278 8、1.791 7(见表 1)。随着初始质量浓度的增加,SDZ的降解速率加快。
表1 不同质量浓度下SDZ降解的动力学常数
| 项目 | K | t1/2/h | R2 |
| 5 mg/L | 0.418 8 | 6.083 6 | 0.876 7 |
| 10 mg/L | 0.864 7 | 6.593 3 | 0.915 2 |
| 15 mg/L | 1.278 8 | 6.627 6 | 0.957 4 |
| 20 mg/L | 1.791 7 | 6.589 1 | 0.960 7 |
2.2 SO42-质量浓度对降解率的影响
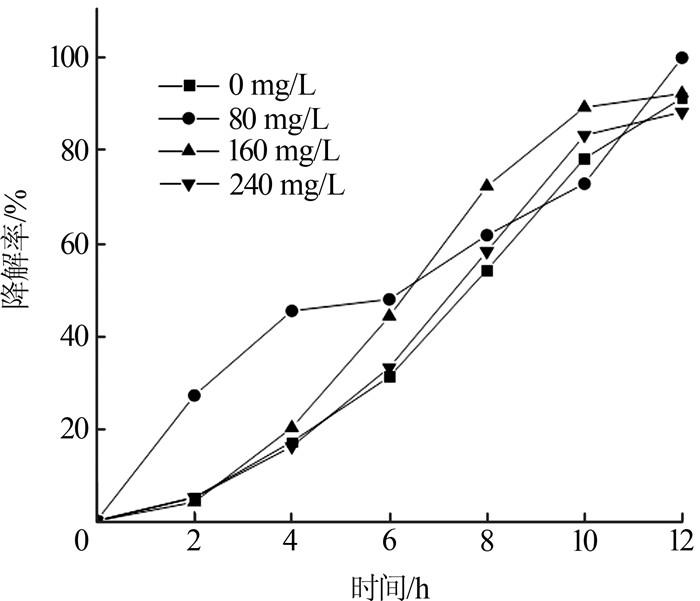
一般情况下,SO42-的氧化还原电位低于磺胺嘧啶的氧化还原电位。电子供体有限时,磺胺嘧啶降解菌可与硫酸根还原菌竞争并得到电子,磺胺嘧啶优先被降解。在SDZ初始质量浓度为20 mg/L、温度为25 ℃、pH为6.0的条件下,考察SO42-质量浓度对SDZ降解率的影响,结果如图 2所示。
图2
2.3 pH对降解率的影响
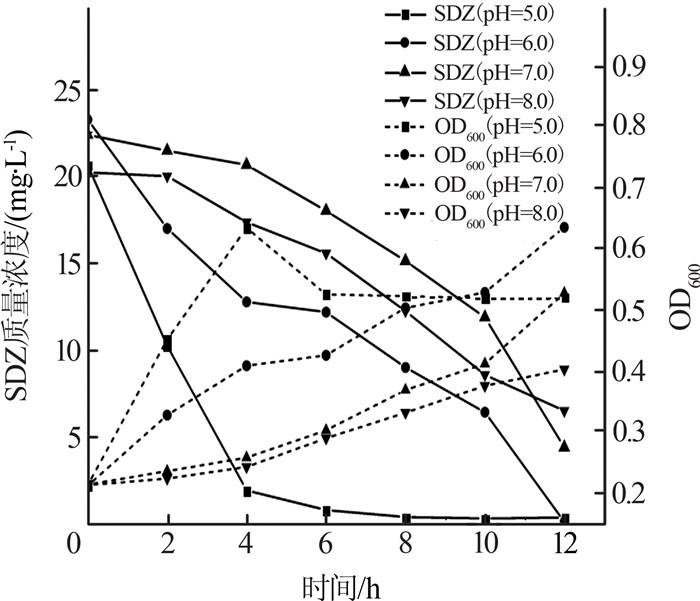
在温度为25 ℃、SO42-质量浓度为80 mg/L的条件下,考察pH对SDZ降解率的影响,如图 3所示。
图3
2.4 外加碳源对降解率的影响
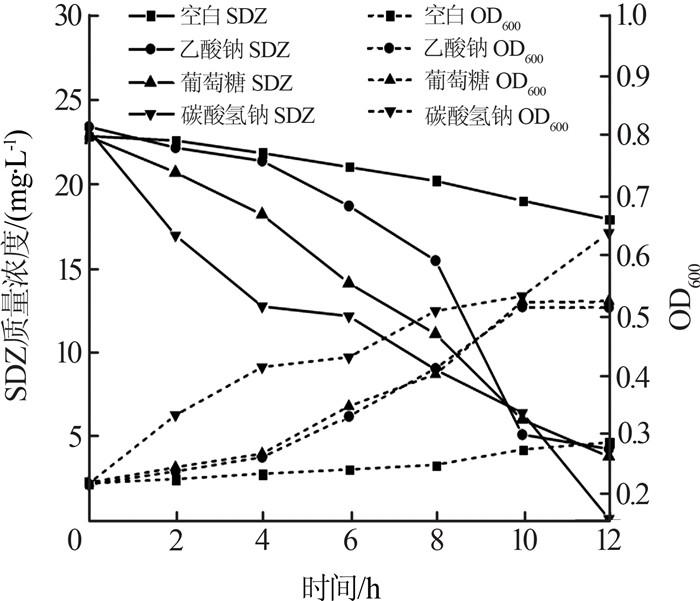
在温度为25 ℃、pH为6.0、SO42-质量浓度为80 mg/L的条件下,考察外加100 mg/L碳源对SDZ降解率的影响,结果如图 4所示。
图4
2.5 降解机理分析
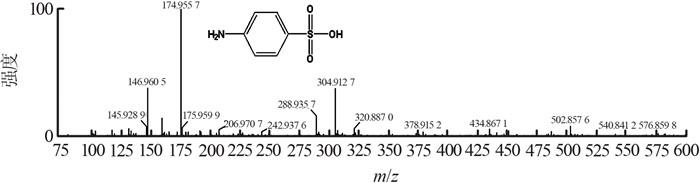
在25 ℃、pH为6.0、SDZ初始质量浓度为20 mg/L的实验条件下,对SDZ降解后的溶液进行Q-TOF分析,研究SDZ的降解机理,结果如图 5所示。保留时间为3.527 min处出现1个主峰,检测到该物质为SDZ(m/z=250),随后峰强度迅速降低,峰完全消失。
图5
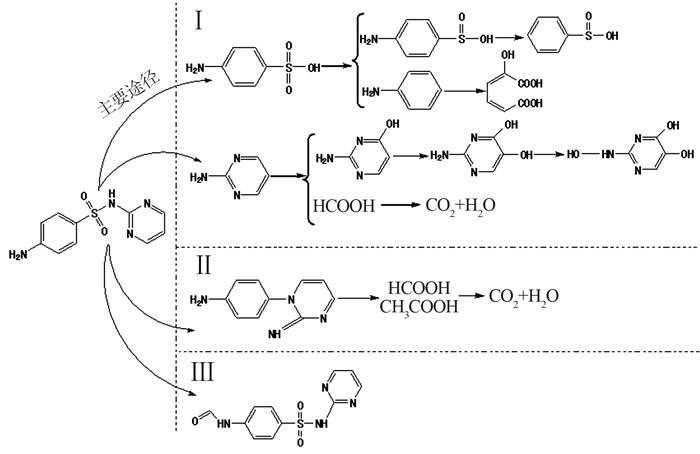
保留时间为0~6 min范围内产生了几个主要降解产物的峰,分析认为SDZ可能通过以下途径降解,如图 6所示。
图6
(2)SDZ很容易释放SO2生成m/z为187的物质,嘧啶环开环裂解生成甲酸和乙酸,进一步矿化生成CO2和H2O〔15〕。
(3)通过苯环氨基的酰胺化生成m/z为278的物质〔16〕。
分析认为,SDZ主要通过第1条途径进行降解。第一步磺酰胺键发生断裂,第二步嘧啶环在C4或C5位置羟基化。降解途径中检测到对氨基苯磺酸、2-氨基嘧啶和2-氨基-4-羟基嘧啶为主要降解产物(见表 2)。TOC去除率为55.1%,SDZ没有完全矿化。
表2 SDZ降解主要中间产物
| 中间产物 | 保留时间/min | m/z |
| 磺胺嘧啶 | 3.527 | 250 |
| 对氨基苯磺酸 | 0.646 | 174 |
| 2-氨基嘧啶 | 0.996 | 96 |
| 2-氨基-4-羟基嘧啶 | 1.325 | 112 |
| 2-氨基-5-羟基嘧啶 | 1.329 | 112 |
| 2-氨基-4,6-二羟基嘧啶 | 5.674 | 128 |
| 2-羟胺基-4,5-二羟基嘧啶 | 6.910 | 145 |
| 4-氨基苯磺酸 | 3.540 | 156 |
| 苯磺酸 | 4.729 | 142 |
| 苯胺 | 5.667 | 94 |
| 2-羟基-2,4-已二烯二酸 | 6.703 | 158 |
| 4-〔2-亚氨基嘧啶-1(2H)-基〕苯胺 | 5.354 | 187 |
| N-甲酰基磺胺嘧啶 | 10.61 | 278 |
3 结论
厌氧生物降解SDZ过程中最适pH为6.0,加入100 mg/L碳酸氢钠作为碳源时,可提高降解效率,SDZ降解率为99.7%。SDZ降解过程符合零级反应动力学特征。降解途径分析表明,SDZ主要通过第1条途径进行降解,对氨基苯磺酸、2-氨基嘧啶和2-氨基-4-羟基嘧啶为主要降解产物。SDZ生物降解过程中,与磺胺抗生素相比,中间产物的毒性降低。
参考文献
Aerobic degradation of sulfa diazine by Arthrobacter spp.: kinetics, pathways, and genomic chara cterization
[J].
Ipso-hydroxylation and subsequent fragmentation: a novel microbial strategy to eliminate sulfonamide antibiotics
[J].
Removal and degradation mechanisms of sulfonamide antibiotics in a new integrated aerobic submerged membrane bioreactor system
[J].DOI:10.1016/j.biortech.2018.08.028 [本文引用: 1]
Degradation path way and mechanism of reactive brilliant red X-3B in electro-assisted microbial system under anaerobic condition
[J].DOI:10.1016/j.jhazmat.2017.01.043 [本文引用: 1]
Distribution of sulfonamides in liquid and solid anaerobic digestates: effects of hydraulic retention time and swine manure to rice straw ratio
[J].DOI:10.1007/s00449-016-1699-1 [本文引用: 1]
Genomic characterizati on, kinetics, and pathways of sulfamethazine biodegradation by Pae narthrobacter sp. A01
[J].DOI:10.1016/j.envint.2019.104961 [本文引用: 1]
Sulfadiazine destruction by chlorination in a pilot-scale water distrib ution system: kinetics, pathway, and bacterial community structure
[J].DOI:10.1016/j.jhazmat.2018.11.096 [本文引用: 1]
Biodegradation of sul fadiazine in microbial fuel cells: reaction mec hanism, biotoxicity removal and the correlation with reactor microbes
[J].DOI:10.1016/j.jhazmat.2018.08.021 [本文引用: 1]
Photocatalytic degrada tion pathway of sulfadiazine over Ag-TiO2 under visible light irra diation
[J].DOI:10.1007/s11164-018-3480-3 [本文引用: 1]
A novel isolated Terrabacter like bacterium can mineralize 2-aminopyrimidine, the principal me tabolite of microbial sulfadiazine degradation
[J].DOI:10.1007/s10532-015-9722-9 [本文引用: 1]
How UV photolysis accele rates the biodegradation and mineralization of sulfadiazine(SD)
[J].DOI:10.1007/s10532-014-9711-4 [本文引用: 1]
Photodegradation of sul fadiazine by goethite-oxalate suspension under UV light irradia tion
[J].
Biodegradation of typical pharmaceutical compounds by a novel strain Acinetobacter sp.
[J].DOI:10.1016/j.jenvman.2018.03.096 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号