基于硫酸根自由基(SO4·-)的过硫酸盐(PDS)活化技术是一类新型的高级氧化技术。PDS中过氧键的裂解(称为活化)可生成SO4·-。SO4·-具有强氧化性,可有效破坏广谱有机污染物,在废水深度处理中具有巨大潜力〔4-5〕。近年来已开发多种方法活化PDS生成SO4·-,如UV照射〔6〕、加热〔7〕及电子转移反应等。基于过渡金属的活化被认为是最可行、最可持续的方法,无需消耗化学药品或能源〔8〕。铜(Cu)是常见的过渡金属。Cu(Ⅱ)通常被认为是PDS降解污染物的低效活化剂。Cu(Ⅱ)/PDS系统可降解70%的丙草胺,但需要几天时间,且所需Cu(Ⅱ)浓度较高〔9〕。其活化效率较低主要归因于Cu(Ⅱ)还原为Cu(Ⅰ)的过程缓慢〔10〕,即高价过渡金属离子还原为低价态的效率较低。为提高Cu(Ⅱ)对PDS活化效果,需提高Cu(Ⅱ)的还原效率。羟胺(HA)是一种较强的还原剂,可显著增强Fe3+向Fe2+的转化〔11-13〕,在Fe2+/H2O2和Fe2+/PDS系统中对苯甲酸的降解作用明显增强。Cu(Ⅰ)对PDS具有较强的活化势,可通过HA促进Cu(Ⅱ)/Cu(Ⅰ)的氧化还原循环,加速PDS的活化。
笔者考察了OTC在Cu(Ⅱ)/HA/PDS体系中的降解效率、降解动力学及影响因素,并通过猝灭实验鉴定该体系的活性物质,用HPLC-MS-MS确定降解中间体,在此基础上提出降解途径,以期为医疗废水中土霉素的去除提供一定理论依据。
1 实验部分
1.1 材料与仪器
五水合硫酸铜、土霉素、羟胺、过硫酸钾、硫酸、氢氧化钠,分析纯,国药集团化学试剂有限公司;甲醇(MeOH,色谱纯)、叔丁醇(TBA,分析纯)、新亚铜试剂(NCP,分析纯),阿拉丁化学试剂有限公司;Cu(Ⅱ)水溶液由五水合硫酸铜制备而成。
实验溶液均由超纯水配制,使用前于4 ℃下保存。
仪器:pHS-3C精密pH计,上海精密科学仪器有限公司;PO10磁力搅拌器,德国IKA公司;1200高效液相色谱仪、1290/6460 Triple Quad LC/MS三重四级液质联用仪,美国安捷伦公司;UV-1100紫外分光光度计,上海美谱达仪器有限公司。
1.2 实验方法
在(25 ± 1)℃下,取50 mL OTC溶液置于100 mL烧杯中,机械搅拌下向反应液中依次加入一定浓度的PDS、HA及Cu(Ⅱ)溶液,并用1 mol/L硫酸溶液或氢氧化钠溶液调节反应液至一定pH进行反应。反应中每隔一段时间进行取样,立即用过量MeOH猝灭以中止样品中的反应,并在24 h内进行分析。
1.3 检测方法
采用高效液相色谱系统定量测定OTC;采用分光光度法测定PDS;采用分光光度法测定亚铜离子浓度〔14〕;采用三重四级液质联用仪分析转化产物。
2 结果与讨论
2.1 羟胺强化Cu(Ⅱ)/PDS降解OTC效果
在pH为5.0,Cu(Ⅱ)、HA、PDS、OTC的初始浓度分别为10 μmol/L、1.0 mmol/L、1.0 mmol/L、10 μmol/L条件下,考察OTC在Cu(Ⅱ)/PDS/HA体系中的降解效果,并对比了同等条件下OTC在Cu(Ⅱ)/PDS、PDS/HA、Cu(Ⅱ)/HA体系中的降解情况,结果如图 1所示。
图1
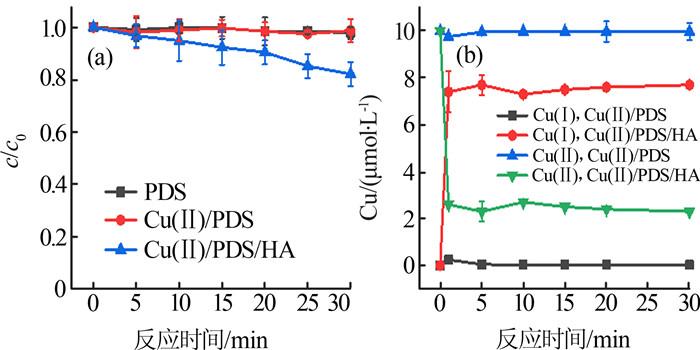
由图 1可知,反应时间为30 min时,OTC在Cu(Ⅱ)/PDS体系中的降解率<30%,在Cu(Ⅱ)/HA体系中几乎不降解,在PDS/HA体系中的降解率为43.5%,而在Cu(Ⅱ)/PDS/HA体系中降解率达到84.9%,说明HA的加入明显强化了OTC的降解。动力学分析表明,OTC的降解符合拟一级动力学,在Cu(Ⅱ)/PDS、PDS/HA、Cu(Ⅱ)/PDS/HA体系中的降解速率常数分别为0.011 3、0.0164、0.056 8 min-1。HA与Cu(Ⅱ)/PDS的耦合显著提高了OTC的降解效果,推测其原因为HA将Cu(Ⅱ)迅速还原为Cu(Ⅰ),进而强化了PDS的活化效果。为证实此推测,测定各体系中PDS浓度与Cu浓度的变化,结果如图 2所示。
图2
图2
Cu(Ⅱ)/PDS/HA体系中PDS(a)、Cu(b)的浓度变化
Fig.2
Concentration changes of PDS(a) and Cu(b) in Cu(Ⅱ)/PDS/HA system
2.2 羟胺强化Cu(Ⅱ)/PDS降解OTC的影响因素
2.2.1 HA、Cu(Ⅱ)和PDS投加浓度的影响
在pH为5.0条件下,考察HA、Cu(Ⅱ)和PDS投加浓度对Cu(Ⅱ)/PDS/HA体系中OTC降解率的影响,结果如图 3所示。
图3
图3
HA(a)、Cu(Ⅱ)(b)、PDS(c)投加浓度对OTC降解率的影响
Fig.3
Effect of concentration of HA(a), Cu(Ⅱ)(b), PDS(c) on OTC degradation rate
a: c0〔Cu(Ⅱ)〕=10 μmol/L, c0(PDS)=1.0 mmol/L, c0(OTC)=10 μmol/L; b: c0(HA)=1.0 mmol/L, c0(PDS)=1.0 mmol/L, c0(OTC)=10 μmol/L; c: c0〔Cu(Ⅱ)〕=10 μmol/L, c0(HA)=1.0 mmol/L, c0(OTC)=10 μmol/L
图 3(c)显示,PDS浓度为0.1 mmol/L时,OTC在30 min内的降解率为59.2%;当PDS增至1.0 mmol/L时,降解率为84.9%;随后进一步增加PDS浓度,反应前5 min降解率进一步提高,但反应30 min后最终降解率仅略有提高。表明PDS最佳剂量为1.0 mmol/L,高浓度的PDS可以增强OTC的降解效果,但过量PDS会造成活性氧物种损失。
2.2.2 初始pH的影响
在Cu(Ⅱ)为10 μmol/L、HA为1.0 mmol/L、PDS为1.0 mmol/L、OTC为10 μmol/L的条件下,考察初始pH对Cu(Ⅱ)/PDS/HA体系中OTC降解率的影响,结果见图 4。
图4
图4
初始pH对Cu(Ⅱ)/PDS/HA体系中OTC降解率的影响
Fig.4
Effect of initial pH on OTC degradation rate in Cu(Ⅱ)/PDS/HA system
由图 4可见,在3.0~5.0范围内,随着初始pH的增加OTC降解率明显增加;pH进一步增至7.0,OTC降解受到明显抑制。Jing Zou等〔15〕报道了初始pH对Fe2+/HA/PMS体系中苯甲酸降解率的影响,结果表明,当初始pH升至6.0时,苯甲酸的降解受到抑制。由于HA的酸度系数pKa为5.96,当溶液pH从5.0增加到7.0时,NH2OH的比例增加,NH3OH+的比例降低〔11〕。NH3OH+、NH2OH与HO·的反应速率常数分别为 < 5×108、9.5×109 mol/(L·s),而SO4·-与NH3OH+和NH2OH的反应速率常数分别为1.5×107、8.5×108 mol/(L·s)。pH为6.0、7.0时OTC的降解受到抑制可能是由于HA对SO4·-和·OH的清除作用增加〔15〕。因此,随着初始pH的增加,更多HA将以NH2OH的形式存在,这可能是OTC在pH为3.0~7.0时降解率变化的主要原因。
2.3 活性物种的鉴定及反应机理
据报道,Cu离子介导的PDS活化可产生不同反应性氧化物种用于污染物去除〔16〕。为鉴定Cu(Ⅱ)/PDS/HA反应体系中的活性物种,开展一系列实验。MeOH对于SO4·-和·OH都是有效的猝灭剂〔10〕。叔丁醇(TBA)对·OH的猝灭反应速率常数较高〔k=6.0×108 mol/(L·s)〕,对SO4·-的反应速率常数要小得多〔k=8.0×105 mol/(L·s)〕,因此TBA是·OH的有效猝灭剂,不是SO4·-的猝灭剂〔5〕。基于上述性质,用MeOH进行猝灭实验可以证明SO4·-和·OH对OTC降解的贡献,TBA猝灭实验则可以区分SO4·-和·OH对OTC降解的贡献。在pH为5.0、Cu(Ⅱ)为10 μmol/L、HA为1.0 mmol/L、PDS为1.0 mmol/L、OTC为10 μmol/L的条件下,考察TBA和MeOH对Cu(Ⅱ)/PDS/HA体系中OTC降解的抑制作用,如图 5所示。
图5
图5
自由基猝灭剂对Cu(Ⅱ)/PDS/HA体系中OTC降解的影响
Fig.5
Effect of free radical quencher on OTC degradation in Cu(Ⅱ)/PDS/HA system
由图 5可见,加入10 mmol/L TBA(初始OTC浓度的1 000倍),OTC降解率从84.9%以上降至32%,而添加10 mmol/L MeOH后OTC的降解几乎完全被抑制。这表明Cu(Ⅱ)/PDS/HA体系中主要的氧化剂为SO4·-和·OH,尽管MeOH和TBA都可以抑制·OH的贡献,但添加MeOH后OTC降解被进一步抑制可归因于SO4·-被清除。此外,有研究表明在活化过硫酸盐体系中(如苯酚和醌活化体系)也可生成1O2降解有机污染物〔17〕。如果1O2是主要氧化物种,那么加入10 mmol/L MeOH不会显著抑制OTC的降解,因为1O2对MeOH是惰性的〔10〕。因此,该研究中1O2的贡献可忽略不计。
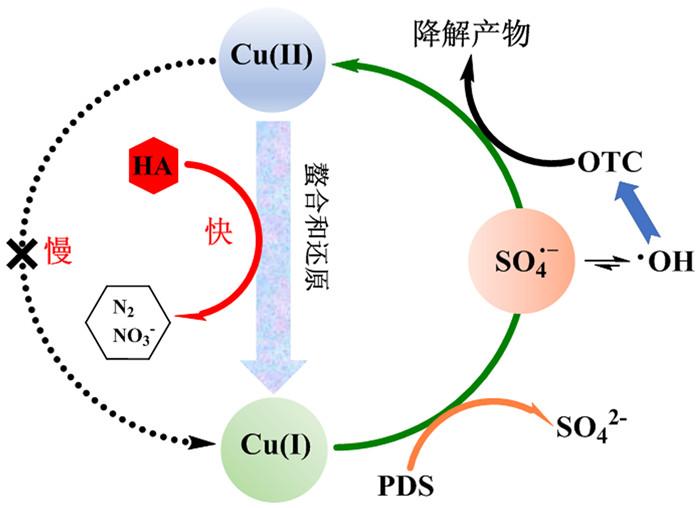
有文献报道Cu(Ⅱ)/HA/H2O2体系在中性或碱性pH条件下易生成Cu(Ⅲ),而Cu(Ⅲ)作为一种中间产物具有强氧化性,能够氧化降解有机污染物〔16, 18〕。Cu(Ⅲ)并不稳定,用高碘酸盐形成高碘酸铜(Ⅲ)-络合物可稳定Cu(Ⅲ),该络合物在415 nm具有特征吸光度。Zongping Wang等〔19〕、Yu Wang等〔20〕在Cu(Ⅱ)/PMS体系中使用高碘酸盐检测Cu(Ⅲ),证明了Cu(Ⅲ)的存在及对有机污染物的去除作用。然而笔者采用高碘酸盐(1.0 mmol/L)时并未检测到特征吸收峰,因此在该实验条件下Cu(Ⅲ)不是主要活性物种。上述结果表明,SO4·-和·OH是Cu(Ⅱ)/PDS/HA体系的主要活性物种。
图6
图6
OTC在Cu(Ⅱ)/PDS/HA反应体系中的降解机理
Fig.6
Degradation mechanism of OTC in Cu(Ⅱ)/PDS/HA system
2.4 降解路径分析
为阐明Cu(Ⅱ)/HA/PDS体系中OTC的降解机理,采用HPLC-MS-MS检测OTC的降解产物,如图 7所示,揭示4种不同反应途径,包括羟基化(m/z+16)、脱甲基化(m/z-14)、脱羰基化(m/z-28)和脱水(m/z-18)。
图7
图7
OTC在Cu(Ⅱ)/PDS/HA体系中的降解途径
Fig.7
Degradation pathway of OTC in Cu(Ⅱ)/PDS/HA system
(2)去甲基化(路径2)可能是二甲基氨基中的任何一个甲基被消除从而形成副产物D(m/z=447)。Fang Yuan等〔23〕观察到紫外直接光解也可形成这种副产物。因此,笔者认为SO4·-和·OH可以诱导从甲基部分提取氢开始的去甲基化反应。
(3)脱羰基化(路径3)涉及OTC环结构中CO的损失。T. K. Choudhury等〔24〕报道了乙酰丙酮热解过程中,乙酰丙酮C—C键离解产生的—COCH3快速单分子分解形成CO。环A中第1个烯醇式乙酰丙酮更可能发生脱羰反应。由于C1~C12a(sp3杂化)的键能比C1~C2(sp2杂化)的键能低,因此激发OTC的裂解可能更易在C12a~C1上发生。实验中检测到脱羰副产物E(m/z=433),E随后羟基化为C(m/z=449)和/或脱水生成G(m/z=415)。
(4)脱水(路径4)指H2O的去除。脱水反应可能发生在C5、C6或C12a位点〔24〕。随着C11~C12酮/烯醇的互变异构化,C6处脱水可形成稳定的第2芳环C,其更可能成为反应位点。实验检测到脱水副产物F(m/z=443),随后经脱羰作用转变为G(m/z=415)。脱羰中间体E(m/z=433)脱水也可得到G(m/z=415)。
3 结论
(1)投加HA可加速Cu(Ⅱ)向Cu(Ⅰ)的转化,从而促进Cu(Ⅱ)/PDS体系对OTC的降解。
(2)OTC的降解率受HA、Cu(Ⅱ)、PDS浓度及pH的影响,随HA、Cu(Ⅱ)和PDS浓度的增加而增大,随pH的增加先增大后减小。
(3)在Cu(Ⅱ)/PDS/HA体系中,SO4·-和·OH是降解OTC的主要活性物种。
(4)OTC降解主要通过羟基化、脱甲基化、脱羰基化和脱水等过程进行。
参考文献
Chiral pharmaceuticals: A review on their environmental occurrence and fate processes
[J].DOI:10.1016/j.watres.2017.08.003 [本文引用: 1]
Selective oxidation of tetracyclines by peroxymonosulfate in livestock wastewater: Kinetics and non-radical mechanism
[J].DOI:10.1016/j.jhazmat.2019.121656 [本文引用: 1]
高级氧化法处理抗生素废水研究进展
[J].DOI:10.3969/j.issn.1006-1878.2018.02.002 [本文引用: 1]
Persulfate-based advanced oxidation: Critical assessment of opportunities and roadblocks
[J].
Degradation of thiacloprid via unactivated peroxymonosulfate: The overlooked singlet oxygen oxidation
[J].DOI:10.1016/j.cej.2020.124264 [本文引用: 2]
The individual and Co-exposure degradation of benzophenone derivatives by UV/H2O2 and UV/PDS in different water matrices
[J].DOI:10.1016/j.watres.2019.05.019 [本文引用: 1]
Treatment of aqueous film-forming foam by heat-activated persulfate under conditions representative of in situ chemical oxidation
[J].
Sulfate radical and its application in decontamination technologies
[J].DOI:10.1080/10643389.2014.970681 [本文引用: 1]
Oxidative degradation of propachlor by ferrous and copper ion activated persulfate
[J].DOI:10.1016/j.scitotenv.2011.12.004 [本文引用: 1]
Hydroxylamine enhanced degradation of naproxen in Cu2+ activated peroxymonosulfate system at acidic condition: efficiency, mechanisms and pathway
[J].DOI:10.1016/j.cej.2018.12.114 [本文引用: 3]
Unraveling the interaction of hydroxylamine and Fe(Ⅲ) in Fe(Ⅱ)/Persulfate system: A kinetic and simulating study
[J].DOI:10.1016/j.watres.2019.115093 [本文引用: 2]
Enhancing the Fenton-like catalytic activity of nFe2O3 by MIL-53(Cu) support: A mechanistic investigation
[J].
Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine
[J].
Complexation enhances Cu(Ⅱ)-activated peroxydisulfate: A novel activation mechanism and Cu(Ⅲ) contribution
[J].
Activation of peroxymonosulfate by benzoquinone: A novel nonradical oxidation process
[J].
Activation of oxygen and hydrogen peroxide by copper(Ⅱ) coupled with hydroxylamine for oxidation of organic contaminants
[J].
Natural polyphenols enhanced the Cu(Ⅱ)/peroxymonosulfate(PMS) oxidation: The contribution of Cu(Ⅲ) and HO·
[J].DOI:10.1016/j.watres.2020.116326 [本文引用: 1]
The role of reactive oxygen species and carbonate radical in oxcarbazepine degradation via UV, UV/H2O2: Kinetics, mechanisms and toxicity evaluation
[J].DOI:10.1016/j.watres.2018.10.007 [本文引用: 1]
Kinetics and mechanism investigation on the destruction of oxytetracycline by UV-254 nm activation of persulfate
[J].DOI:10.1016/j.jhazmat.2015.11.043 [本文引用: 1]
Photodegradation and toxicity changes of antibiotics in UV and UV/H2O2 process
[J].
Homogeneous pyrolysis of acetylacetone at high temperatures in shock waves
[J].DOI:10.1002/kin.550220506 [本文引用: 2]










 津公网安备 12010602120337号
津公网安备 12010602120337号