DEAMOX—New biological nitrogen removal process based on anaerobic ammonia oxidation coupled to sulphide?driven conversion of nitrate into nitrite
2
2006
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
... 〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
厌氧氨氧化菌富集培养技术的研究与应用
1
2009
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
厌氧氨氧化菌富集培养技术的研究与应用
1
2009
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
Advanced nitrogen removal from wastewater by combining anammox with partial denitrification
1
2015
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
高浓度硝酸盐对城市污水活性污泥中微生态种群结构的影响
1
2005
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
高浓度硝酸盐对城市污水活性污泥中微生态种群结构的影响
1
2005
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
硝酸盐对沉积物中有机物氧化减量及微生物群落结构的影响
2
2013
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
硝酸盐对沉积物中有机物氧化减量及微生物群落结构的影响
2
2013
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
Nitrate stimulates anaerobic microbial arsenite oxidation in paddy soils
0
2017
Effect of organic carbon on nitrogen conversion and microbial communities in the completely autotrophic nitrogen removal process
0
2012
有机碳源条件下厌氧氨氧化SBBR中的微生物多样性
2
2012
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
有机碳源条件下厌氧氨氧化SBBR中的微生物多样性
2
2012
... 短程反硝化-厌氧氨氧化(PD-Anammox)耦合工艺通常以氨态氮和硝酸盐氮作为基质富集培养厌氧氨氧化菌和反硝化菌,从而实现耦合工艺的启动〔1〕.受厌氧氨氧化菌倍增周期长以及耦合工艺中有机物对厌氧氨氧化细菌富集的影响〔2〕,PD-Anammox耦合工艺的常规启动过程十分漫长〔1〕.近年有研究发现,通过调控进水基质比例,将耦合工艺初始进水氮源由硝酸盐改为亚硝酸盐,待脱氮效率稳定后逐步将亚硝酸盐氮转换为硝酸盐氮,可以有效减轻进水基质(特别是进水中的有机物)对厌氧氨氧化菌的影响,从而实现耦合工艺的快速启动〔3〕.需要指出的是,进水基质的变化可显著改变微生物的代谢功能〔4〕.在长期驯化过程中,厌氧氨氧化系统中的微生物群落结构及其功能均呈现出明显的演替过程〔5-8〕.目前,关于PD-Anammox耦合工艺中微生物菌群演替及其氮代谢功能基因表达随基质改变的瞬时响应机制的研究较少,而相关机理的解析对耦合工艺的快速启动和稳定运行具有重要意义. ...
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
Metagenomic and metatranscriptomic insights into the complex nitrogen metabolic pathways in a single?stage bioreactor coupling partial denitrification with anammox
1
2020
... 实验装置为膨胀污泥床反应器(EGSB)(见图1),有机玻璃材质,内径5 cm,有效容积1 L.运行过程中,用恒温槽(HX-08,无锡沃信仪器有限公司)保持反应器内水温为(30±1.5) ℃,水力停留时间(HRT)为8 h,同时设置回流比为10∶1.接种污泥取自实验室运行的厌氧氨氧化-反硝化耦合反应器〔9〕,污泥接种量为200 mL,SS为11.3 g/L. ...
Heterotrophic ammonia and nitrate bio?removal over nitrite (Hanbon):Performance and microflora
1
2017
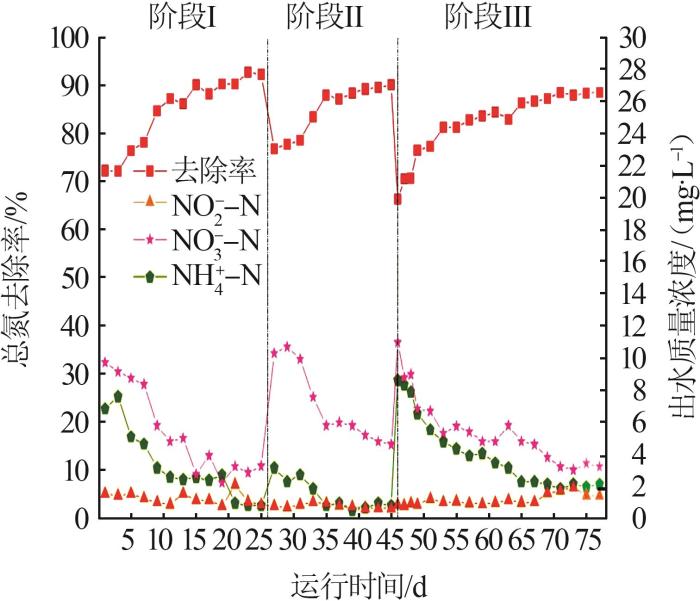
... 采用EGSB反应器及模拟污水,通过改变进水基质比例实现PD-Anammox耦合工艺的快速启动.该过程分为3个阶段(阶段Ⅰ进水氮素为氨氮和亚硝酸盐氮,阶段Ⅱ进水氮素为氨氮、亚硝酸盐氮和硝酸盐氮的混合液,阶段Ⅲ进水氮素为氨氮和硝酸盐氮),运行时间为77 d,具体运行情况见表1.耦合工艺运行过程中严格控制反应器内pH在7.0~8.0,模拟污水进水碳源的配制参照文献〔10〕.为保证微生物正常生长,在1 L进水中添加1 mL微量元素储备液.运行期间,每48 h采集1次出水样品(3个平行),并用0.45 μm滤头过滤,统一保存在4 ℃冰箱中,用于水质检测.污泥样品每次采集3个平行样品,当天提取污泥样品中的RNA送往测序公司,同时在收集的污泥样品中加入等体积的无水乙醇,置于-20 ℃冰箱中用于后续提取样品总DNA. ...
1
1989
... 氨氮采用纳氏试剂分光光度法测定;亚硝态氮采用N-(1-萘基)-乙二胺分光光度法测定;硝态氮采用紫外分光光度法测定;总氮采用碱性过硫酸钾消解紫外分光光度法测定;COD采用重铬酸盐法〔11〕测定. ...
Flexible nitrite supply alternative for mainstream anammox:Advances in enhancing process stability
1
2020
... PD-Anammox耦合工艺中总氮去除的贡献率按式(1)〔12〕计算,全程反硝化贡献率按式(2)计算. ...
基于16S rRNA基因高通量测序方法分析多花黄精内生细菌群落结构及多样性
1
2020
... 采集的污泥样品用FastDNA® Spin Kit土壤试剂盒(MP Biomedicals,美国)提取总DNA,将DNA样品送往上海美吉生物医药科技有限公司,采用ABI GeneAmp® 9700型PCR仪扩增16S rRNA基因的序列V3-V4区域〔13〕.PCR扩增结果经纯化和建库后上机测序.原始数据通过qiime2软件合并数据,再通过质量筛选、模块降噪后生成特征表和代表序列,最终获得物种分类信息. ...
基于16S rRNA基因高通量测序方法分析多花黄精内生细菌群落结构及多样性
1
2020
... 采集的污泥样品用FastDNA® Spin Kit土壤试剂盒(MP Biomedicals,美国)提取总DNA,将DNA样品送往上海美吉生物医药科技有限公司,采用ABI GeneAmp® 9700型PCR仪扩增16S rRNA基因的序列V3-V4区域〔13〕.PCR扩增结果经纯化和建库后上机测序.原始数据通过qiime2软件合并数据,再通过质量筛选、模块降噪后生成特征表和代表序列,最终获得物种分类信息. ...
Microbial ecology of denitrification in biological wastewater treatment
1
2014
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
碳源对厌氧氨氧化脱氮性能影响的试验研究
1
2013
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
碳源对厌氧氨氧化脱氮性能影响的试验研究
1
2013
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
The novel bacterial Phylum Calditrichaeota is diverse,widespread and abundant in marine sediments and has the capacity to degrade detrital proteins
1
2017
... 在阶段Ⅱ稳定期,变形菌门(Proteobacteria,38.0%~63.6%)、浮霉菌门(Planctomycetes,10.7%~22.5%)和绿弯菌门(Chloroflexi,8.7%~13.2%)是耦合工艺中的主要菌门.变形菌门包含广泛的反硝化菌〔14〕,当进水硝酸盐和碳源增加2 h(S1)后,变形菌门相对丰度从38.0%(S0)显著升高至59.3%(p<0.05),并在进水1 d后(S2)丰度达到最大值(63.6%),但随后其丰度在第3天(S3)时显著降低至42.0%,与阶段Ⅲ稳定阶段(S4,42.2%)相比并无显著差异(p>0.05).进水硝酸盐氮含量增加可诱导变形菌门丰度升高,表明进水硝态氮的冲击短时间内诱导了耦合系统中反硝化菌群的快速增殖〔5〕.浮霉菌门丰度在进水2 h后降至11.9%,并在1 d后达到最低丰度(10.7%);3 d后(S3)其丰度升至16.7%,在稳定期丰度为12.1%.进水改变瞬间,碳源浓度增加对厌氧氨氧化菌产生了抑制,导致浮霉菌门丰度显著下降〔15〕.随着厌氧氨氧化菌对进水条件的适应,其丰度逐渐上升,但稳定期后碳源升高导致异养菌滋生过多,造成厌氧氨氧化菌相对丰度的降低.与此同时,异养菌Calditrichaeota门的丰度在稳定运行期间显著高于氮源冲击前.该菌门可利用细胞裂解的碳源和蛋白质进行富集生长〔16〕,是运行后期浮霉菌门相对丰度下降的主要原因. ...
陶厄氏菌Thauera sp. strain TN9的鉴定及特性
1
2013
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
陶厄氏菌Thauera sp. strain TN9的鉴定及特性
1
2013
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
动胶菌属系统分类、生理特征及其在活性污泥中的作用
1
2016
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
动胶菌属系统分类、生理特征及其在活性污泥中的作用
1
2016
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
不同短程硝化系统中微生物群落结构的对比分析
1
2016
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
不同短程硝化系统中微生物群落结构的对比分析
1
2016
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
Calorithrix insularis gen. nov., sp. nov., a novel representative of the Phylum Calditrichaeota
1
2017
... 如图7所示,S0~S4样品中丰度差异最大的菌属分别是陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和JdFR_76.从进化树分支(图6)可知,γ-变形菌纲(Gammaproteobacteria)包含的5个特异性菌属分别为陶厄氏菌(Thauera)、动胶菌(Zoogloea)、球衣菌(Sphaerotilus)、Denitratisoma和固氮螺菌(Azospira),其中陶厄氏菌(Thauera)〔17〕、动胶菌(Zoogloea)〔18〕和Denitratisoma〔19〕都属于反硝化菌,表明γ-变形菌亚门内反硝化菌差异物种在瞬时冲击后的富集显著.此外,Calorithrix(2.4%~5.8%)是耦合工艺启动后的差异菌,其隶属的Calditrichaeota门丰度也在进水冲击后显著上升.Calorithrix属中包含一种新型细菌Calorithrix insularis sp〔20〕,能异化硝酸盐还原为铵(DNRA),推测在阶段Ⅲ中部分硝酸盐被异化还原为铵盐. ...
厌氧氨氧化工艺的抑制现象
1
2012
... 随着进水中硝酸盐和碳源含量的增加,耦合工艺中的厌氧氨氧化菌Candidatus Brocadia丰度由21.9%(S0)降为11.2%(S1),1 d后(S2)达到谷值(9.5%),其原因在于有机物浓度突升对厌氧氨氧化菌产生一定抑制作用〔21〕.3 d后(S3)Candidatus Brocadia丰度回升至16.1%.该趋势与总氮去除率的变化趋势一致.在阶段Ⅲ稳定运行时期(S4),厌氧氨氧化菌丰度相对于氮源冲击第3天后(S3 16.1%)降至11.0%,原因可能与长期运行下异养菌(如Calorithrix)的滋生有关. ...
厌氧氨氧化工艺的抑制现象
1
2012
... 随着进水中硝酸盐和碳源含量的增加,耦合工艺中的厌氧氨氧化菌Candidatus Brocadia丰度由21.9%(S0)降为11.2%(S1),1 d后(S2)达到谷值(9.5%),其原因在于有机物浓度突升对厌氧氨氧化菌产生一定抑制作用〔21〕.3 d后(S3)Candidatus Brocadia丰度回升至16.1%.该趋势与总氮去除率的变化趋势一致.在阶段Ⅲ稳定运行时期(S4),厌氧氨氧化菌丰度相对于氮源冲击第3天后(S3 16.1%)降至11.0%,原因可能与长期运行下异养菌(如Calorithrix)的滋生有关. ...
Endogenous metabolism of anaerobic ammonium oxidizing bacteria in response to short?term anaerobic and anoxic starvation stress
1
2017
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
Genome?centered metagenomics analysis reveals the symbiotic organisms possessing ability to cross?feed with anammox bacteria in anammox consortia
1
2018
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
Investigation of COD and COD/N ratio for the dominance of anammox pathway for nitrogen removal via isotope labelling technique and the relevant bacteria
1
2019
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
Step?feeding organic carbon enhances high?strength nitrate and ammonia removal via DEAMOX process
1
2019
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
A comprehensive insight into the functional bacteria and genes and their roles in simultaneous denitrification and anammox system at varying substrate loadings
1
2019
... 相对丰度较高的反硝化菌分别为Denitratisoma(2.3%~7.6%)、动胶菌(2.2%~6.4%)和陶厄氏菌(2.3%~5.2%).其中内源性反硝化菌Denitratisoma的相对丰度在瞬时冲击2 h后下降为2.3%,并在1 d(3.4%)和3 d(7.6%)后迅速上升,在阶段Ⅲ稳定运行时期(S4),反硝化菌Denitratisoma丰度由7.6%降至3.9%.Denitratisoma主要利用细胞死亡裂解的有机碳源富集生长〔22〕.受到氮源冲击后,部分细胞死亡裂解促进了Denitratisoma的生长,该菌是厌氧氨氧化菌重要的共生细菌〔23-24〕.与此同时,陶厄氏菌是多种PD-Anammox耦合工艺中的优势短程反硝化菌〔8,25-26〕,其丰度在瞬时冲击2 h后也呈现先下降(2.3%)后上升(3.5%)的趋势,表明Denitratisoma和陶厄氏菌是氮源冲击后耦合工艺恢复阶段的关键反硝化菌. ...
基于短程反硝化的厌氧氨氧化脱氮工艺与菌群特性
1
2018
... 图9中,当进水硝酸盐和碳源升高2 h后(S1),厌氧氨氧化反应的主要功能基因hdh/hzo和hzsA/B/C表达丰度分别从阶段Ⅱ运行末期(S0)的38 652和54 505 TPM显著下降至5 537 和7 687 TPM(p<0.05),1 d后(S2)开始显著上升(p<0.05),同时反应器中的Candidatus Brocadia菌呈现明显富集趋势.随着反应时间的延长,耦合工艺脱氮效能逐渐恢复,hdh/hzo和hzsA/B/C基因表达量无显著变化(p>0.05),说明厌氧氨氧化反应活性自第3天开始趋于稳定.阶段Ⅱ运行末期(S0)的hdh/hzo和hzsA/B/C基因表达活性下降,主要是由于进水中的亚硝酸盐氮减半,硝酸盐难以被厌氧氨氧化菌直接利用,且碳源升高对厌氧氨氧化菌有抑制作用〔27〕.此外,稳定时期(S4)hdh/hzo和hzsA/B/C基因表达丰度显著低于进水改变前(S0),主要原因在于进水中硝酸盐和碳源浓度的升高分别促进了反硝化细菌和异养菌的生长与活性〔28〕. ...
基于短程反硝化的厌氧氨氧化脱氮工艺与菌群特性
1
2018
... 图9中,当进水硝酸盐和碳源升高2 h后(S1),厌氧氨氧化反应的主要功能基因hdh/hzo和hzsA/B/C表达丰度分别从阶段Ⅱ运行末期(S0)的38 652和54 505 TPM显著下降至5 537 和7 687 TPM(p<0.05),1 d后(S2)开始显著上升(p<0.05),同时反应器中的Candidatus Brocadia菌呈现明显富集趋势.随着反应时间的延长,耦合工艺脱氮效能逐渐恢复,hdh/hzo和hzsA/B/C基因表达量无显著变化(p>0.05),说明厌氧氨氧化反应活性自第3天开始趋于稳定.阶段Ⅱ运行末期(S0)的hdh/hzo和hzsA/B/C基因表达活性下降,主要是由于进水中的亚硝酸盐氮减半,硝酸盐难以被厌氧氨氧化菌直接利用,且碳源升高对厌氧氨氧化菌有抑制作用〔27〕.此外,稳定时期(S4)hdh/hzo和hzsA/B/C基因表达丰度显著低于进水改变前(S0),主要原因在于进水中硝酸盐和碳源浓度的升高分别促进了反硝化细菌和异养菌的生长与活性〔28〕. ...
硝酸盐对土壤反硝化活性及蒽厌氧降解的影响
1
2018
... 图9中,当进水硝酸盐和碳源升高2 h后(S1),厌氧氨氧化反应的主要功能基因hdh/hzo和hzsA/B/C表达丰度分别从阶段Ⅱ运行末期(S0)的38 652和54 505 TPM显著下降至5 537 和7 687 TPM(p<0.05),1 d后(S2)开始显著上升(p<0.05),同时反应器中的Candidatus Brocadia菌呈现明显富集趋势.随着反应时间的延长,耦合工艺脱氮效能逐渐恢复,hdh/hzo和hzsA/B/C基因表达量无显著变化(p>0.05),说明厌氧氨氧化反应活性自第3天开始趋于稳定.阶段Ⅱ运行末期(S0)的hdh/hzo和hzsA/B/C基因表达活性下降,主要是由于进水中的亚硝酸盐氮减半,硝酸盐难以被厌氧氨氧化菌直接利用,且碳源升高对厌氧氨氧化菌有抑制作用〔27〕.此外,稳定时期(S4)hdh/hzo和hzsA/B/C基因表达丰度显著低于进水改变前(S0),主要原因在于进水中硝酸盐和碳源浓度的升高分别促进了反硝化细菌和异养菌的生长与活性〔28〕. ...
硝酸盐对土壤反硝化活性及蒽厌氧降解的影响
1
2018
... 图9中,当进水硝酸盐和碳源升高2 h后(S1),厌氧氨氧化反应的主要功能基因hdh/hzo和hzsA/B/C表达丰度分别从阶段Ⅱ运行末期(S0)的38 652和54 505 TPM显著下降至5 537 和7 687 TPM(p<0.05),1 d后(S2)开始显著上升(p<0.05),同时反应器中的Candidatus Brocadia菌呈现明显富集趋势.随着反应时间的延长,耦合工艺脱氮效能逐渐恢复,hdh/hzo和hzsA/B/C基因表达量无显著变化(p>0.05),说明厌氧氨氧化反应活性自第3天开始趋于稳定.阶段Ⅱ运行末期(S0)的hdh/hzo和hzsA/B/C基因表达活性下降,主要是由于进水中的亚硝酸盐氮减半,硝酸盐难以被厌氧氨氧化菌直接利用,且碳源升高对厌氧氨氧化菌有抑制作用〔27〕.此外,稳定时期(S4)hdh/hzo和hzsA/B/C基因表达丰度显著低于进水改变前(S0),主要原因在于进水中硝酸盐和碳源浓度的升高分别促进了反硝化细菌和异养菌的生长与活性〔28〕. ...
Functional stability of the nitrate?reducing community in grassland soils towards high nitrate supply
1
2006
... 硝酸盐还原基因napA/B/C和narB/C、亚硝酸盐还原基因nirS和一氧化二氮还原酶基因nosZ的表达量在进水硝酸盐和碳源升高2 h后(S1)下降明显,氮源冲击1 d后(S2),反硝化相关功能基因napA/B/C、nirK、nirS及nosZ表达量显著上升(p<0.05),S2阶段反硝化相关功能基因表达量升高,其反硝化活性增强,系统中的有机物被反硝化菌利用,进而减少了有机物对厌氧氨氧化菌活性的抑制.另外,narG/H基因表达受到氮源冲击后(S1~S3)表达丰度没有显著差异,有研究显示narG基因丰度受NO3--N浓度变化的影响不显著〔29-30〕.随着反应时间的延长,硝酸盐还原基因中除napA/B/C基因表达量显著下降,narB/C/G/H/I/J/Y/Z基因表达量均呈显著上升趋势,而nosZ基因表达量无显著变化.表明在长期适应过程中,细胞周质中的硝酸盐还原活动减弱,细胞内硝酸盐还原活动相对上升,而一氧化氮还原为氮气的氮代谢过程并未加强.与进水改变前(S0)比较,稳定时期(S4)的硝酸盐还原酶基因narG/H、narI/J、narY/Z和异化硝酸盐还原为铵的关键基因nrfA/B/C/D均呈显著上升趋势,铵化的相关功能菌(Calorithrix)的丰度(5.8%)与氮源冲击前的丰度(2.5%)相比也明显上升,表明在稳定阶段Calorithrix在短程反硝化过程中起到重要作用,narG基因已被证实在短程反硝化中发挥关键作用〔31〕,高浓度硝酸盐和碳源能促进异化硝酸盐为铵的反应活性〔32〕. ...
Vegetated ditches for treatment of surface water with highly fluctuating water regime
1
2011
... 硝酸盐还原基因napA/B/C和narB/C、亚硝酸盐还原基因nirS和一氧化二氮还原酶基因nosZ的表达量在进水硝酸盐和碳源升高2 h后(S1)下降明显,氮源冲击1 d后(S2),反硝化相关功能基因napA/B/C、nirK、nirS及nosZ表达量显著上升(p<0.05),S2阶段反硝化相关功能基因表达量升高,其反硝化活性增强,系统中的有机物被反硝化菌利用,进而减少了有机物对厌氧氨氧化菌活性的抑制.另外,narG/H基因表达受到氮源冲击后(S1~S3)表达丰度没有显著差异,有研究显示narG基因丰度受NO3--N浓度变化的影响不显著〔29-30〕.随着反应时间的延长,硝酸盐还原基因中除napA/B/C基因表达量显著下降,narB/C/G/H/I/J/Y/Z基因表达量均呈显著上升趋势,而nosZ基因表达量无显著变化.表明在长期适应过程中,细胞周质中的硝酸盐还原活动减弱,细胞内硝酸盐还原活动相对上升,而一氧化氮还原为氮气的氮代谢过程并未加强.与进水改变前(S0)比较,稳定时期(S4)的硝酸盐还原酶基因narG/H、narI/J、narY/Z和异化硝酸盐还原为铵的关键基因nrfA/B/C/D均呈显著上升趋势,铵化的相关功能菌(Calorithrix)的丰度(5.8%)与氮源冲击前的丰度(2.5%)相比也明显上升,表明在稳定阶段Calorithrix在短程反硝化过程中起到重要作用,narG基因已被证实在短程反硝化中发挥关键作用〔31〕,高浓度硝酸盐和碳源能促进异化硝酸盐为铵的反应活性〔32〕. ...
Quantify the contribution of anammox for enhanced nitrogen removal through metagenomic analysis and mass balance in an anoxic moving bed biofilm reactor
1
2019
... 硝酸盐还原基因napA/B/C和narB/C、亚硝酸盐还原基因nirS和一氧化二氮还原酶基因nosZ的表达量在进水硝酸盐和碳源升高2 h后(S1)下降明显,氮源冲击1 d后(S2),反硝化相关功能基因napA/B/C、nirK、nirS及nosZ表达量显著上升(p<0.05),S2阶段反硝化相关功能基因表达量升高,其反硝化活性增强,系统中的有机物被反硝化菌利用,进而减少了有机物对厌氧氨氧化菌活性的抑制.另外,narG/H基因表达受到氮源冲击后(S1~S3)表达丰度没有显著差异,有研究显示narG基因丰度受NO3--N浓度变化的影响不显著〔29-30〕.随着反应时间的延长,硝酸盐还原基因中除napA/B/C基因表达量显著下降,narB/C/G/H/I/J/Y/Z基因表达量均呈显著上升趋势,而nosZ基因表达量无显著变化.表明在长期适应过程中,细胞周质中的硝酸盐还原活动减弱,细胞内硝酸盐还原活动相对上升,而一氧化氮还原为氮气的氮代谢过程并未加强.与进水改变前(S0)比较,稳定时期(S4)的硝酸盐还原酶基因narG/H、narI/J、narY/Z和异化硝酸盐还原为铵的关键基因nrfA/B/C/D均呈显著上升趋势,铵化的相关功能菌(Calorithrix)的丰度(5.8%)与氮源冲击前的丰度(2.5%)相比也明显上升,表明在稳定阶段Calorithrix在短程反硝化过程中起到重要作用,narG基因已被证实在短程反硝化中发挥关键作用〔31〕,高浓度硝酸盐和碳源能促进异化硝酸盐为铵的反应活性〔32〕. ...
Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle
1
2011
... 硝酸盐还原基因napA/B/C和narB/C、亚硝酸盐还原基因nirS和一氧化二氮还原酶基因nosZ的表达量在进水硝酸盐和碳源升高2 h后(S1)下降明显,氮源冲击1 d后(S2),反硝化相关功能基因napA/B/C、nirK、nirS及nosZ表达量显著上升(p<0.05),S2阶段反硝化相关功能基因表达量升高,其反硝化活性增强,系统中的有机物被反硝化菌利用,进而减少了有机物对厌氧氨氧化菌活性的抑制.另外,narG/H基因表达受到氮源冲击后(S1~S3)表达丰度没有显著差异,有研究显示narG基因丰度受NO3--N浓度变化的影响不显著〔29-30〕.随着反应时间的延长,硝酸盐还原基因中除napA/B/C基因表达量显著下降,narB/C/G/H/I/J/Y/Z基因表达量均呈显著上升趋势,而nosZ基因表达量无显著变化.表明在长期适应过程中,细胞周质中的硝酸盐还原活动减弱,细胞内硝酸盐还原活动相对上升,而一氧化氮还原为氮气的氮代谢过程并未加强.与进水改变前(S0)比较,稳定时期(S4)的硝酸盐还原酶基因narG/H、narI/J、narY/Z和异化硝酸盐还原为铵的关键基因nrfA/B/C/D均呈显著上升趋势,铵化的相关功能菌(Calorithrix)的丰度(5.8%)与氮源冲击前的丰度(2.5%)相比也明显上升,表明在稳定阶段Calorithrix在短程反硝化过程中起到重要作用,narG基因已被证实在短程反硝化中发挥关键作用〔31〕,高浓度硝酸盐和碳源能促进异化硝酸盐为铵的反应活性〔32〕. ...














 津公网安备 12010602120337号
津公网安备 12010602120337号