文献〔12-14〕表明:绝大多数锰氧化菌的最适pH约为6.5~8.5,强酸强碱环境会影响其氧化Mn2+活性。Danhua ZHOU等〔15〕研究了恶臭假单胞菌MnB1在不同pH条件下对15 mg/L Mn2+的氧化行为,发现当pH为7.5时,反应约30 h后无定形β-MnO2的质量浓度可达10 mg/L,然而当pH降为5.6时,反应40 h后,仅有2 mg/L的锰氧化物生成。郑金〔16〕从山东泰安棕壤结核分离出了芽孢杆菌T1151,该菌在pH为7.0的条件下对82 mg/L Mn2+的氧化率最大,然而当pH条件为4.0或9.0时,几乎检测不到高价锰的存在。由此可见,尽管在中性条件下生物氧化除锰法具有环保高效的优点,但是我国锰矿废水酸性强,将严重抑制锰氧化菌的氧化活性。因此,从特定环境中筛选耐酸锰氧化菌并研究其氧化行为、动力学过程对生物除锰法处理含锰酸性废水具有重大意义。
因此,本研究以中国锰都湘潭污水处理厂的活性污泥为菌株来源,筛选耐酸性锰氧化菌,考察其生长能力,以及pH、溶液初始Mn(Ⅱ)浓度、接种量等因素对锰氧化菌除锰行为的影响,结合产物形貌、物质形态与化学组成,以及反应过程动力学分析,揭示该耐酸性锰氧化菌除锰特性,从而为生物锰氧化法处理酸性含锰废水的大规模应用提供研究基础和科学依据。
1 材料和方法
1.1 锰氧化菌的富集与分离
首先,量取15 mL湘潭市(河西)污水处理厂曝气池的活性污泥,加入含有90 mL无菌水的锥形瓶中,振荡45 min,静置30 min;然后,取1 mL上清液接种于PYCM液体培养基中,置于培养箱中于30 ℃、150 r/min条件下培养1~2 d;最后,取0.1 mL上清液稀释为原有浓度的10-1、10-2、10-3,分别涂布在PYCM固体平板培养基上,培养48 h后,挑取单菌落在JFM固体培养基平板上进行平板划线纯化培养,直到长出单个菌落。
PYCM培养基:蛋白胨0.8 g,酵母浸膏0.2 g,K2HPO4 0.1 g,MgSO4·7H2O 0.2 g,MnSO4·H2O 0.2 g,CaCl2 0.1 g,(NH4)2SO4 0.1 g,NaNO3 0.2 g,去离子水1 L,调节pH至7.0。
JFM培养基:MgSO4·7H2O 0.5 g,(NH4)2SO4 0.5 g,NaNO3 0.5 g,CaCl2 0.2 g,K2HPO4 0.5 g,柠檬酸铁铵 10 g,MnSO4·H2O 0.5 g,去离子水1 L,调节pH至7.0。
1.2 筛选所得耐酸性锰氧化菌形态特征与菌种鉴定
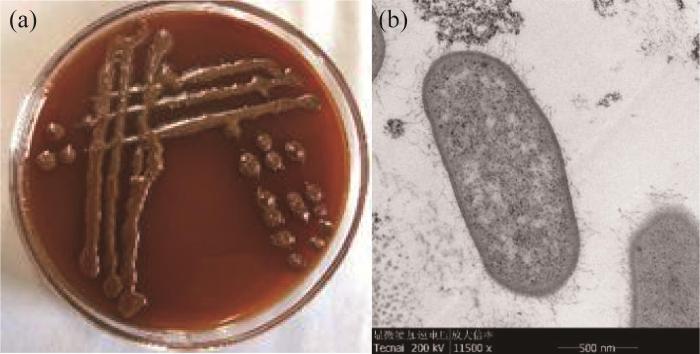
菌株形态特征测试:首先,用0.1 mol/L pH为7.35的磷酸盐缓冲液清洗菌体,将离心管里的微生物轻轻吹散后转移到1.5 mL的EP管内,自然沉降1 h后轻轻弃去上清液;然后,沿管壁缓缓加入1 mL新预冷2.5%戊二醛进行固定,再采用透射电镜TEM(FEI:Tecnai F20 S-TWIN)观察菌株细胞结构特征。
菌种鉴定:首先,将纯化得到的菌体接种至JFM培养基,培养至对数期后离心收集菌体,其次,提取微生物为扩增模板中提取其DNA,选用16SrRNA基因V3 V4区正向引物341F和反向引物805R对样品DNA进行PCR扩增;PCR扩增条件为94 ℃预变性5 min、35个循环变性(94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s);然后,对产物进行电泳检测,并用 DNA Gel Extraction Kt进行凝胶回收,由上海生工生物工程公司完成测序;最后,将获得基因序列上传NCBI并与已有的相似度高的序列进行比对、BLAST分析和同源性分析,再用MEGA软件构建发育树。
1.3 不同条件下锰氧化菌氧化除Mn(Ⅱ)行为特征
研究不同pH、污染物浓度、接种量条件下锰氧化菌去除溶液中Mn(Ⅱ)行为,通常将菌株按2%接种率接种到Mn(Ⅱ)溶液中,在30 ℃、150 r/min条件下培养,取样周期为168 h,每次间隔24 h。在探究pH对生物氧化除锰的影响实验中,Mn(Ⅱ)初始质量浓度为10 mg/L,pH分别为2.0、3.0、4.0、5.0、6.0、7.0和8.0;在探究Mn(Ⅱ)浓度对锰氧化菌除锰的影响实验中,于培养基pH为7.0条件下,配制初始Mn(Ⅱ)质量浓度分别为10、20、30、40、50 mg/L;在探究菌液接种量对锰氧化菌除锰的影响实验中,于培养基pH为7.0,Mn(Ⅱ)质量浓度为20 mg/L条件下,按照体积分数分别为0.6%、1.0%、1.4%、2.0%、3.0%、4.0%的接种量,考察生物氧化除锰的行为。
1.4 产物SEM-EDS、XPS及FTIR表征
反应后,对固体产物进行离心收集、充分洗涤后干燥并研磨。对上述样品采用扫描电镜-能谱(SEM-EDS 日立:S4800 JEOL:7800F)分析其形貌特征与物质组成;采用X射线光电子能谱仪(赛默飞世尔:Escalab 250Xi)进行X射线光电子能谱(XPS)分析;采用美国赛默飞世尔公司的Nicolet 670型傅里叶红外光谱仪,将样品与KBr以1∶100的质量比混合后进行压片处理,在波数为400~4 000 cm-1的扫描范围内进行测试,获得样品的化学结构和化学键的信息。
2 结果和讨论
2.1 筛选所得锰氧化菌的形态特征与鉴定
图1
图1
锰氧化菌菌落特征与细胞形态
Fig. 1
Colony characteristics and cell morphology of manganese oxidizing bacteria
对菌株进行生理生化分析,将PCR产物的16SrDNA基因序列上传到GenBank,获得GenBank登录号为MW725160。通过Neighbor-Joining Tree法构建系统发育树,见图2。
图2
图2
基于16SrDNA基因序列构建的系统发育树
Fig. 2
Phylogenetic tree based on 16SrDNA gene sequence
该锰氧化菌菌株 M3与Klebsiella sp.具有99%的同源性,命名为Klebsiella sp. Strain M3。在中国典型培养物保藏中心(CCTCC)获得细菌保藏编号:CCTCC M2021261。尽管到目前为止极少报道Klebsiella属锰氧化菌,已有林海等〔18〕从铜矿山排放废水的沟渠污泥中筛选了克雷伯氏杆菌,在酸性矿山废水中表现出了极强的耐酸性以及良好的吸附性能。
2.2 锰氧化菌氧化除Mn(Ⅱ)行为特征
2.2.1 pH对锰氧化菌除锰效果影响
由于我国锰矿废水大部分偏酸性,笔者主要考察了pH为2.0~8.0时,锰氧化菌氧化去除Mn(Ⅱ)效果,结果见图3。
图3
由图3可知,当pH为6.0~8.0时,反应168 h后,菌株的Mn(Ⅱ)去除率为95.51%~98.93%,然而当pH分别为5.0、4.0、3.0、2.0时,除锰率分别为73.33%、52.2%、36.01%、0%,可见在pH为中性的条件下,菌株除锰效果不错,然而随着pH的降低,去除率显著下降,这是因为在中性条件下绝大部分微生物的生长状态良好且活性强〔19〕,过酸条件会抑制锰氧化菌分泌多酮氧化酶从而导致对于Mn(Ⅱ)的去除效果下降。一般当pH为5.0时,锰氧化菌几乎不具有氧化性能〔20〕,然而在本研究中,当pH为3.0~5.0时,菌株M3仍然能够去除36.01%~73.33%的Mn(Ⅱ)。总之,与已发表的锰氧化菌相关研究〔21-22〕相比,本研究所获得的Klebsiella sp. Strain M3在酸性条件下氧化Mn(Ⅱ)能力明显增强。
2.2.2 Mn(Ⅱ)初始浓度对锰氧化菌除锰效果影响
Mn(Ⅱ)初始浓度对菌株除锰效果影响见图4。
图4
图4
Mn(Ⅱ)初始浓度对锰氧化菌除锰效果的影响
Fig. 4
Effect of Mn(Ⅱ) concentration on Mn(Ⅱ) removal of strain
2.2.3 接种量对锰氧化菌除锰效果的影响
接种量对锰氧化菌除锰效果的影响见图5。
图5
图5
接种量对锰氧化菌除锰效果的影响
Fig. 5
Effect of inoculation amount on Mn(Ⅱ) removal of strain
由图5可知,菌液接种量较低时,锰氧化菌对Mn(Ⅱ)的去除率明显要差于菌液接种量较高时;随着菌液接种量升高,Mn(Ⅱ)的去除率逐渐上升,且接种量越高,Mn(Ⅱ)浓度随时间降低得越快,除锰率越早趋于平缓,接种量在20%以上最终去除率都能达到95%以上。另外,当锰氧化菌菌液接种量只有0.6%时,经过7 d去除反应后Mn(Ⅱ)溶液质量浓度从10 mg/L降低到4 mg/L以下,去除率高达 61.3%,再次表明锰氧化菌菌株耐锰性强,即使投加很少的量在锰溶液中也能体现出较好的Mn(Ⅱ)去除效果。
2.3 表征结果
锰氧化菌氧化锰后产物的扫描电镜图(a)及EDS(b)结果见图6。
图6
图6
锰氧化菌氧化锰后产物的扫描电镜图(a)及EDS(b)结果
Fig. 6
Scanning electron micrographs and EDS results of manganese oxidation products from manganese oxidizing bacteria
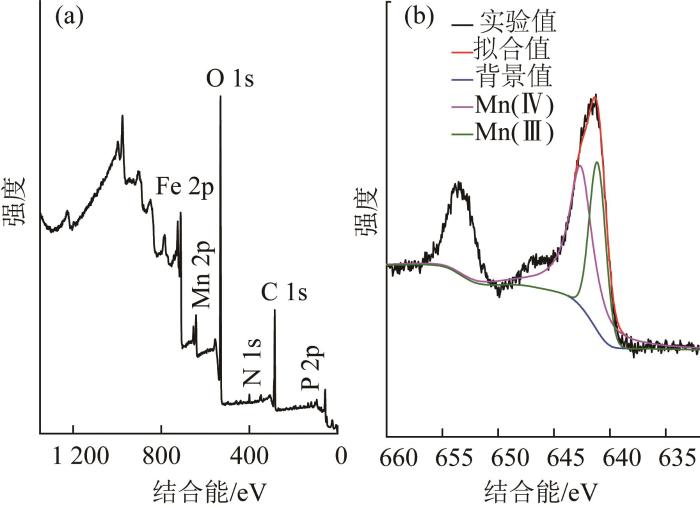
图7
图7
锰氧化菌除锰产物XPS全图谱(a)和反应后产物Mn 2p高分辨图谱(b)
Fig. 7
XPS spectrum of manganese removal products by manganese oxidizing bacteria(a) and high resolution spectrum of Mn 2p after reaction(b)
由图7(a)可知,出现的特征峰有Mn 2p、O 1s、Fe 2p、N 1s、C 1s、和P 2p,其中Mn 2p特征峰的出现再次表明锰氧化菌与溶液中Mn(Ⅱ)发生作用,从而有效地将Mn(Ⅱ)从溶液中转移到沉淀物。由图7(b)可知,Mn 2p结合能有两个主峰Mn 2p1/2和Mn 2p3/2,Mn 2p1/2和Mn 2p3/2的电子结合能分别为653.35 eV、641.65 eV,其中Mn 2p3/2在图谱中的谱峰不对称,Mn可能存在不止一种化学价态。后续使用XPS Peak软件对Mn 2p的特征峰进行分峰拟合,其中,电子结合能642.6 eV和641.1 eV分别对应Mn(Ⅳ)和Mn(Ⅲ)的特征峰〔22〕,Mn(Ⅳ)和Mn(Ⅲ)峰面积比约为1.71∶1,说明溶液中Mn(Ⅱ)确实被大量氧化成高价态MnO2与MnOOH。晏平〔19〕研究发现菌株Aminobacter sp. H1对Mn(Ⅱ)氧化后所产生的固体产物主要成分为MnCO3、MnOOH、Mn3O4和MnO2。本研究所筛菌株除锰机理主要以生物氧化为主,目前一般认为微生物在繁殖过程中产生的胞外锰氧化酶可催化相关反应直接氧化Mn2+,其中多铜氧化酶在细菌氧化锰过程中起重要的作用〔17,19〕。
锰氧化菌除锰后产物的FTIR结果见图8。
图8
图8
锰氧化菌除锰后产物的FTIR结果
Fig. 8
FTIR results of manganese oxide products after manganese removal
2.4 生物除锰动力学
常用的生物反应动力学方程有细胞生长动力学模型、底物消耗动力学模型、产物形成动力学模型〔28〕,本研究属于生化反应底物消耗动力学模型,主要采用假一级动力学研究菌株在不同污染物浓度范围内的去除特性。即ln(C/C0)=Kt,整理后得:
C=C0e-Kt
式中:K——反应速度常数,min-1;
C——剩余锰质量浓度,mg/L;
C0——初始锰质量浓度,mg/L;
t——反应时间,min。
且半衰期(
本实验采用假一级动力学方程对锰氧化菌除锰进行动力学拟合分析,将实验得到的剩余锰浓度随菌液接触时间的变化曲线进行指数函数拟合,拟合结果见图9。
图9
图9
剩余锰浓度随接触时间的变化
Fig. 9
Residual manganese concentration changes with contact time
表1 生物氧化锰动力学参数
Table 1
| C0/(mg·L-1) | 9.8 | 17.84 | 28.54 | 38.7 | 47.85 |
|---|---|---|---|---|---|
| K/h-1 | 0.027 | 0.013 | 0.010 | 0.007 | 0.004 |
| R2 | 0.993 | 0.904 | 0.948 | 0.963 | 0.928 |
| 26.08 | 53.55 | 71.15 | 99.14 | 170.69 |
3 结论
(1)分离筛选出一株耐酸性锰氧化菌菌株(命名为Klebsiella sp. Strain M3),其在固体培养基上呈凸起状,红褐色且具有金属光泽。Mn(Ⅱ)质量浓度达到1 000 mg/L时,菌株生长受限但依然能够生长,具有很强的锰耐受能力。
(2)Klebsiella sp. Strain M3最适pH为7.0,去除率能达到98.93%。Mn(Ⅱ)初始浓度越高,菌株除锰率越低,随着接种量的增加,除锰率则会上升。
(3)通过产物SEM-EDS、FTIR、XPS表征发现:锰氧化菌氧化Mn(Ⅱ)后菌体表面有纳米级颗粒物产生,Fe、Mn含量较高,Mn—O健、Fe—O键的伸缩振动表明产物中存在铁锰氧化物,反应产物中Mn主要以Mn(Ⅲ)和Mn(Ⅳ)价态存在,证实了溶液中Mn(Ⅱ)确实被大量氧化成高价态MnO2及部分MnOOH。
(4)该生物氧化锰动力学遵循假一级动力学方程,随着Mn(Ⅱ)初始浓度的增加,反应速率常数降低。
参考文献
锰矿资源现状及潜力预测
[J].
A current situation of manganese resources and its technical research progress
[J].
中国锰矿资源现状与国家级锰矿床实物地质资料筛选
[J].
Current status of manganese ore resources in China and selecting for national physical geological data of manganese ore deposits
[J].
广东大宝山矿区锰污染的分布规律和季节影响
[J].
Distribution and seasonal influence of manganese contamination in Dabaoshan mine,Guangdong Province
[J].
Treatment of high-manganese mine water with limestone and sodium carbonate
[J].
湘潭锰矿的酸性水污染及其防治对策
[J].
Acid water pollution in Xiangtan manganese mine and the prevention and control of it
[J].
矿山高浓度酸性含锰废水处理的研究与工程实施
[J].
Experimental research and engineering practice of the treatment of high-concentration acidic mining wastewater containing manganese
[J].
Ambient manganese exposure is negatively associated with human sperm motility and concentration
[J].
Analysis of a distinct speech disorder seen in chronic manganese toxicity following Ephedrone abuse
[J].
Removal of manganese(Ⅱ) from drinking water by aeration process using an airlift reactor
[J].
A review of technologies for manganese removal from wastewaters
[J].
生物法去除地下水中铁锰的研究进展
[J].
Research progress on iron and manganese removal from underground water by biological method
[J].
Microbial manganese oxide formation and interaction with toxic metal ions
[J].
DGGE diversity of manganese mine samples and isolation of a Lysinibacillus sp. efficient in removal of high Mn(Ⅱ) concentrations
[J].
Effect of drinking water treatment process parameters on biological removal of manganese from surface water
[J].
Heavy metal adsorption with biogenic manganese oxides generated by Pseudomonas putida strain MnB1
[J].
一株锰氧化菌对Mn2+的氧化及其产物的表征和特性研究
[D].
Mn2+ oxidization by a manganese-oxiding bacterium and the characteristics and properties of its products
[D].
锰氧化菌Bacillus sp
MK3-1的Mn(Ⅱ)氧化特性和除锰能力研究[J].
Mn(Ⅱ) oxidation and removal by a manganese-oxidizing Bacterium Bacillus sp. MK3-1
[J].
克雷伯氏杆菌用于BAF吸附矿山酸性废水中Cu2+
[J].
Klebsiella sp. used in BAF adsorption of mine acid wastewater containing copper ion
[J].
锰氧化菌Aminobacter sp. H1的分离鉴定及其锰氧化机制研究
[J].
Isolation and identification of Mn oxidizing bacterium Aminobacter sp. H1 and its oxidation mechanism
[J].
锰氧化菌Arthrobacter sp. HW-16的锰氧化特性和氧化机制
[J].
Manganese oxidation characteristics and oxidation mechanism of a manganese-oxidizing bacterium Arthrobacter sp. HW-16
[J].
微生物与重金属相互作用过程与机制研究进展
[J].
Progress in the study of interaction process and mechanism between microorganism and heavy metal
[J].
Interpretation of XPS Mn(2p) spectra of Mn oxyhydroxides and constraints on the mechanism of MnO2 precipitation
[J].
Highly efficient removal of bivalent heavy metals from aqueous systems by magnetic porous Fe3O4-MnO2:Adsorption behavior and process study
[J].
Component analysis of extracellular polymeric substances(EPS) during aerobic sludge granulation using FTIR and 3D-EEM technologies
[J].
氧化石墨烯-锰氧化物复合物的制备及对铀的吸附性能
[J].
Preparation and adsorption performance of a graphene oxide-manganese oxide hybrid for uranium removal
[J].
Mn-catalyzed oxidation of multiple-ringed aromatics
[J].
Arthrobacter echigonensis介导生物氧化锰形成的机制及生物氧化锰的成分
[J].
Biogenic manganese oxides component and formation mechanisms catalysed by Arthrobacter echigonensis
[J].












 津公网安备 12010602120337号
津公网安备 12010602120337号