本研究以毛用活性红染料PW-6g为筛选底物,从土壤中分离出1株具有高活性偶氮染料降解脱色酶系的细菌。进一步对该菌株的脱色性能进行了研究,并利用高效液相色谱法对染料脱色代谢产物进行了分析,验证了染料的微生物脱色代谢过程,以期为工业化生物处理印染废水提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 供试土样和试剂
供试土样采自海南东寨港红树林自然保护区浅滩土壤;毛用活性红PW-6g购自天津德凯化工股份有限公司。
1.1.2 培养基
(1)富集培养基。PW-6g 0.2 g,NH4NO3 4.0 g,K2HPO4·3H2O 0.5 g,KH2PO4 0.5 g,MgSO4·7H2O 0.3 g,微量元素溶液1 mL,加水至1 000 mL,调pH至7.0。微量元素溶液配方:FeSO4·7H2O 0.5 g,MnSO4·H2O 0.15 g,ZnSO4 0.14 g,无水CaCl2 0.1 g,加水至1 000 mL。
(2)富集固体培养基。在富集培养基的基础上添加2%的琼脂。
(3)增殖培养基。牛肉膏3.0 g,葡萄糖5.0 g,蛋白胨2.0 g,KH2PO4 1.8 g,NaH2PO4 3.5 g,FeSO4·7H2O 0.03 g,MnSO4·H2O 0.02 g,MgSO4·7H2O 0.20 g,ZnSO4 0.05 g,无水CaCl2 0.01 g,加水至1 000 mL,调pH至7.0。
(4)增殖固体培养基。在富集培养基的基础上添加2%的琼脂。
(5)脱色降解培养基。在富集培养基的基础上添加一定量的毛用活性红PW-6g。
1.2 实验方法
1.2.1 菌株的分离
取5.0 g供试土样加入到含10 mL富集培养基(PW-6g质量浓度为50 mg/L)的250 mL锥形瓶中,30 ℃、150 r/min富集振荡培养,7 d后接种5 mL培养液到含PW-6g的富集培养基中(染料浓度成倍增大),培养4个周期使PW-6g最终质量浓度达到400 mg/L。以划线法接种第4次富集的培养液(PW-6g质量浓度为400 mg/L)于含400 mg/L PW-6g的富集固体培养基上,30 ℃下培养2 d,分离得到单菌落。经培养获得4株在高浓度PW-6g为唯一碳源的富集固体培养基平板上能生长的细菌。将其多次划线纯化后保存于增殖固体培养基斜面上。
1.2.2 酶活测试
将4株菌分别培养在含有400 mg/L PW-4 g的增殖培养基中,在30 ℃下培养24 h(pH为7.0),8 000 r/min离心分离15 min。上清液用于胞外酶活测定。沉淀细胞重悬于pH为7.2的0.1 mol/L磷酸缓冲盐溶液中进行超声处理,在4 ℃下超声10次,每次20 s,每次超声间隔10 s,功率为200W。然后将细胞破碎液再次离心,取上清液用于胞内酶活测定。
(1)偶氮还原酶(AZOR)。通过监测482 nm吸光度的减少量来计算AZOR酶活。1 mL反应体系:0.1 mol/L磷酸缓冲盐溶液(pH为7.0),1 mmol/L NADH,24 μmol/L橙黄Ⅱ,10 μL酶液。1个酶活力单位定义为每min还原1 μmol橙黄Ⅱ所需的酶量。
(2)苯胺双加氧酶(ADO)。通过监测氧消耗的量来计算胞内ADO酶活。取离心后的细胞沉淀,细胞重悬于10 mmol/L磷酸缓冲盐溶液(pH为7.0)中,制得细胞悬液。1 mL反应体系:预先氧饱和的10 mmol/L磷酸缓冲盐溶液(pH为7.0),1 mmol/L苯胺,1 mL细胞悬液。以不加苯胺的反应体系测定细胞本底呼吸。测定结束后,将反应液收集,反复离心洗涤3次后,烘干至恒重,计算细胞干重。1个酶活力单位定义为每min氧化苯胺消耗1 mg O2所需的细胞量。
(3)苯甲酸-1,2-双加氧酶(B12O)。通过监测340 nm吸光度的减少计算B12O酶活。1 mL反应体系:0.1 mol/L 2-(N-吗啡啉)乙磺酸缓冲盐溶液(pH为6.7),1 mmol/L苯甲酸钠,0.13 mmol/L NADH,10 μL酶液。1个酶活力单位定义为每min氧化1 μmol NADH所需的酶量。
(4)邻苯二酚-1,2-双加氧酶(C12O)。通过监测260 nm吸光度的增加计算C12O酶活。1 mL反应体系:8.7 mmol/L酒石酸缓冲盐溶液(pH为7.0),1 mmol/L EDTA,0.1 mmol/L邻苯二酚,10 μL酶液。1个酶活力单位定义为每min产生1 μmol己二烯二酸所需的酶量。
(5)邻苯二酚-2,3-双加氧酶(C23O)。通过监测375 nm吸光度的增加计算C23O酶活。1 mL反应体系:48 mmol/L酒石酸缓冲盐溶液(pH为7.5),1 mmol/L EDTA,0.1 mmol/L邻苯二酚,10 μL酶液。1个酶活力单位定义为每min产生1 μmol 2-羟基己二烯半醛酸所需的酶量。
(6)蛋白含量测定。以牛血清白蛋白为标准蛋白采用Lowry法测定蛋白浓度。
1.2.3 16S rDNA序列系统分析
对菌株Mabhk-3的16S rDNA序列测序由上海生工生物工程技术服务有限公司完成。将菌株的16S rDNA序列在NCBI中与相关的16S rDNA序列进行同源性比较,在16S rDNA序列分析的基础上,采用MEGA程序构建系统发育树。
1.2.4 降解脱色实验
接种菌株Mabhk-3放至增殖培养基中,30 ℃、150 r/min振荡培养16 h,细胞浓度约为4.0×108CFU/mL。按5%(体积分数,下同)的量接种菌悬液至含200 mL脱色降解培养基(PW-6g质量浓度为400 mg/L)的500 mL锥形瓶中,30 ℃、150 r/min振荡培养48 h。将培养液于5 000 r/min离心15 min,上清液于PW-6 g的最大吸收波长498 nm下测定其吸光度A1,以不接菌悬液的脱色降解培养基的吸光度A2为对照,计算脱色率。
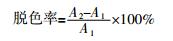
(1)PW-6g质量浓度对脱色率的影响。按5%的量将菌悬液接入PW-6g初始质量浓度分别为100、200、300、400、500、600、700 mg/L的200 mL脱色降解培养基中,在30 ℃、转速为150 r/min的摇床中培养脱色48 h,测定吸光度并计算脱色率。
(2)温度对脱色率的影响。按5%的量将菌悬液分别接入含400 mg/L PW-6g的200 mL脱色降解培养基中,置于温度分别为20、25、30、35、40、45、50 ℃,转速为150 r/min的摇床中培养脱色48 h,测定并计算脱色率。
(3)pH对脱色率的影响。按5%的量将菌悬液分别接入pH分别为3.5、4.5、5.5、6.5、7.5、8.5、9.5含400 mg/L PW-6g的200 mL脱色降解培养基中,在30 ℃、转速为150 r/min的摇床中培养脱色48 h,测定吸光度并计算脱色率。
(4)接种量对脱色率的影响。按2%、3%、4%、5%、6%、7%、8%的量将菌悬液分别接入pH为7.0的含400 mg/L PW-6g的200 mL脱色降解培养基中,在30 ℃、转速为150 r/min的摇床中培养脱色48 h,测定吸光度并计算脱色率。
(5)盐浓度对脱色率的影响。按5%的量将菌悬液分别接入pH为7.0的含400 mg/L PW-6 g的200 mL脱色降解培养基中(NaCl质量浓度为0、10、20、30、40、50 g/L),在30 ℃、转速为150 r/min的摇床中培养脱色48 h,测定吸光度并计算脱色率。
1.2.5 脱色代谢产物分析
取最适脱色条件下经48 h脱色的脱色液100 mL经10 000 r/min离心10 min,取上清液,进行HPLC分析。分析条件:色谱柱为月旭科技(上海)股份有限公司生产的Ultimate®AQ-C18,5 μm,4.6×250 mm;流动相:V(甲醇):V(20 mmol/L乙酸铵溶液)=5:95;流速为1.0 mL/min;柱温为25 ℃;检测波长为254 nm。
2 结果与讨论
2.1 脱色菌的分离和鉴定
从红树林土壤中分离到4株能以毛用活性染料PW-6g为唯一碳源的脱色细菌菌株。经纯培养后,对其AZOR、ADO、B12O、C12O、C23O的酶活性进行测定,结果见表1。
表1 PW-6g脱色前后上清液(胞外)和细胞内的酶活性
| 酶(U-mg-1) | 对照组(0h) | 实验组(24h) | |||||||||||||||||
| 胞内 | 胞外 | 胞内 | 胞外 | ||||||||||||||||
| Mabhk-1 | Mabhk-2 | Mabhk-3 | Mabhk—4 | Mabhk-1 | Mabhk-2 | Mabhk-3 | Mabhk-4 | Mabhk-1 | Mabhk-2 | Mabhk-3 | Mabhk-4 | Mabhk-1 | Mabhk-2 | Mabhk-3 | Mabhk-4 | ||||
| AZOR | 1.867 7±0.001 3 | 1.736 4±0.004 3 | 1.362 0±0.001 8 | 1.017 0±0.006 4 | 1.095 7±0.003 4 | 1.847 3±0.007 8 | 1.679 5±0.008 5 | 1.360 5±0.009 4 | 3.433 0±0.000 7* | 3.712 3±0.005 8* | 5.123 5±0.002 3* | 2.743 1±0.005 1* | 1.267 7±0.003 3 | 1.736 4±0.009 5 | 1.362 0±0.002 6 | 1.617 0±0.007 0 | |||
| ADO | 40±4 | 48±6 | 41±5 | 40±4 | — | — | — | — | 45±6 | 42±4 | 95±2* | 43±3 | — | — | — | — | |||
| B12O | 1.247 7±0.003 3 | 1.223 6±0.004 6 | 1.336 3±0.007 9 | 1.043 7±0.005 0 | 0.007 5±0.006 1 | 0.003 5±0.003 2 | 0.004 7±0.002 6 | 0.000 8±0.000 3 | 3.510 9±0.004 2* | 1.923 7±0.007 9 | 3.225 1±0.009 2* | 1.616 4±0.006 8 | 4.247 7±0.002 9* | 1.223 6±0.000 3* | 2.836 3±0.006 9* | 1.043 7±0.004 1* | |||
| C12O | 1.285 4±0.006 1 | 1.555 9±0.004 1 | 1.803 2±0.004 7 | 1.772 3±0.002 9 | 0.005 3±0.001 9 | 0.002 9±0.001 2 | 0.002 8±0.001 3 | 0.008 0±0.004 9 | 1.638 7±0.005 0 | 1.456 3±0.008 1 | 4.209 3±0.009 7* | 4.725 5±0.002 5* | 1.285 4±0.009 2* | 1.555 9±0.006 6* | 2.803 2±0.003 7* | 3.772 3±0.001 5* | |||
| C23O | 1.256 5±0.000 7 | 1.928 5±0.006 3 | 1.096 1±0.003 9 | 1.861 7±0.004 9 | 0.007 2±0.006 1 | 0.001 8±0.000 8 | 0.006 0±0.003 1 | 0.003 2±0.000 6 | 1.637 5±0.002 7 | 3.211 0±0.009 3* | 3.583 8±0.006 3* | 1.961 6±0.002 5 | 1.256 5±0.001 6* | 1.928 5±0.007 1* | 2.696 1±0.000 2* | 1.861 7±0.005 7* | |||
注:表中值均为3次实验平均值±标准误差(SEM).*表示与对照组相比的显著性差异p < 0.01.
由表1可知,4株菌经24 h的脱色诱导,均呈现较强的胞内偶氮还原酶活力。其中,Mabhk-3的AZOR活力最强。经PW-6g诱导后,Mabhk-3的ADO活性最强,比对照组提高了132%;Mabhk-1和Mabhk-3的B12O活性显著增加,分别提高了181%和141%;Mabhk-3和Mabhk-4的C23O活性也显著增加,分别提高了133%和167%;Mabhk-2和Mabhk-3的C23O活性也显著增加,分别提高了66%和227%。而且,PW-6g能够促进B12O、C12O、C23O向胞外释放,因此在胞外也检测到较强的酶活性。
由毛用活性红PW-6g分子结构〔9〕可知,PW-6g的降解始于偶氮键的断裂,且在降解过程中会产生有毒的苯胺类化合物。因此,AZOR和ADO的活性对PW-6g的降解尤为重要。综合酶活性结果,Mabhk-3在PW-6g诱导下具有较强的PW-6g降解能力。
Mabhk-3的16S rDNA碱基长度为896碱基对(bp)。将Mabhk-3的16S rDNA测序结果与GenBank中现有的菌种16S rDNA基因序列进行比对,发现Mabhk-3与多株芽孢杆菌16S rDNA核苷酸序列的同源性较高,均达到99%以上,依据此结果,Mabhk-3可归属于芽孢杆菌纲芽孢杆菌目芽孢杆菌属。选择BLAST比对结果中相似度最高的11条16S rDNA,利用MEGA 7.0软件进行多重序列比对绘制菌株系统发育树,结果见图1。
图1
由图1可知,Mabhk-3与枯草芽孢杆菌(Bacillus subtilis UHSBs02B)同源性最高,且位于同一个分支上,故暂将该菌株命名为Bacillus subtilis Mabhk-3。
2.3 降解脱色实验
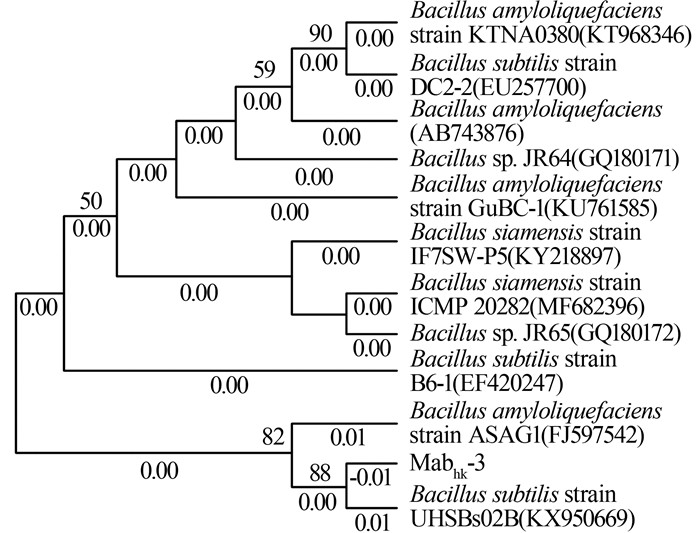
2.3.1 PW-6g初始质量浓度对脱色率的影响
考察PW-6g初始质量浓度对脱色率的影响,结果见图2。
图2
由图2可知,PW-6g初始质量浓度为100~600 mg/L时,菌株Mabhk-3 48 h的脱色率均达到97.0%以上,脱色液几乎无色,离心沉淀菌体为白色,说明菌株Mabhk-3能耐受较高浓度的PW-6g染料。PW-6g初始质量浓度达到700 mg/L时,脱色率显著降低且菌体量较少,呈深红色。结果表明,染料达到一定浓度后,一方面其毒性增强,超出了菌株的代谢阈值,影响了菌株的生长,使得菌株对染料的降解能力下降;另一方面菌体吸附了染料达到饱和,菌体周围的染料浓度过大,染料的毒性蓄积在细胞表面,影响了细胞膜的功能,导致降解率下降。结果显示,当PW-6g初始质量浓度超过600 mg/L时,采用Mabhk-3菌株进行脱色降解,需要对染料废水进行适度稀释。
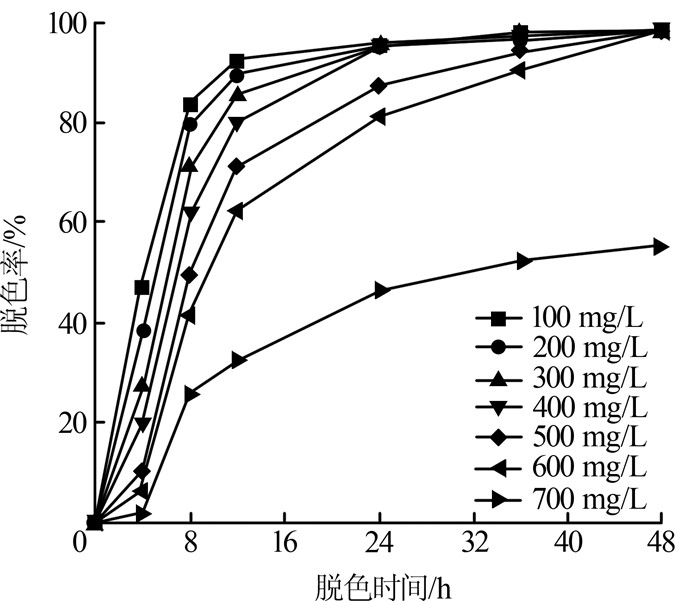
2.3.2 温度对脱色率的影响
考察温度对脱色率的影响,结果见图3。
图3
由图3可知,温度低于35 ℃时,随着温度的增加,菌株Mabhk-3对PW-6g的48 h脱色率增加,30~35 ℃时的脱色率最大,对PW-6g的脱色率接近100%;当温度大于35 ℃时,随着温度升高,脱色率下降,50 ℃时对PW-6g的脱色率仅有13%左右。这是因为35 ℃以下,温度的升高有利于细菌的生长和细胞内的酶促反应,从而利于对PW-6g的吸附降解,但温度太高,引起细菌快速的老化衰退,温度高于细胞内的酶促反应的最适温度,从而使细菌对PW-6g的吸附降解能力下降。
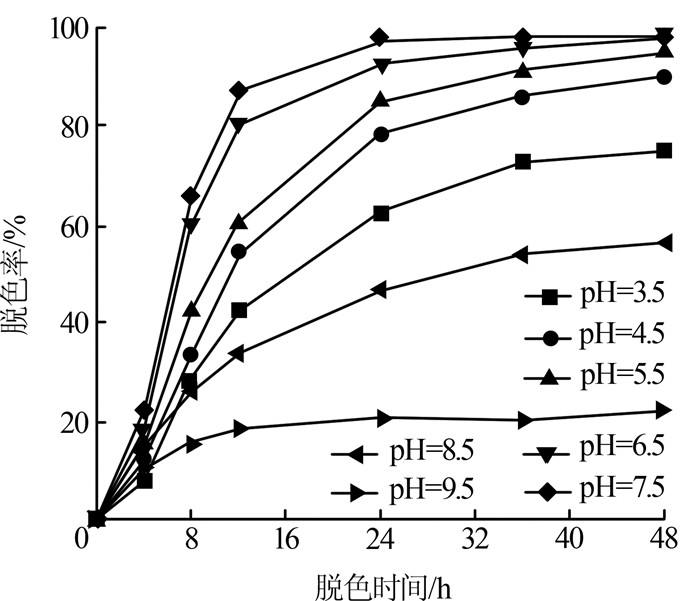
2.3.3 pH对脱色率的影响
染料分子及代谢产物均为兼性分子,其解离状态随脱色液中pH的变化而改变,直接影响PW-6g的吸附降解,考察pH对脱色率的影响,结果见图4。
图4
由图4可知,当pH低于7.5时,Mabhk-3菌株对PW-6g的脱色率随pH的升高而升高;当pH高于7.5时,脱色率随pH的升高而下降;当pH为6.5~7.5时,有最佳脱色效果,对PW-6g的12 h脱色率已经大于80%,48 h脱色率接近100%。还可以看出,pH分别为3.5、8.5时对PW-6g的48 h脱色率也大于50%,说明菌株Mabhk-3对PW-6g脱色时,有一定的pH适应范围。然而,在较碱性的pH条件(pH=9.5)下培养48 h后,脱色效率显著降低至22%,明显低于相对强酸性pH条件(pH=3.5)。因此,在利用Mabhk-3菌株对含PW-6g染料废水进行脱色时,应确保废水pH不超过8.5。
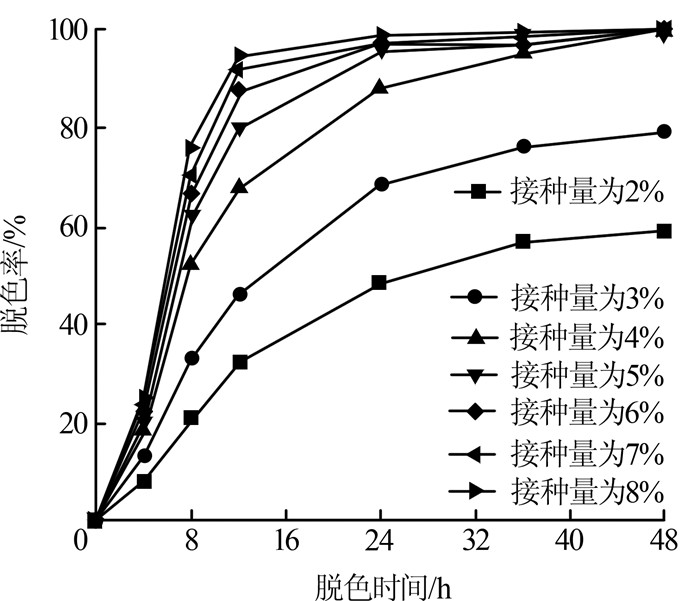
2.3.4 接种量对脱色率的影响
考察接种量对脱色率的影响,结果见图5。
图5
从图5可知,接种量为2%时,Mabhk-3菌株对PW-6g的48 h脱色率最低,仅有59%左右;随着接种量加大,脱色率逐渐增加,接种量为4%~8%时,脱色率最大,Mabhk-3对PW-6g的脱色率均接近100%。且当接种量大于4%时,脱色过程非常稳定,过大的接种量不会显著影响PW-6g的脱色降解。从考虑成本和微生物生长繁殖等角度出发,选接种量为4%比较合适。
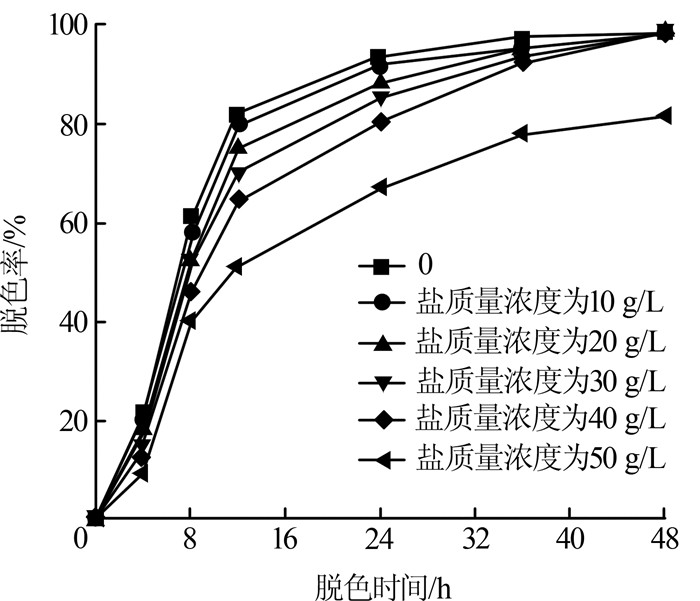
2.3.5 盐浓度
由于活性染料废水中通常含有高浓度的盐,而这些盐能够影响微生物的生长和代谢,因此研究脱色菌Mabhk-3对盐的耐受性至关重要。基于上述考虑,考察盐质量浓度对PW-6g脱色率的影响,结果见图6。
图6
由图6可知,脱色24 h时,NaCl质量浓度为0~40 g/L时,PW-6 g的脱色率可达80%以上。当盐质量浓度增加到50 g/L时,PW-6g的24 h脱色率低于70%。这说明盐浓度的增加对脱色过程有负面影响。但随着脱色时间的延长,脱色率进一步提高,在高盐质量浓度(50 g/L)脱色48 h后,脱色率达81%以上。结果表明,Mabhk-3脱色菌能耐受质量浓度为40~50 g/L的盐,显示出巨大的工业应用潜力。
2.4 脱色代谢产物分析
按接种量为4%的量接种4株菌的菌悬液至含200 mL脱色降解培养基(PW-6g质量浓度为600 mg/L,pH为7.5)的500 mL锥形瓶中,35 ℃、150 r/min振荡培养48 h。利用HPLC分析脱色液中的主要代谢产物,结果见表2。
表2 脱色液中代谢产物的HPLC分析
| mg/L | ||||||
| 菌株 | 代谢产物 | |||||
| PW-6g | 对苯二胺 | 苯胺 | 邻苯二甲酸苯 | 甲酸 | 邻苯二酚 | |
| Mabhk-1 | 97±24 | 12±2 | 1±1 | 1±0 | 未检出 | 未检出 |
| Mabhk-2 | 129±34 | 10±3 | 1±1 | 42±10 | 51±5 | 未检出 |
| Mabhk-3 | 未检出 | 未检出 | 未检出 | 未检出 | 未检出 | 未检出 |
| Mabhk-4 | 302±32 | 1±0 | 未检出 | 35±8 | 5±2 | 未检出 |
由表2可知,经4株菌48 h脱色后主要代谢产物均显著下降。特别是Mabhk-3,脱色液中主要污染物PW-6g、对苯二胺、苯胺、邻苯二甲酸、苯甲酸和邻苯二酚经脱色后,均检测不出。说明Mabhk-3对PW-6g具有高效彻底的脱色降解能力。
3 结论
(1)通过梯度驯化和酶活检测,筛选出1株能高效利用毛用活性红染料PW-6g的菌株,并通过16S rDNA鉴定为Bacillus subtilis spp.。
(2)Mabhk-3菌株的最佳脱色降解PW-6g的条件:PW-6g的初始质量浓度为600 mg/L、pH为7.5、温度为35 ℃、接种量为4%、盐质量浓度小于40 g/L。在该条件下,接种菌株Mabhk-3脱色48 h对PW-6g的脱色降解率可接近100%。
(3)通过HPLC分析验证了微生物降解PW-6g的代谢途径。PW-6g是通过偶氮键断裂、脱磺酸基、脱氨、多步氧化及开环最终进入中心碳代谢,用作为细菌生长的碳源。
参考文献
含活性染料印染废水生物降解脱色性能研究
[J].DOI:10.3969/j.issn.1005-9350.2016.02.016 [本文引用: 1]
Biodegradation of synthetic dyes-a review
[J].
Novel physico-biological treatment for the remediation of textile dyes-containing industrial effluents
[J].
Bacterial-yeast consortium as an effective biocatalyst for biodegradation of sulphonated azo dye Reactive Red 198
[J].DOI:10.1039/C4RA15834B [本文引用: 2]
Biodegradation and detoxification of Direct Black G textile dye by a newly isolated thermophilic microflora
[J].DOI:10.1016/j.biortech.2017.11.092 [本文引用: 2]
细菌降解偶氮染料的研究进展
[J].DOI:10.11894/1005-829x.2015.35(12).001 [本文引用: 1]
Degradation of azo dye active brilliant red X-3B by composite ferrate solution
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号