近些年来,好氧反硝化菌因其在脱氮过程中无需回流、酸碱中和等诸多优点,受到了广泛的关注。1988年,Robertson等首次报道了Thiosphaera panto-tropha具有同时硝化反硝化功能,并提出了异养硝化-好氧反硝化(HN-AD)菌的概念〔1〕。至今,国内外学者已筛选分离得到的好氧硝化菌主要有芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、产碱杆菌属(Alcaligenes)、微枝杆菌属(Microvirgula)、假单胞菌属(Pseudomonas)等〔2-7〕。为推进HN-AD技术在实验废水中的应用,特殊环境下的研究成为了当前学者广泛关注的热点。研究发现,一些HN-AD菌株能够耐受贫营养(碳质量浓度为1~15 mg/L)〔8〕、低温和重金属等特殊环境〔9-11〕,甚至有些HN-AD菌株还能够以苯酚作为唯一碳源〔6, 12〕。
苯胺是一种重要的化工原料,被广泛应用于国防、农药和医药等行业,加之生产过程中管理不善所引起的泄漏,以致污水厂尾水、河流等地表水体中常有苯胺的检出〔13〕。可见,苯胺与氮素极易共存,另一方面,苯胺生物降解过程中也会释放出氨氮〔14〕。近年来,极少数文献报道了复合菌、菌株Pseudomonas migulae AN-1可实现同步脱氮降解苯胺〔14-15〕,这为利用好氧反硝化菌同时脱氮降解苯胺提供了可能。本课题组从污水厂尾水中通过富集、驯化、分离得到1株具有较高同步脱氮降解苯胺效能的菌株,对该菌株进行了生理生化鉴定及16S rDNA序列分析,并对其同时脱氮降解苯胺特性进行了探究,为微污染水的脱氮处理及受苯胺污染的江河、湖泊和地下水的修复提供了参考。
1 材料与方法
1.1 培养基
富集培养基(g/L)〔16〕:CH3COONa 1.0、KNO3 0.72、苯胺0.5、MgSO4·7H2O 0.05、Na2HPO4·12H2O 5.14、KH2PO4 0.75,1 000 mL蒸馏水,pH=7.2。其固体培养基即按液体培养基体积分数的2%加入琼脂。
筛选培养基(g/L):CH3COONa 0.1、KNO3 0.072、苯胺0.05、MgSO4·7H2O 0.005、Na2HPO4·12H2O 0.514、KH2PO4 0.075,1 000 mL蒸馏水,pH=7.2。其固体培养基即按液体培养基体积分数的2%加入琼脂。
苯胺液体培养基(g/L):苯胺0.05,Na2HPO4·7H2O 0.514,KH2PO4 0.075,MgSO4·7H2O 0.005,1 000 mL蒸馏水,pH=7.2。
BTB固体选择培养基(g/L):葡萄糖5.0、KNO3 1.0、KH2PO4 1.0、CaCl2·7H2O 0.2、FeCl2·6H2O 0.5、琼脂20、体积分数为1%的BTB乙醇溶液1 mL。
1.2 菌株的驯化与分离
接种生活污水厂二沉池污泥,曝气24 h后,静置弃上清液,取下层浓稠污泥10 mL接种至100 mL富集培养基中,在30 ℃、90 r/min条件下振荡培养3~4 d后进行转接,培养基中的成分质量分数逐次递减1%至与筛选培养基组成相同,驯化过程持续约2个月,使目标菌逐渐适应后成为优势菌群,达到富集驯化目的。
驯化过程结束后,将混合菌液按梯度(10-1~ 10-10)进行稀释后在BTB固体选择培养基上进行涂布,于30 ℃下培养,待长出菌落后,挑选差异性比较明显的单一菌落,在筛选固体培养基上反复划线分离,直至得到单菌落〔16〕。本研究共筛选分离出9株能同步脱氮降解苯胺的好氧反硝化菌,其中菌株H3表现出较好降解性能。
1.3 生理生化鉴定
菌株生理生化特性依据《常见细菌系统鉴定手册》〔17〕进行分析。
1.4 16S r DNA序列分析及系统发育树构建
采用细菌通用引物27f/1492r〔18〕进行扩增,测序工作委托上海生工完成。将16S rDNA测序结果与GenBank中核酸数据进行BLAST对比分析,之后利用MEGA5.0软件进行多序列比对,构建系统发育树。
1.5 生长曲线及降解动力学
1.5.1 乙酸钠和苯胺为共同碳源
将OD600约为0.5的菌液按5%(体积分数,下同)的比例接入至筛选培养基中,置于摇床,在30 ℃、90 r/min条件下振荡培养,定期取样分析OD600、苯胺、NH4+、NO2-、NO3-、TN。设置3个重复。
1.5.2 苯胺为唯一碳源和氮源
将OD600约为0.5的菌液按5%的比例接入至苯胺液体培养基中,置于摇床在30 ℃、90 r/min条件下振荡培养,定期取样分析OD600、苯胺、NH4+、NO2-、NO3-、TN。设置3个重复。
1.6 环境因子对同步脱氮降解苯胺特性的影响
1.6.1 碳源的影响
分别投加0.12 g丁二酸钠、0.10 g乙酸钠、0.10 g葡萄糖至1 L筛选培养基中,将OD600约为0.5的菌液按5%的比例接入至培养基中,置于摇床,在30 ℃、90 r/min条件下振荡培养,4 d后取样分析苯胺、NH4+、NO2-、NO3-、TN和OD600。设置3个重复。
1.6.2 重金属的影响
分别将重铬酸钾、氯化镍、氯化钴三种化合物投加至筛选培养基中,使其重金属初始质量浓度均为80 mg/L,将OD600约为0.5的菌液按5%的比例接入至培养基中,同时设置不加重金属的对照组,置于摇床振荡培养,其余步骤同上。
1.6.3 抗生素的影响
选取氯霉素、诺氟沙星、磺胺嘧啶三种抗生素,分别投加至筛选培养基中,使其初始质量浓度均为35 μg/L,其余步骤同上。
1.6.4 苯胺浓度的影响
设置苯胺初始质量浓度为10、25、50、100、150 mg/L,将OD600约为0.5的菌液按5%的比例接入至苯胺液体培养基中,置于摇床,分别在30 ℃、90 r/min条件下振荡培养,于72 h时取样分析OD600、苯胺、NH4+、NO2-、NO3-、TN。设置3个重复。
1.7 分析方法
苯胺采用N-(1-萘基)乙二胺偶氮分光光度法,硝态氮采用紫外分光光度法,氨氮采用纳氏试剂分光光度法,亚硝酸盐氮采用分子吸收分光光度法,总氮采用碱性过硫酸钾消解紫外分光光度法〔19〕。
2 结果与讨论
2.1 生理生化鉴定
菌株H3的菌落呈圆形,边缘不整齐,透明,有鞭毛,革兰氏染色呈阴性。生理生化鉴定的结果表明,该菌株接触酶反应阳性,具有亚硝酸盐和硝酸盐的还原能力。
2.2 16S rDNA序列分析及系统发育树构建
经16S rDNA测序及同源性序列比对,结果表明,菌株H3与多株不动杆菌的相似性水平在99%以上,将菌株与同源性高的细菌进行系统发育分析,得到系统进化发育树,结果如图1所示。结合H3的生理生化特性,确定菌株H3为不动杆菌属(Acinetobacter sp.)。
图1
2.3 生长曲线及降解动力学
2.3.1 乙酸钠和苯胺为共同碳源
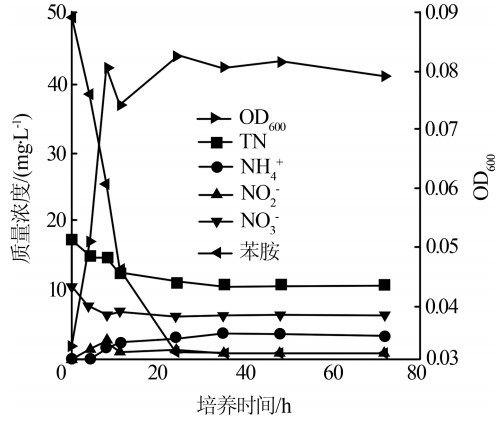
菌株Acinetobacter sp. H3的生长曲线、同步脱氮降解苯胺动力学结果如图2所示。
图2
菌株H3在0~12 h处于对数生长期,随后进入稳定生长期。同时,NO3-的去除率、NH4+、NO2-的生成量均在0~12 h内变化最为明显,随后变化不大;而TN和苯胺的去除率则随着培养时间的延长有所增加,最后分别为38.52%和100%。基于苯胺好氧降解理论分析,50 mg/L苯胺可释放出7.52 mg/L的NH4+,而在整个试验过程中最大NH4+质量浓度为3.76 mg/L,表明菌株H3同时具有硝化、反硝化和苯胺降解性能。周石磊等〔5〕报道了多株不动杆菌属Acinetobacter sp.具有较好的反硝化性能,不过至今尚未见报道此菌属可以降解苯胺。
2.3.2 苯胺为唯一碳源和氮源
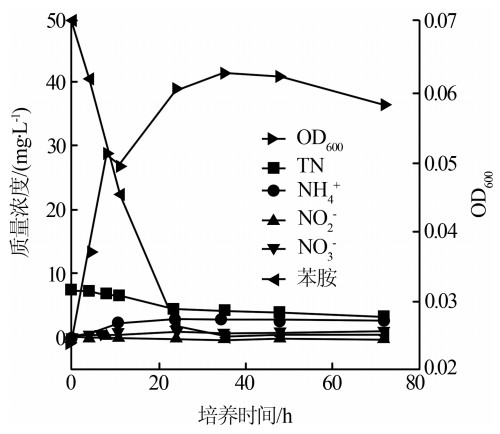
为进一步考察菌株H3的同步脱氮降解苯胺性能,以苯胺作为唯一碳源和氮源进行了试验,结果如图3所示。
图3
由图3可知,菌株H3在0~24 h处于对数生长期,之后进入稳定生长期。同时,NH4+、NO2-和NO3-生成量均在0~24 h内变化最为明显,随后变化不大,较乙酸钠和苯胺为共同碳源时的生长速率略慢,表明乙酸钠有利于促进菌株的生长;另一方面,TN和苯胺的去除率在24 h时基本达到了最大,分别为55.42%和100%,表明了菌株H3能较好地利用苯胺及中间产物作为好氧反硝化的碳源和氮源。
2.4 环境因子对菌株H3同步脱氮降解苯胺的影响
2.4.1 碳源的影响
2.4.2 外源毒素的影响
当菌株H3受到35 μg/L抗生素胁迫时,相比对照组,苯胺仍能被完全转化降解,而TN去除则受到了不同程度的抑制,氯霉素、诺氟沙星和磺胺嘧啶对菌株H3的抑制倍数分别为1.42、1.26、1.39倍。张敏〔25〕研究也发现,氯霉素和磺胺嘧啶对硝化具有明显的抑制作用,且可显著改变氨氧化菌的群落结构,而恩诺沙星的抑制作用则相对不显著。虽然抗生素对好氧反硝化过程产生了一定的抑制作用,但TN去除率仍能维持在50%左右,故菌株H3也可考虑应用于含低浓度抗生素废水的脱氮处理。
当受到80 mg/L重金属胁迫时,菌株H3的同步脱氮降解苯胺效果受到的抑制程度与抗生素相似,Cr6+、Ni2+、Co2+对菌株H3的抑制倍数分别为1.32、1.98、1.02倍,其中Ni2+对菌株H3脱氮的抑制作用最强,对于另外两种则具有较强的耐受力。
2.4.3 苯胺浓度的影响
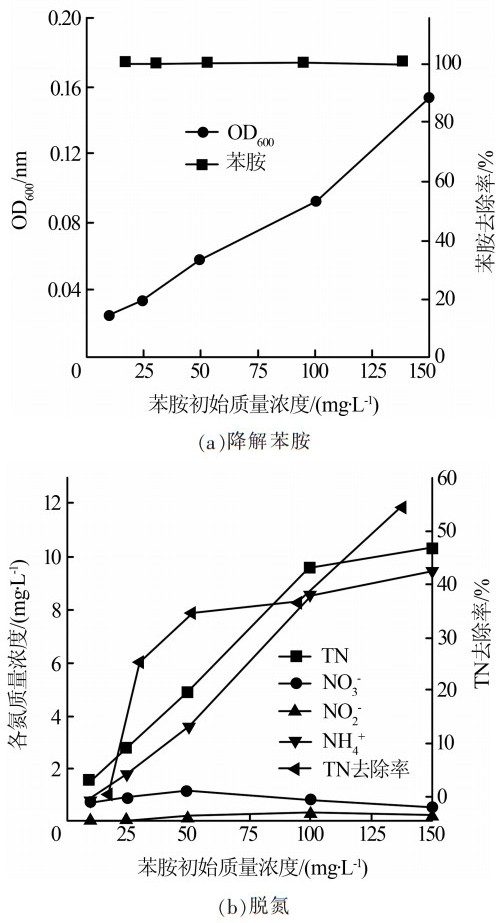
设置不同苯胺初始浓度,考察其对菌株H3同步脱氮降解苯胺性能的影响,结果如图4所示。
图4
3 结论
(1)菌株H3革兰氏染色为阴性,经16S rDNA序列分析,并结合生理生化鉴定,确定菌株H3为Acinetobacter sp.。
(2)微污染条件下,菌株H3具有较好的反硝化性能,能以丁二酸钠、乙酸钠、葡萄糖和苯胺作为反硝化碳源,且对某些抗生素和重金属表现出了较好的耐受能力。
(3)当以10~150 mg/L苯胺为唯一碳源和氮源时,菌株H3较好地实现了同步脱氮降解苯胺。
可见,该菌株具有较广可利用的反硝化碳源,对于部分抗生素和重金属具有较强的耐受能力,可应用于微污染水的脱氮处理及苯胺污染的江河、湖泊、地下水的修复。
参考文献
Simultaneous Nitrification and Denitrification in Aerobic Chemostat Cultures of Thiosphaera pantotropha
[J].
Isolation and immobilization of new aerobic denitrifying bacteria
[J].
The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7
[J].DOI:10.1016/j.biortech.2011.12.139
1株好氧反硝化细菌的分离鉴定及反硝化特性研究
[J].
贫营养好氧反硝化菌的分离鉴定及其脱氮特性
[J].DOI:10.3969/j.issn.1000-6923.2016.01.040 [本文引用: 1]
Potential of Aerobic Denitrification by Pseudomonas stutzeri TR2 To Reduce Nitrous Oxide Emissions from Wastewater Treatment Plants
[J].DOI:10.1128/AEM.01983-09 [本文引用: 1]
Biology of oligotrophic bacteria
[J].DOI:10.1146/annurev.mi.33.100179.002113 [本文引用: 1]
Heterotrophic nitrification and aerobic denitrification at low nutrient conditions by a newly isolated bacterium, Acinetobacter sp. SYF26
[J].DOI:10.1099/mic.0.000047 [本文引用: 1]
Ammonium removal at low temperature by a newly isolated heterotrophic nitrifying and aerobic denitrifying bacterium Pseudomonas fluorescens wsw-1001
[J].
Interaction of Cr(Ⅵ) reduction and denitrification by strain Pseudomonas aeruginosa PCN-2 under aerobic conditions
[J].DOI:10.1016/j.biortech.2015.02.109 [本文引用: 1]
Simultaneous heterotrophic nitrification and aerobic denitrification at high initial phenol concentration by isolated bacterium Diaphorobacter sp. PD-7
[J].DOI:10.1016/j.cjche.2015.02.001 [本文引用: 1]
Mechanisms and pathways of aniline elimination from aquatic environments
[J].
Molecular subtyping scheme for Salmonella panama
[J].
Biological nutrient removal by a sequencing batch reactor (SBR) using an internal organic carbon source in digested piggery wastewater
[J].DOI:10.1016/j.biortech.2004.03.002 [本文引用: 1]
Assessment of potential antibiotic contaminants in water and preliminary occurrence analysis
[J].






 津公网安备 12010602120337号
津公网安备 12010602120337号