氨氮以离子铵(NH4+)和游离氨(NH3)2种形式存在于水体中,主要来源于工业废水(焦化、石油化工等)以及生活污水。富含氨氮的废水若不经处理直接排放,会对人类生活和生态环境造成较大影响〔1〕。据统计,2017年我国废水排放总量为840.78亿t,其中氨氮为280.9万t。对于氨氮废水的处理,传统处理技术主要有生物法〔2〕、折点氯化法〔3〕、化学沉淀法〔4〕、吹脱法〔5〕、离子交换法〔6-7〕、膜吸收法〔8-10〕、电渗析法〔11〕等。上述方法在氨氮处理上具有原理简单、操作方便和理论效果好等优点,但其存在运行成本高、处理时间长、效果不稳定和二次污染等缺点。因此,研究新型氨氮废水处理技术具有重要意义。
1 贵金属催化剂的应用现状
图1
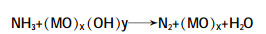
强氧化性的·OH在上述反应过程中起关键性作用。催化剂可降低氨氮氧化所需的活化能,之后其再被·OH彻底氧化为N2。根据以上氨氮催化氧化机理分析,为达到更好的处理效果,将催化氧化与其他方法(离子交换、微波诱导、膜吸收技术、生化法等)合理结合将是氨氮废水处理未来的发展方向之一。
1.1 贵金属催化剂在湿式催化氧化技术中的应用
Jiangyan Qin等〔18〕通过湿式催化氧化技术去除废水中氨氮的研究表明,贵金属复合催化剂Ru/ Al2O3和Pd/Al2O3对氨氮的催化氧化性能要好于复合催化剂Pt/Al2O3,反应主要产物为N2,且以硝态氮形式存在的氮含量较少。J. Barbier等〔19〕通过实验研究发现,稀土氧化物CeO2和贵金属掺杂形成的复合催化剂对废水中的氨氮具有较好的催化氧化去除效果;相比于Pt/CeO2和Pd/CeO2,Ru/CeO2对氨氮的去除表现出更高的催化活性,且对产物N2的选择性达90%以上。王子丹等〔20〕采用自制的PdNi/C复合催化剂催化氧化去除废水中的氨氮,结果表明,在氨氮初始质量浓度为1 000 mg/L,pH=12,反应压强为2 MPa,反应时间为3 h,反应温度为140 ℃的条件下,氨氮去除率达到99%,并且N2选择性高达90%。
虽然国内外研究者在将贵金属催化剂用于湿式催化氧化处理氨氮废水方面取得了较好的效果,所得产物清洁无污染,且对产物N2具有较高的选择性,但仍存在一定的缺点,如反应条件严苛,需要高温、高压且反应时间长;在催化剂制备上存在贵金属负载量较高的问题,这将导致其工业应用成本增高和催化剂生产成本升高等,不利于大规模的应用。
1.2 贵金属催化剂在光催化氧化技术中的应用
S. Eidenassmann等〔25〕利用自制的负载型Pt/TiO2复合光催化剂去除废水中的氨氮,当催化剂加入量为6 g/L,pH为9,反应时间为4.5 h时,能够将初始质量浓度为300 mg/L的氨氮废水催化氧化处理到45.4 mg/L,且主要产物为N2;其中硝态氮和亚硝态氮分别降到6.8 mg/L和2.3 mg/L。多次实验证明,该催化剂有较高的负载牢固性和较长的反应寿命。M. Anpo等〔26〕通过实验研究发现,贵金属Pt和Rh负载在TiO2上后,催化剂的光催化能力有很大程度的提高;并得出TiO2产生的光电子能够迅速转移到负载的贵金属粒子上,在一定程度上削弱了光生电子-空穴的复合,进而提高了光催化性能。王军〔27〕制备了AgO-Ce4+-La3+/TiO2粉体光催化剂,其在pH=11,反应时间为6 h的条件下,可以使废水中的氨氮去除率达到93.9%,催化剂对产物N2的选择性达到89%以上,有较少量的副产物硝态氮产生。
光催化氧化技术作为一种无污染的清洁技术,从理论上用于去除水中氨氮是可行的。国外研究者制备的贵金属复合光催化剂对氨氮有较高的处理效果且对产物N2具有较好的选择性,但存在制备的催化剂贵金属负载量高、催化剂用量较大、反应周期长和对光源要求高等缺点。国内研究者目前制备出较为廉价的Ag复合催化剂,但存在制备工艺复杂、反应条件较高、反应时间长、处理浓度较低等问题。因此,如何制备出廉价、高效且选择性强的贵金属复合光催化剂,是今后研究的重要方向之一。
1.3 贵金属催化剂在微波诱导催化氧化技术中的应用
Longli Bo等〔31〕将自制的Pt基离子负载于强碱性阴离子交换树脂载体上,制备了Pt/树脂催化剂。在氨氮质量浓度为60 mg/L,微波辐照功率为900 W,微波辐照时间为5 min,催化剂投加量为7 g/L的条件下,氨氮去除率达98.4%,其中主要产物为N2,催化剂对主产物N2的选择性达89.3%。
研究表明,微波诱导催化氧化对低浓度的氨氮有较好的去除作用,对于较高浓度氨氮的去除还需进一步研究。今后微波诱导催化氧化处理氨氮废水的应用研究重点,在于开发适合工业生产的大型微波反应装置和研制成本更为低廉的贵金属催化剂,以及解决微波在加热过程中不能连续作用的问题。
1.4 贵金属催化剂在催化臭氧氧化技术中的应用
催化臭氧氧化技术是将臭氧的强氧化性和催化剂的吸附、催化特性结合起来,增加催化剂活性表面臭氧和氨氮的反应浓度,从而产生强氧化性的·OH,对水中氨氮进行氧化分解。
实际应用中采用催化臭氧氧化技术处理氨氮废水需要消耗大量的臭氧,并存在臭氧污染环境等问题;另外,存在催化剂负载量大、生产成本高、使用寿命不长、处理浓度较低等缺陷。因此,今后需要针对上述问题进行研究改进。
1.5 贵金属催化剂在超声催化氧化技术中的应用
超声催化氧化技术是利用超声辅助功能,在极小的空间里产生非常高的温度和压力,并产生强氧化性的·OH〔34〕,从而氧化废水中的氨氮。
目前,有关贵金属催化剂用于超声催化氧化处理氨氮的研究已取得较好的成果,开发的较为廉价的Ag系贵金属催化剂可使氨氮的去除率达80%以上,且对产物N2选择性达90%以上。但目前该方面的研究仅限于实验室阶段,对于工业应用还需研制特定的大型工业超声设备。
1.6 贵金属催化剂在电催化氧化技术中的应用
电催化氧化处理技术主要是通过电极和催化剂作用产生超氧自由基(·O2)、H2O2、·OH等强氧化性基团催化氧化水体中的污染物。
李保菊〔37〕采用自制的Pt-CeO2/GCE催化剂通过电催化氧化处理氨氮废水,结果表明,当电压为-0.4 V,碱浓度为1 mol/L,氨氮初始质量浓度为20 mg/L时,氨氮去除率可达95.91%,并且去除氨氮过程中没有亚硝酸根的出现。N. N. Rao等〔38〕以Ti/ RuO2-TiO2-IrO2-SnO2网状电极为阳极,以网状钛电极为阴极,在水流量为0.6 L/min,电流密度为20 mA/cm2,电解时间为90 min的条件下处理初始质量浓度为40 mg/L的氨氮废水,氨氮去除率可达99.37%。M. Ziese等〔39〕的实验研究表明,其自制的TiO2-NTs/RuO2-SnO2-SbO2电极具有较高的吸氧电位,对氨氮有很强选择性,能达到较好的氨氮处理效果。
从文献分析可知,贵金属催化剂结合电催化技术处理较低浓度的氨氮废水,氨氮去除率可达95%以上,且对产物N2具有良好的选择性。但该技术存在一定缺陷,如需消耗大量的电能,对pH有较高的要求。另外,在催化剂制备方面则存在所制贵金属催化剂比表面积较小、负载量大、寿命不长等问题,这些问题为今后贵金属催化剂的开发和研究提供了新方向。
2 贵金属催化剂研究方向
针对贵金属催化剂在氨氮处理中存在的处理量小、反应条件高、成本高、贵金属负载量高等问题,可从以下2个方面进行研究:(1)进行技术改进,采用多种工艺技术联合,优化应用工艺条件;(2)开发低负载量、高选择性和长寿命的贵金属复合催化材料。
2.1 低负载量贵金属催化材料的开发
针对上述问题国内外学者进行了相关研究,并取得了一定的成果。王园媛等〔43〕通过浸渍法制备了低贵金属负载量的Pd/γ-Al2O3和Pt/γ-Al2O3催化剂,其对二甲醚催化燃烧具有较好的稳定效果,其中Pt和Pd的负载量(均以质量计)分别为0.025%和0.027%;Jian Liu等〔44〕通过纳米CeO2负载氧化钴制备的Co催化剂具有较高的分散度和较强的稳定性。借鉴上述文献,可以将价格相对较低的贵金属Ru负载于CeO2(具有良好的氧存储能力并且能明显提高贵金属在载体上的分散度)上,并与较高活性的Cu进行掺杂制备贵金属催化剂。由于Ce和Cu的掺杂可有效降低催化剂中贵金属的负载量,同时CeO2可以起到稳定晶型和提高催化剂载体强度的作用,避免催化剂因贵金属负载量减少而使寿命减弱的情况发生。也可通过选用一些比表面积较大的载体(γ-Al2O3、分子筛等)充分固定活性组分。此外,研制新型的催化剂制备方法,如涂覆法,可有效提高催化剂的使用寿命,确保活性组分不会过快地流失。
2.2 催化剂应用工艺条件的实用化研究
目前,在催化氧化处理氨氮废水中,催化剂应用的工艺条件是高温、高压、高pH,对此对设备提出既要耐高压,又要耐酸碱腐蚀等一系列要求,同时也存在操作人员和设备的安全性问题。因此,在研制新型高效催化材料时,需要进行对应工艺条件的研究优化。具体可从以下3方面进行优化:(1)优化具体应用工艺,降低催化剂应用要求以及压力、温度等;(2)缩短现有冗杂的工艺流程、生产周期和提高生产效率;(3)对目前老旧工艺设备进行改造升级,以此满足新产品的应用条件。
3 结论
贵金属催化剂与非贵金属催化剂相比,在催化氧化处理氨氮废水方面具有显著的优越性。相比于传统催化剂的低活性、低选择性和短寿命,贵金属催化剂具有高活性、高选择性和高寿命的优点,但其存在负载量大以及价格昂贵等问题。因此,开发低负载量和低价格贵金属作为活性组分的贵金属催化剂;将现有催化技术与传统处理技术进行合理融合,将是贵金属催化剂催化氧化处理氨氮废水的研究方向之一。贵金属催化剂在氨氮废水处理中的应用将具有十分广阔的发展前景,并对水环境的改善和生态系统的修复具有重要的社会意义。
参考文献
Biological phosphorus and nitrogen removal from wastewater using moving bed biofilm process
[J].
Biological treatment of 2, 4, 6-trinitrotoluene(TNT) red water by immobilized anaerobic-aerobic microbial filters
[J].DOI:10.1016/j.cej.2014.08.041 [本文引用: 1]
Use of electrodialysis and reverse osmosis for the recovery and concentration of ammonia from swine manure
[J].DOI:10.1016/j.biortech.2006.12.039 [本文引用: 1]
16S rRNA gene high-throughput sequencing reveals shift in nitrogen conversion related microorganisms in a CANON system in response to salt stress
[J].DOI:10.1016/j.cej.2017.02.096 [本文引用: 1]
Ammonium and potassium removal for anaerobically digested wastewater using natural clinoptilolite followed by membrane pretreatment
[J].DOI:10.1016/j.jhazmat.2007.05.066 [本文引用: 1]
CEM-UF组合膜-硝化/反硝化系统处理低C/N废水及种群结构分析
[J].
Low-cost adsorbents:Growing approach to wastewater treatment-A review
[J].DOI:10.1080/10643380801977610 [本文引用: 1]
Experimental study on treatment of high ammonia nitrogen wastewater by internal circulation impinging current biofilm reactor
[J].
Study on the permselectivity of ion exchange membrane
[J].
Direct and mediated electrochemical oxidation of ammonia on boron-doped diamond electrode
[J].DOI:10.1016/j.elecom.2010.10.004 [本文引用: 1]
Revealing the mechanism of indirect ammonia electro-oxidation
[J].DOI:10.1016/j.electacta.2011.12.092 [本文引用: 1]
Mo-Cu-Fe-O novel catalytic materials for wet catalytic oxidation of dye wastewater at normal temperature and atmospheric pressure
[J].
Catalytic wet air oxidation of ammonia over alumina supported metals
[J].DOI:10.1016/S0926-3373(97)00082-9 [本文引用: 1]
Catalytic wet air oxidation of ammonia over M/CeO2 catalysts in the treatment of nitrogen-containing pollutants
[J].
Photocatalytic degradation of textile dyeing wastewater through microwave synthesized of Zr-AC, Ni-AC and Zn-AC
[J].DOI:10.1016/S1003-6326(15)64072-9 [本文引用: 1]
Synthesis and characterization of porous and nonporous monodisperse colloidal TiO2 particles
[J].
The design and development of highly reacti-ve titanium oxide photocatalysts operating under visible light irradiation
[J].
Qsar study of the fate of pharmaceuticl chemicals in an aquatic environment
[J].
Microwave enhanced Fenton process for the removal of methylene blue from aqueous solution
[J].
Preparation and characteristics of carbon-supported platinum catalyst and its application in the removal of phenolic pollutants in aqueous solution by microwave-assisted catalytic oxidation
[J].DOI:10.1016/j.jhazmat.2007.12.111 [本文引用: 1]
Effects of different catalysts on the ozonation of pyruvic acid in water
[J].DOI:10.1080/01919510600709949 [本文引用: 1]
Catalytic oxidation of ammonium ion in water with ozone over metal oxide catalysts
[J].DOI:10.1016/j.cattod.2013.09.039 [本文引用: 1]
Physico-chemical treatments for removal of recalcitrant contaminants from landfill leachate
[J].
An excellent support of Pd catalyst for methane combustion:Thermal-stable Si-doped alumina
[J].
Electrochemical oxidation of tannery wastewater
[J].
Properties of manganite/ruthenate superlattices with ultrathin layers
[J].DOI:10.1002/pssr.201307007 [本文引用: 1]
Study on desulfurization of simulated gasoline catalyzed by supported metal oxide molecular sieve
[J].
Low-temperature conversion of ammonia to nitrogen in water with ozone over composite metal oxide catalyst
[J].






 津公网安备 12010602120337号
津公网安备 12010602120337号