研究表明,MFC对于抗生素类污染物具有较好的去除效果〔9〕。然而,目前针对单室空气阴极MFC降解ERY的研究较少。本研究以ERY为目标污染物,利用单室空气阴极MFC对其进行降解,研究了MFC系统对ERY的降解效果、产电能力及降解机制。此外,还对MFC阳极膜上微生物群落结构和多样性进行了检测和分析。
1 材料与方法
1.1 实验装置
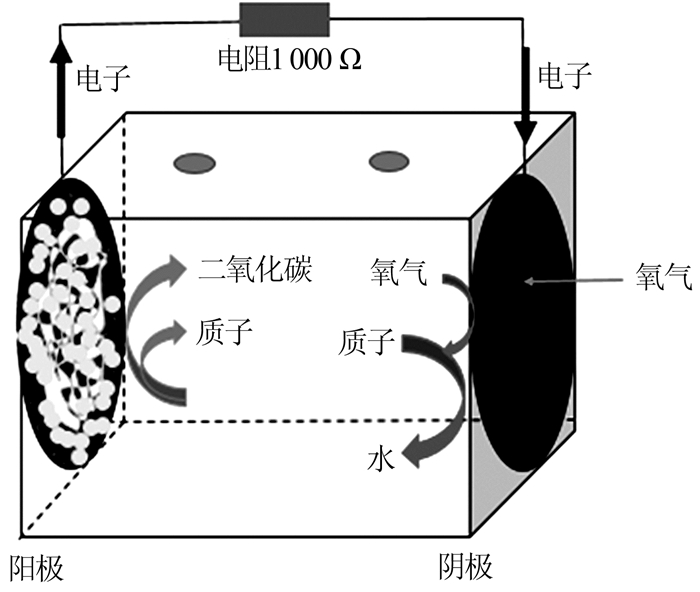
本研究所用反应器为单室空气阴极MFC。其分为阳极和阴极,阳极一侧为厌氧环境,需保证在全封闭状态下;阴极则与空气直接接触。MFC由长4 cm、横断面直径3 cm的有机玻璃柱体组成,有效体积28 mL。MFC的阴极为碳布,将4层PTFE涂在其与空气接触的一侧,并将0.5 mg/cm2 Pt/C催化剂涂在另一侧。MFC的阳极为3K碳布,碳布使用前需经丙酮浸泡12 h,然后依次用蒸馏水和乙醇冲洗,以去除表面杂质,使微生物富集能力加强。将阴阳极碳布(有效面积均为7 cm2)分别置于MFC两侧,并用橡胶圈进行密封固定。将有机玻璃盖盖在阴阳两极上,其中阴极一侧的盖子是中空的,阳极一侧的盖子则为密封的。利用钛丝将阴阳两极连接。MFC外接1 000 Ω的电阻。组装完成的MFC结构如图1所示。
图1
1.2 MFC接种与稳定运行
将反应器与PISO-813数据采集系统连接,然后将反应器置于30 ℃恒温生化培养箱内。每隔30 min采集一次数据,采样精度0.001 V。MFC反应器采用序批式培养,通过定期更换接种液完成启动。接种液来自实验室稳定运行的MFC出水。以乙酸钠为唯一碳源,50 mmol/L的磷酸盐缓冲液(氯化铵0.31 g、氯化钾0.13 g、磷酸二氢钾2.88 g、磷酸二氢钠4.09 g)为基底溶液。直到反应器可以产生平稳的输出电压(即最高电压达500 mV以上),可认为MFC启动成功。MFC启动成功后进入正式运行期,当监测到的输出电压<50 mV时,需更换培养液,此过程记为1个周期。
1.3 电化学检测
CV曲线和交流阻抗曲线(EIS)均由电化学工作站(CHI660E,辰华,中国)进行测量。本研究测试采用三电极体系,以MFC的阳极作为工作电极,阴极作为对电极,Ag/AgCl电极作为参比电极,参比电极放在靠近阳极一侧。CV曲线电压范围-0.8~1.3 V,扫描速率50 mV/s。EIS曲线频率范围100 000~1 Hz,振幅0.005 V。功率密度曲线和极化曲线采用改变外接电阻的方法,记录电池两端电压,通过计算得到相应数值。阳极半径为0.015 m;阴影面积为0.000 7 m2。
1.4 红霉素和COD检测
表1 梯度洗脱顺序
| 时间/min | A体积分数/% | B体积分数/% |
| 0.0 | 90 | 10 |
| 1.5 | 84 | 16 |
| 2.0 | 82 | 18 |
| 2.5 | 80 | 20 |
| 3.0 | 78 | 22 |
| 4.0 | 65 | 35 |
| 4.5 | 40 | 60 |
| 5.0 | 40 | 60 |
| 6.5 | 5 | 95 |
| 7.0 | 90 | 10 |
| 10.0 | 90 | 10 |
1.5 MFC生物膜结构和代谢活性检测
利用激光共聚焦显微镜(LSM880 with Airyscan,Zeiss)分析MFC阴极、阳极生物膜结构和代谢活性。将MFC阴极、阳极生物膜剪成适当形状,放入50 mmol/L的PBS溶液中浸泡,以洗去膜表面浮菌。然后用死活染色试剂盒(LIVE DEAD FIXABLE AQUA DEAD CE 1 KIT,Invitrogen)避光染色20 min,再利用PBS缓冲液冲洗掉表面多余染料。激发谱线分别为488、543 nm。每个实验重复3次,每个切片选取4个视野观察。利用生物显微图像分析软件Image-Pro Plus 6.0分析生物膜中活菌比例,为绿色荧光面积/总荧光面积。
1.6 MFC阳极微生物多样性检测分析
采用16S rDNA扩增子测序技术比较MFC阳极微生物群落在添加红霉素前后的变化。将取下的MFC阳极生物膜〔分别记为MFC_0(未添加红霉素)和MFC_E(添加红霉素)〕送至北京诺禾致源公司进行检测。根据所扩增区域特点,基于Ion S5TMXL测序平台,利用单端测序方法,构建小片段文库进行单端测序。通过对Reads剪切过滤,OTUs聚类(97%的一致性),并进行物种注释及丰度分析,揭示样品物种构成;进一步通过α多样性分析、β多样性分析挖掘样品之间的差异。
2 结果与讨论
2.1 循环伏安和交流阻抗检测
将启动成功的MFC分别用ERY以10、15、20、25、30 mg/L的质量浓度梯度进行驯化。每个浓度运行5个周期。在MFC产电达到最高峰时,以MFC阳极为工作电极进行循环伏安扫描。实验结果表明,不同浓度下的CV曲线都有明显的氧化还原峰,表明MFC中的阳极生物膜具有电化学活性。当ERY质量浓度为10 mg/L时,氧化峰电位为-0.25 V,还原峰电流为-50 mA。随着ERY浓度的升高,MFC的峰电流减小,峰电位不变,峰电流与ERY浓度呈负相关。此外,CV曲线围成的积分面积即电极的活性面积随着ERY浓度的升高而减小,说明电极上的电量减小。推测造成该现象的原因是由于ERY的加入,使得MFC阳极上的产电菌活性受到抑制,且ERY浓度(10~30 mg/L范围内)越大,对产电菌抑制性越强。
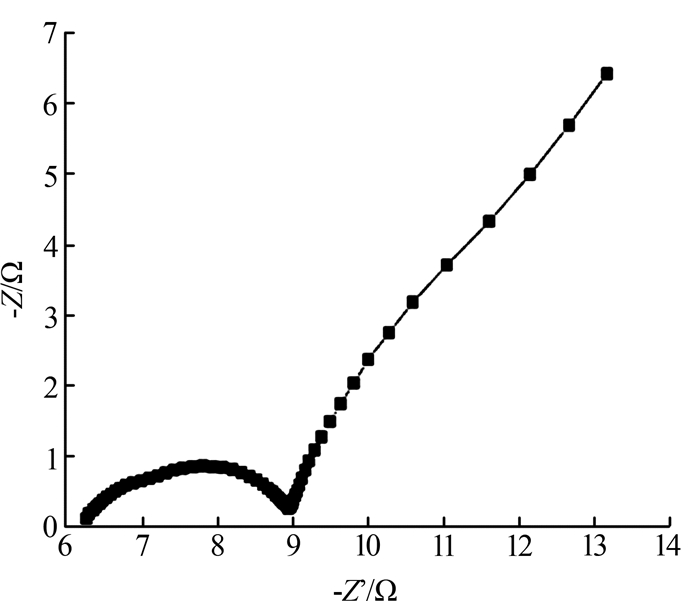
MFC的交流阻抗曲线(ERY初始质量浓度为30 mg/L)如图2所示。
图2
由图2可知,阻抗值为9 Ω,阻抗值较小,表明该MFC系统产生的阻抗损失较小,有利于该系统功率输出。MFC中影响欧姆电阻的主要因素包括阳极底物、阳极产电菌群、电极材料、反应器构型和操作条件等。总的来说,单室MFC内阻低于双室构型MFC内阻,底物为纯物质的内阻低于混合底物内阻,混菌构建的反应器内阻低于纯菌构建的反应器内阻。
2.2 MFC产电性能检测
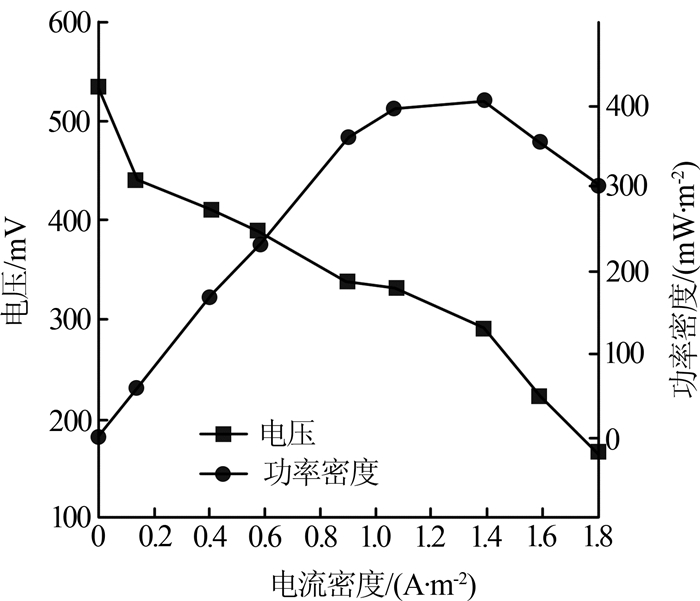
MFC的功率密度曲线和极化曲线(ERY初始质量浓度为30 mg/L)如图3所示。
图3
对于本研究的MFC,获得最大的功率输出是最佳情况,即在最高电位下得到最大电流密度。此外,OCV是在外电阻无限大时得到的,本实验OCV接近550 mV。值得注意的是,输出电压随着外阻的降低而降低。因此,为了在一定范围内得到最大的功率输出,就需要在电流密度增大的过程中寻找最小的电压降。
2.3 对ERY和COD的去除效果
在1个运行周期(48 h)下,考察了MFC对30 mg/L ERY的去除效果。结果表明,ERY降解率为(83.21±1.4)%,COD去除率为(84.91±2.1)%,COD去除率略高于ERY降解率。同Ying Zhou等〔11〕利用MFC降解磺胺二甲嘧啶的去除率为99%相比,本研究抗生素降解率不是很高。根据A. Y. Lin等〔12〕利用臭氧氧化技术降解抗生素的研究推测,含有饱和C—C键的红霉素比含有不饱和芳环的磺胺类抗生素的降解速率要慢。同T. T. Nguyen等〔13〕用膜反应器降解医用废水时67%~78%的红霉素降解率相比,本研究采用的MFC反应器显得优势大一些。MFC能够降解ERY,结合下文的高通量检测分析,推测是由于耐药菌的作用,如已经报道过的假单胞杆菌等〔14〕。
2.4 微生物群落分析
2.4.1 MFC生物膜结构和代谢活性检测分析
根据MFC阴极、阳极生物膜激光共聚焦结果可知,未添加ERY的MFC阳极生物量要比添加了ERY的多,推测是ERY抑制了部分菌群。对激光共聚焦显微镜生成图片采用IPP软件分析表明,生物膜相对代谢活性:未添加ERY的阳极为0.574 9±0.002 5,添加ERY的阳极为0.575 4±0.000 5,未添加ERY的阴极为0.914 1±0.000 5,添加ERY的阴极为0.729 4±0.000 3。未添加ERY的阳极生物膜代谢活性与添加ERY的很接近,但是未添加ERY的阴极生物膜代谢活性明显大于添加ERY的。
2.4.2 微生物种群多样性和丰度
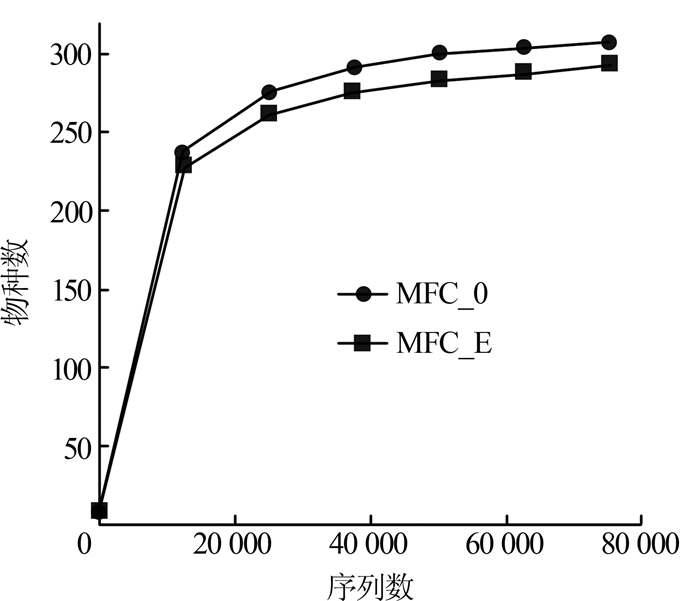
根据物种丰富度指数Chao1分析得到:在Ion S5TMXL测序平台得到MFC_0、MFC_E样本对应的原始数据分别为83 145条、82 129条;进行嵌合体过滤,得到可用于后续分析的有效数据分别为80 284条、80 100条。物种丰度指数估计的最大OTUs数:MFC_0为315,MFC_E为302,MFC_0比MFC_E群落物种丰富度高。MFC_0的群落具有较高的多样性(Shannon=4.949,Chao1=311.9),而MFC_E群落的多样性相对较低(Shannon=4.482,Chao1=299.463)。综合分析Chao1和Shannon多样性指数可知,ERY的加入对MFC阳极微生物群落的丰富度及多样性都有影响,加入ERY的阳极生物膜物种丰富度和多样性均有所降低。稀释曲线如图4所示。
图4
2.4.3 微生物群落差异性分析
实验结果表明,MFC_E和MFC_0中总的OTUs数有325个,其中276个OTUs为两者共同含有。两者共有的OTUs中,微生物大多属于变形菌门(Proteobacteria)。总的来说,2个样品的微生物群落有差异,但相同物种的数量较为稳定;两者共有的OTUs中,产电菌丰富,这类菌的存在使得MFC得以高效运行。
在门水平上,MFC_E和MFC_0中的微生物群落存在差异,但优势物种都为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)。MFC_E与MFC_0相比,变形菌门(Proteobacteria)的菌种相对丰度增加(MFC_E: 75.8%,MFC_0: 67.4%)。推测是ERY的加入对阳极生物膜的群落结构造成较大影响,具有抗药性的菌种富集在MFC的阳极膜上,而没有抗药性的菌种得到抑制,使得优势物种丰度减小。优势菌种类变化,可能是具有抗性基因的菌种存活,没有相关抗性基因的菌种则受到抑制。
MFC_E和MFC_0中,变形菌门(Proteobacteria)、螺旋体门(Spirochaetes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)4门表现出明显差异,厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、互养菌门(Synergistetes)、黏胶球形菌门(Lentisphaerae)4门所占比例较为接近。其中厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)是现有研究中产电菌、抗生素抗性菌中出现较多的菌种,这3类细菌门的总和占总序列数的比:MFC_0为71.72%,MFC_E为83.53%,此结果和上述2组样品共有的OTUs结果相同。
2.4.4 ERY对功能菌群落结构影响
属水平上的OTUs序列数如表2所示。
表2 属水平上不同阳极微生物群落中产电菌、抗生素抗性菌相对丰度
| 产电菌 | MFC_0 | MFC_E |
| 假单胞囷(Pseudomonas) | 0.002 5 | 0.013 6 |
| 地杆菌(Geobacter) | 0.32 | 0.40 |
| 根微杆菌(Rhizomicrobium) | 0.012 | 0.02 |
| 埃希氏囷属(Escherichia) | 0.01 | 0.008 |
| 脱硫弧囷属(Desufovibrio) | 0.13 | 0.10 |
| 梭囷属(Clostridium) | 0.04 | 0.03 |
| 牙抱杆囷(Bacillus) | 0.08 | 0.083 |
| 肠球囷属(Enterococcus) | 0.02 | 0.03 |
| 总计 | 0.604 5 | 0.694 6 |
| 抗生素抗性菌 | MFC_0 | MFC_E |
| 假单胞囷(Pseudomonas) | 0.002 5 | 0.013 6 |
| 固氣螺囷(Aminiphilus) | 0.16 | 0.21 |
| 分支杆菌(Mycobacterium) | 0.005 4 | 0.039 |
| 节杆囷属(Arthrobacter) | 0.01 | 0.06 |
| 总计 | 0.177 9 | 0.322 6 |
由表2可知,目前已报道的产电菌占每个总序列的相对丰度:MFC_0为60.45%,MFC_E为69.46%,即加ERY后的产电菌增加了1.15倍。目前已报道的抗生素抗性菌占每个总序列的相对丰度:MFC_0为17.79%,MFC_E为32.26%,加有ERY后驯化得到的阳极膜上的微生物群落抗性菌增加了1.81倍。其中地杆菌(Geobacter)为2个样品产电菌中的优势菌。
综上所述,报道中经常见到的产电菌、抗生素抗性菌在2个样品中都有检出,如产电菌:地杆菌(Geo-bacter)、假单胞菌(Pseudomonas)、梭菌属(Clostri-dium)〔15〕;抗生素抗性菌:假单胞菌(Pseudomonas)、分支杆菌(Mycobacterium)。可见,样品中的产电菌种类相对丰富,抗生素抗性菌在ERY的驯化过程中得到了富集。在长期的驯化后,ERY不仅减弱了对微生物的抑制作用,抗性菌的相对丰度反而稍有所增加。所以,通过MFC处理抗生素时,一旦MFC驯化启动成功,基本上不需考虑ERY加入后对电池性能产生的影响。
3 结论
(1)随着ERY浓度的升高,MFC的峰电流减小,峰电位不变,峰电流与ERY浓度呈负相关。CV曲线的面积随着ERY浓度的升高而减小。由于ERY的加入,MFC阳极上的产电菌活性受到抑制,ERY浓度越大,对产电菌活性抑制性越强。
(2)采用MFC降解质量浓度为30 mg/L的ERY,最大功率密度为400 mW/m2,开路电压为0.54 V,ERY降解率为(83.21±1.4)%,COD去除率为(84.91± 2.1)%。
(3)ERY的加入使MFC中微生物的群落结构发生改变,但ERY加入前后的主要物种仍相同且数量较大,共有的OTUs中,71.72%的菌种为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria),这3类为主要的产电菌门,为微生物燃料电池的性能发挥了重要作用。
参考文献
Nutrient recovery and energy production from digestate using microbial electrochemical technologies(METs)
[J].DOI:10.1016/j.jclepro.2018.10.152 [本文引用: 1]
Microbial electrochemical technologies for wastewater treatment:Principles and evolution from microbial fuel cells to bioelectrochemical-based constructed wetlands
[J].DOI:10.3390/w10091128 [本文引用: 1]
Application of microbial fuel cell technology for vinasse treatment and bioelectricity generation
[J].
Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane
[J].
Review of antibiotic resistance in China and its environment
[J].DOI:10.1016/j.envint.2017.10.016 [本文引用: 1]
Determination of antibiotics in sewage from hospitals, nursery and slaughter house, wastewater treatment plant and source water in Chongqing region of Three Gorge Reservoir in China
[J].DOI:10.1016/j.envpol.2009.12.034 [本文引用: 1]
The changes of bacterial communities and antibiotic resistance genes in microbial fuel cells during long-term oxytetracycline processing
[J].DOI:10.1016/j.watres.2018.05.047 [本文引用: 1]
Understanding the impact of flow rate and recycle on the conversion of a complex biorefinery stream using a flow-through microbial electrolysis cell
[J].DOI:10.1016/j.bej.2016.06.008 [本文引用: 1]
Simultaneous electricity production and antibiotics removal by microbial fuel cells
[J].
O3 and O3/H2O2 treatment of sulfonamide and macrolide antibiotics in wastewater
[J].
Removal of antibiotics in sponge membrane bioreactors treating hospital wastewater:Comparison between hollow fiber and flat sheet membrane systems
[J].DOI:10.1016/j.biortech.2017.02.118 [本文引用: 1]
Acute sensitivity of activated sludge bacteria to erythromycin
[J].DOI:10.1016/j.jhazmat.2009.07.051 [本文引用: 1]
Electrochemical performance and microbial community analysis in air cathode microbial fuel cells fuelled with pyroligneous liquor
[J].DOI:10.1016/j.bioelechem.2018.11.006 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号