芹菜籽源药渣生物炭制备及对苯酚的吸附性能
徐恺 , 1 , 2 , 唐克 , 1 , 2 , 常春 1 , 蒙丽颖 1
Preparation of biochar from celery seed residue and its adsorption performance for phenol
Xu Kai , 1 , 2 , Tang Ke , 1 , 2 , Chang Chun 1 , Meng Liying 1
通讯作者: 唐克, 博士。E-mail:tangke1984@126.com
收稿日期: 2020-04-21
基金资助:
国家自然科学基金青年项目 . 21606023 辽宁省自然科学基金项目 . 20180550030 锦州市科技计划项目 . 16A2G26
Abstract
Biochar was prepared by H3 PO4 two-step activation and pyrolysis using celery seed residue extracted by steam distillation as precursor. Its adsorption performance for phenol in water was studied. The results of SEM and FTIR showed that a large number of oxygen-containing functional groups were found on its surface. The results of the adsorption test showed that 71.4% of phenol(50 mg/L) was removed after using 3 g/L of biochar. The phenol adsorption process on biochar conformed to the Freundlich isotherm equation and pseudo-second-order kinetic model. The maximum adsorption capacity was 50.56 mg/g.
Keywords:
celery seed residue biochar adsorption phenol
本文引用格式
徐恺, 唐克, 常春, 蒙丽颖. 芹菜籽源药渣生物炭制备及对苯酚的吸附性能 . 工业水处理 [J], 2020, 40(6): 36-39 doi:10.11894/iwt.2019-0670
Xu Kai. Preparation of biochar from celery seed residue and its adsorption performance for phenol . Industrial Water Treatment
苯酚是工业废水中最主要的有机污染物之一〔1 〕 ,其主要来源于炼油、煤炭加工、制药、石化和造纸〔2 〕 等行业排放的废水。由于苯酚对人类健康不利,存在致癌风险〔3 〕 ,因此,从工业废水中除去苯酚非常重要。在含酚废水的治理方法中,吸附法因具有效率高、成本低、易于设计等优点而得到广泛应用〔4 〕 。
研究表明〔5 〕 ,生物炭是去除废水中苯酚的最佳吸附剂。农业残留物中主要含有纤维素、半纤维素和木质素等,它们是制备生物炭很好的原料,其中,甘蔗渣、玉米渣、木薯渣等多种农业残留物已被用于制备生物炭〔6 -7 〕 。芹菜籽是芹菜的果实,其所含有效成分是芹菜的50倍,是一种常见的农产品。芹菜籽残渣是提取芹菜籽精油后的废渣,常作为固体废弃物被掩埋处理,造成环境污染。芹菜籽残渣的主要成分为纤维素、木质素、淀粉和半纤维素,经检测其中的总碳超过50%,可作为制备生物炭的良好原料。因此,本研究以芹菜籽残渣为前驱体,采用H3 PO4 两步活化和热解法制备生物炭,并研究了其对水中苯酚的吸附性能,以期开发出一种有效且廉价的废水净化吸附剂。
1 材料和方法
1.1 仪器和药品
仪器:DHG-9245A鼓风干燥箱、SXL-1208马弗炉,上海精宏实验设备有限公司;TG16-WS高速台式离心机,湖南湘仪实验室仪器开发有限公司;HZQ-X100恒温振荡培养箱,常州华怡实验仪器有限公司;UV-1800C紫外可见分光光度计,北京莱伯泰科有限公司。
苯酚(纯度99%),购自天津市北辰方正试剂厂;经过水蒸气蒸馏法提取并烘干的芹菜籽残渣,芹菜籽产地为新疆,购自安博堂中药饮片有限公司。
1.2 材料的制备
将经过水蒸气蒸馏法提取过的芹菜籽残渣用去离子水进行清洗,然后烘干,粉碎至0.18 mm。称取粉碎后的芹菜籽残渣,以1:4的质量比加入质量分数为15%的H3 PO4 溶液,混合后静置6 h,进行化学活化。活化结束后,置于马弗炉中在550 ℃下焙烧2 h。冷却,用蒸馏水清洗至pH为中性,然后于105 ℃下烘干至恒重。研磨过0.18 mm筛孔,即制成生物炭颗粒。置于干燥器内备用。
1.3 苯酚吸附试验
为了探究制备的生物炭对苯酚的吸附性能,进行批量吸附试验。基本试验条件:温度为25 ℃,苯酚溶液体积为100 mL,初始苯酚质量浓度为50 mg/L,pH为2,生物炭投加量为3 g/L,吸附时间为2 h。利用紫外分光光度计(分析波长为510 nm)测量溶液中的苯酚浓度。
2 结果与讨论
2.1 生物炭的表征结果及分析
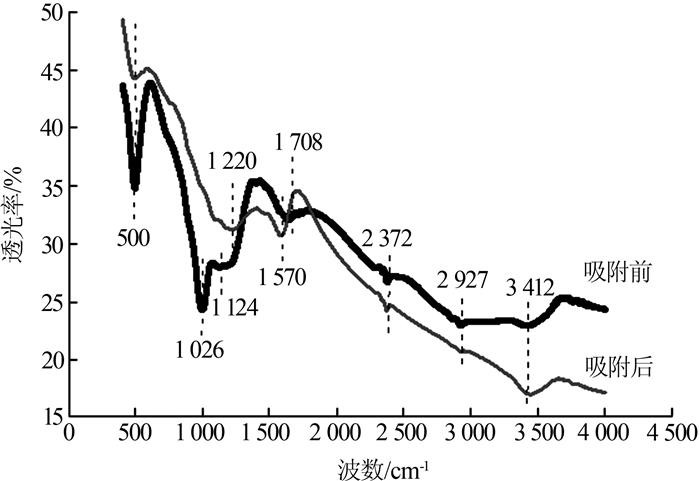
对吸附前后的生物炭进行了SEM、FTIR表征,结果分别如图 1 、图 2 所示。
图1
图2
由图 1 可知,吸附前生物炭表面存在较多块状结构,各结构之间间距较大,且有凹凸不平的褶皱,表面粗糙,这为生物炭吸附苯酚提供了活性位点,使生物炭具有较好的吸附性能。吸附苯酚后,生物炭表面结构与吸附前相比有明显的变化,大量的颗粒状物质聚集在生物炭表面,使得生物炭表面由吸附前的粗糙、不平整变得较为平整有序,且生物炭表面的块状结构变小,生物炭的芳香片层结构之间的连接也变得更加紧密,这表明有大量的苯酚吸附到生物炭表面上。
由图 2 可知,在3 412 cm-1 处存在羟基(—OH)的吸收峰〔8 〕 ,在2 927 cm-1 处存在脂类(C—H)官能团的不对称伸缩振动峰,在约1 708 cm -1 处存在羰基(—C═O)的伸缩振动峰,在1 000~1 300 cm-1 处的吸收峰是重叠的,该区间存在部分醚基(—C—O)的伸缩振动,含磷官能团如多磷酸盐(P—O—P)、磷酸酯(P═O)的拉伸振动。吸附苯酚后,位于1 026 cm-1 处的峰消失,1 124 cm-1 处的峰发生了红移,1 708 cm-1 处的峰发生了蓝移,说明生物炭表面的官能团对吸附苯酚起到了作用。
2.2 各因素对生物炭吸附苯酚效果的影响
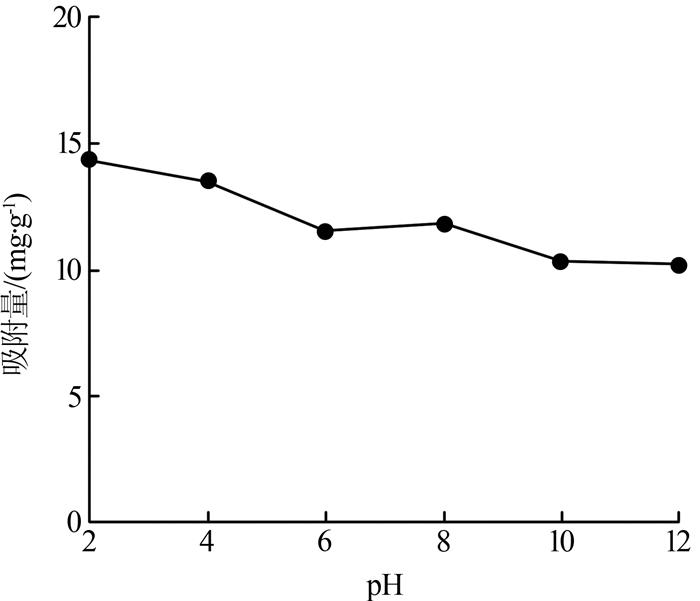
2.2.1 溶液pH的影响
图3
由图 3 可以看出,当pH为2时,吸附量最大。苯酚的pK a 为9.95,当溶液pH<9.95时,苯酚以分子形式存在于溶液中,其与水的亲和力较弱,更容易吸附在生物炭表面;当pH>9.95时,苯酚以离子形式存在于溶液中,其与水的亲和力强,易与水形成化学键,不利于生物炭对苯酚的吸附。溶液pH从2增加到12苯酚吸附量降低,可归因于炭表面和溶液中的酚盐阴离子之间存在静电排斥作用〔9 〕 。
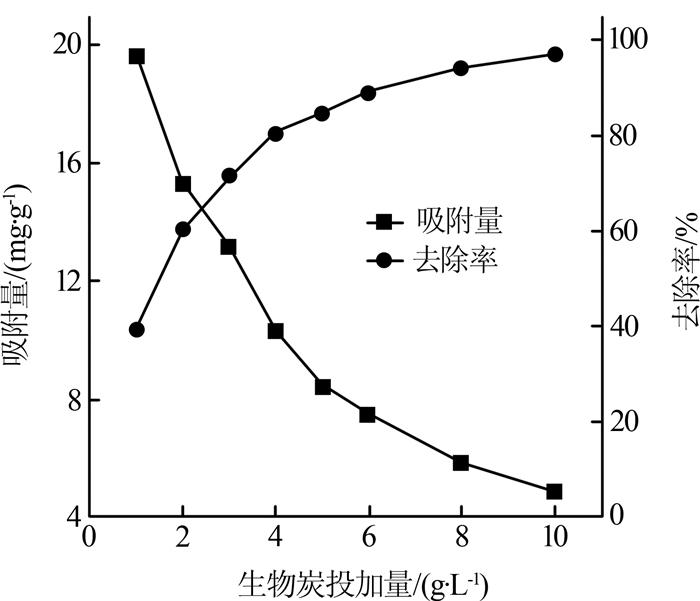
2.2.2 生物炭投加量的影响
图4
由图 4 可知,当生物炭投加量由1 g/L增大至10 g/L时,吸附量从19.588 mg/g下降至4.85 mg/g,而去除率从39.22%提高至96%。随着生物炭投加量的逐渐增大,吸附位点也随之增加,进而去除率增大。但是,由于吸附剂颗粒之间存在相互作用,如团聚,形成絮凝体,导致颗粒内扩散阻力增大,因此投加量增加,会导致吸附量下降〔10 〕 。当吸附剂投加量为3 g/L时,苯酚去除率已经达到71.4%,当吸附剂投加量增加到6 g/L时,去除率仅增加18.6%。考虑到吸附剂的成本问题,在后续试验中采用吸附剂投加量为3 g/L。
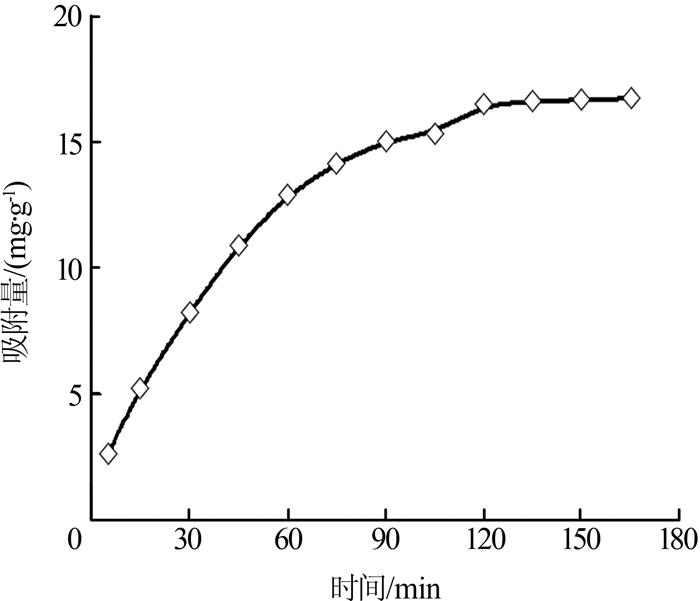
2.2.3 吸附时间的影响
图5
由图 5 可知,在开始的60 min内,生物炭对苯酚的吸附十分迅速,在之后的60 min内,对苯酚的吸附变的缓慢,到120 min时,吸附基本达到平衡,吸附量达到16.49 mg/g。综上,选择吸附时间为2 h。
2.2.4 离子强度的影响
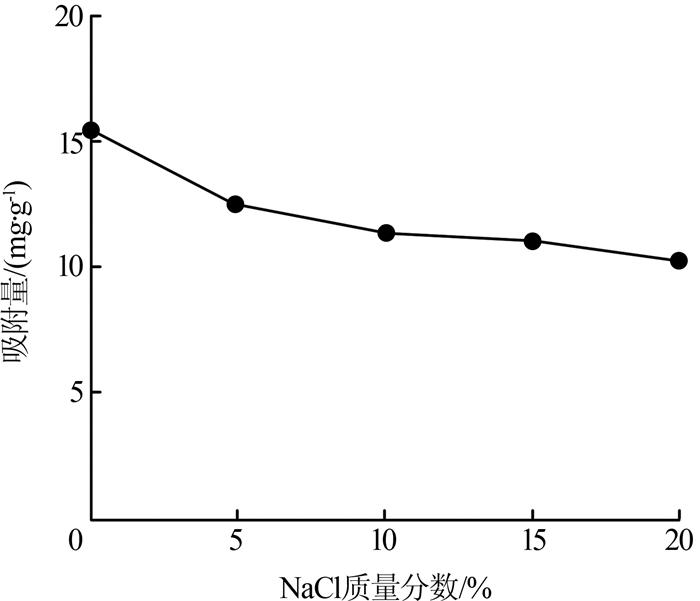
将溶液中的NaCl质量分数控制在0~20%之间研究离子强度对苯酚吸附效果的影响,结果如图 6 所示。
图6
由图 6 可知,当NaCl质量分数从0增大至20%时,吸附量从15.341 mg/g下降至10.223 mg/g。这可能是由于溶液中的Na+ 、Cl- 会包围带相反电荷的吸附位点,使其失去电荷,削弱了吸附质与生物炭之间的静电作用力,从而降低了生物炭对苯酚的吸附能力。另外,生物炭粒子间不会团聚主要原因是存在扩散双电层排斥作用,离子浓度增高会影响排斥作用,使吸附剂粒子团聚,造成吸附剂收缩,吸附位点数减少,也会使吸附量下降。
2.3 吸附动力学
其他条件不变,在初始苯酚质量浓度分别为30、50、70 mg/L的条件下,进行生物炭吸附苯酚的动力学试验,并采用伪一级动力学模型、伪二级动力学模型和颗粒内扩散模型对试验数据进行拟合,结果如表 1 、表 2 所示。
结果表明,伪二级动力学模型可以更好地描述生物炭对苯酚的吸附过程,其吸附速率主要受化学吸附控制。大量研究表明,苯酚可以和含氧基团形成给-受体配合物〔11 〕 ,电子给体-受体机制更适用于生物炭上苯酚的吸附过程。随着初始苯酚质量浓度从30 mg/L增加到70 mg/L,苯酚平衡吸附量(Q e )在20.093 mg/g至35.387 mg/g之间变化,表明制备的生物炭具有较高的吸附容量。颗粒内扩散拟合曲线表明,生物炭对苯酚的吸附分为2个阶段,第1阶段在10 min内即可完成,为瞬时吸附;第2阶段为颗粒内部扩散过程;另外,3条线性曲线均没有通过原点,表明颗粒内部扩散作用不是吸附中唯一的限制机制。
2.4 吸附等温线研究
其他条件不变,在温度为25、35、45 ℃条件下进行等温吸附研究,并采用Langmuir、Freundlich等温模型对试验数据进行拟合,结果如表 3 所示。
试验结果表明,生物炭对苯酚的吸附更符合Freundlich模型,吸附近似多层吸附。
3 结论
以水蒸气蒸馏法提取后的芹菜籽残渣为原料,采用H3 PO4 两步活化和热解法制备了生物炭。表征结果表明,生物炭表面丰富的含氧官能团参与了对苯酚的吸附过程。吸附性能试验结果表明,对100 mL质量浓度为50 mg/L的苯酚溶液,最佳吸附条件:吸附时间2 h,溶液pH为2,生物炭投加量为3 g/L。在此条件下,苯酚去除率为71.4%。生物炭对苯酚的吸附过程遵循伪二级动力学模型,表明该过程受化学吸附控制。与Langmuir等温模型相比,苯酚在生物炭上的吸附更符合Freundlich等温模型。制备的芹菜籽源药渣生物炭是一种能有效去除水溶液中苯酚且成本低廉的吸附剂。
参考文献
View Option
[1]
Ahmaruzzaman M . Adsorption of phenolic compounds on low-cost adsorbents:A review
[J]. Advances in Colloid and Interface Science , 2008 , 143 (1/2 ): 48 - 67 .
URL
[本文引用: 1]
[2]
Busca G , Berardinelli S , Resini C , et al . Technologies for the removal of phenol from fluid streams:A short review of recent developments
[J]. Journal of Hazardous Materials , 2008 , 160 (2/3 ): 265 - 288 .
URL
[本文引用: 1]
[3]
Gómez J L , Bódalo A , Gómez E , et al . Immobilization of peroxidases on glass beads:An improved alternative for phenol removal
[J]. Enzyme and Microbial Technology , 2006 , 39 (5 ): 1016 - 1022 .
URL
[本文引用: 1]
[4]
Yang Kun , Wu Wenhao , Jing Qingfang , et al . Aqueous adsorption of aniline, phenol, and their substitutes by multi-walled carbon nanotubes
[J]. Environmental Science & Technology , 2008 , 42 (21 ): 7931 - 7936 .
URL
[本文引用: 1]
[5]
Phatai P , Utara S , Hatthapanit N . Removal of methyl violet by adsorption onto activated carbon derived from coffee residues
[J]. Advanced Materials Research , 2013 , 864 (867 ): 710 - 714 .
URL
[本文引用: 1]
[6]
Dos Santos V C G , De Souza J V T M , Tarley C R T , et al . Copper ions adsorption from aqueous medium using the biosorbent sugarcane bagasse in natura and chemically modified
[J]. Water Air & Soil Pollution , 2011 , 216 (1/2/3/4 ): 351 - 359 .
URL
[本文引用: 1]
[7]
Wang Xuyu , Wang Sai , Yin Xueqiong , et al . Activated carbon preparation from cassava residue using a two-step KOH activation:Preparation, micropore structure and adsorption capacity
[J]. Journal of Biobased Materials and Bioenergy , 2014 , 8 (1 ): 35 - 42 .
URL
[本文引用: 1]
[8]
Muhammad S U R , Kim I , Rashid N , et al . Adsorption of brilliant green dye on biochar prepared from lignocellulosic bioethanol plant waste
[J]. Clean-Soil Air Water , 2016 , 44 (1 ): 55 - 62 .
URL
[本文引用: 1]
[9]
Lazo-Cannata J C , Nieto-Márquez A , Jacoby A , et al . Adsorption of phenol and nitrophenols by carbon nanospheres:Effect of pH and ionic strength
[J]. Separation & Purification Technology , 2011 , 80 (2 ): 217 - 224 .
URL
[本文引用: 1]
[10]
Mattson J A , Jr H B M , Malbin M D , et al . Surface chemistry of active carbon:Specific adsorption of phenols
[J]. Journal of Colloid & Interface Science , 1969 , 31 (1 ): 116 - 130 .
URL
[本文引用: 1]
[11]
Özcan A S , Özer G , Özcan A . Adsorption of lead(Ⅱ) ions onto 8-hydroxy quinoline-immobilized bentonite
[J]. Journal of Hazardous Materials , 2009 , 161 (1 ): 499 - 509 .
URL
[本文引用: 1]
Adsorption of phenolic compounds on low-cost adsorbents:A review
1
2008
... 苯酚是工业废水中最主要的有机污染物之一〔1 〕 ,其主要来源于炼油、煤炭加工、制药、石化和造纸〔2 〕 等行业排放的废水.由于苯酚对人类健康不利,存在致癌风险〔3 〕 ,因此,从工业废水中除去苯酚非常重要.在含酚废水的治理方法中,吸附法因具有效率高、成本低、易于设计等优点而得到广泛应用〔4 〕 . ...
Technologies for the removal of phenol from fluid streams:A short review of recent developments
1
2008
... 苯酚是工业废水中最主要的有机污染物之一〔1 〕 ,其主要来源于炼油、煤炭加工、制药、石化和造纸〔2 〕 等行业排放的废水.由于苯酚对人类健康不利,存在致癌风险〔3 〕 ,因此,从工业废水中除去苯酚非常重要.在含酚废水的治理方法中,吸附法因具有效率高、成本低、易于设计等优点而得到广泛应用〔4 〕 . ...
Immobilization of peroxidases on glass beads:An improved alternative for phenol removal
1
2006
... 苯酚是工业废水中最主要的有机污染物之一〔1 〕 ,其主要来源于炼油、煤炭加工、制药、石化和造纸〔2 〕 等行业排放的废水.由于苯酚对人类健康不利,存在致癌风险〔3 〕 ,因此,从工业废水中除去苯酚非常重要.在含酚废水的治理方法中,吸附法因具有效率高、成本低、易于设计等优点而得到广泛应用〔4 〕 . ...
Aqueous adsorption of aniline, phenol, and their substitutes by multi-walled carbon nanotubes
1
2008
... 苯酚是工业废水中最主要的有机污染物之一〔1 〕 ,其主要来源于炼油、煤炭加工、制药、石化和造纸〔2 〕 等行业排放的废水.由于苯酚对人类健康不利,存在致癌风险〔3 〕 ,因此,从工业废水中除去苯酚非常重要.在含酚废水的治理方法中,吸附法因具有效率高、成本低、易于设计等优点而得到广泛应用〔4 〕 . ...
Removal of methyl violet by adsorption onto activated carbon derived from coffee residues
1
2013
... 研究表明〔5 〕 ,生物炭是去除废水中苯酚的最佳吸附剂.农业残留物中主要含有纤维素、半纤维素和木质素等,它们是制备生物炭很好的原料,其中,甘蔗渣、玉米渣、木薯渣等多种农业残留物已被用于制备生物炭〔6 -7 〕 .芹菜籽是芹菜的果实,其所含有效成分是芹菜的50倍,是一种常见的农产品.芹菜籽残渣是提取芹菜籽精油后的废渣,常作为固体废弃物被掩埋处理,造成环境污染.芹菜籽残渣的主要成分为纤维素、木质素、淀粉和半纤维素,经检测其中的总碳超过50%,可作为制备生物炭的良好原料.因此,本研究以芹菜籽残渣为前驱体,采用H3 PO4 两步活化和热解法制备生物炭,并研究了其对水中苯酚的吸附性能,以期开发出一种有效且廉价的废水净化吸附剂. ...
Copper ions adsorption from aqueous medium using the biosorbent sugarcane bagasse in natura and chemically modified
1
2011
... 研究表明〔5 〕 ,生物炭是去除废水中苯酚的最佳吸附剂.农业残留物中主要含有纤维素、半纤维素和木质素等,它们是制备生物炭很好的原料,其中,甘蔗渣、玉米渣、木薯渣等多种农业残留物已被用于制备生物炭〔6 -7 〕 .芹菜籽是芹菜的果实,其所含有效成分是芹菜的50倍,是一种常见的农产品.芹菜籽残渣是提取芹菜籽精油后的废渣,常作为固体废弃物被掩埋处理,造成环境污染.芹菜籽残渣的主要成分为纤维素、木质素、淀粉和半纤维素,经检测其中的总碳超过50%,可作为制备生物炭的良好原料.因此,本研究以芹菜籽残渣为前驱体,采用H3 PO4 两步活化和热解法制备生物炭,并研究了其对水中苯酚的吸附性能,以期开发出一种有效且廉价的废水净化吸附剂. ...
Activated carbon preparation from cassava residue using a two-step KOH activation:Preparation, micropore structure and adsorption capacity
1
2014
... 研究表明〔5 〕 ,生物炭是去除废水中苯酚的最佳吸附剂.农业残留物中主要含有纤维素、半纤维素和木质素等,它们是制备生物炭很好的原料,其中,甘蔗渣、玉米渣、木薯渣等多种农业残留物已被用于制备生物炭〔6 -7 〕 .芹菜籽是芹菜的果实,其所含有效成分是芹菜的50倍,是一种常见的农产品.芹菜籽残渣是提取芹菜籽精油后的废渣,常作为固体废弃物被掩埋处理,造成环境污染.芹菜籽残渣的主要成分为纤维素、木质素、淀粉和半纤维素,经检测其中的总碳超过50%,可作为制备生物炭的良好原料.因此,本研究以芹菜籽残渣为前驱体,采用H3 PO4 两步活化和热解法制备生物炭,并研究了其对水中苯酚的吸附性能,以期开发出一种有效且廉价的废水净化吸附剂. ...
Adsorption of brilliant green dye on biochar prepared from lignocellulosic bioethanol plant waste
1
2016
... 由图 2 可知,在3 412 cm-1 处存在羟基(—OH)的吸收峰〔8 〕 ,在2 927 cm-1 处存在脂类(C—H)官能团的不对称伸缩振动峰,在约1 708 cm -1 处存在羰基(—C═O)的伸缩振动峰,在1 000~1 300 cm-1 处的吸收峰是重叠的,该区间存在部分醚基(—C—O)的伸缩振动,含磷官能团如多磷酸盐(P—O—P)、磷酸酯(P═O)的拉伸振动.吸附苯酚后,位于1 026 cm-1 处的峰消失,1 124 cm-1 处的峰发生了红移,1 708 cm-1 处的峰发生了蓝移,说明生物炭表面的官能团对吸附苯酚起到了作用. ...
Adsorption of phenol and nitrophenols by carbon nanospheres:Effect of pH and ionic strength
1
2011
... 由图 3 可以看出,当pH为2时,吸附量最大.苯酚的pK a 为9.95,当溶液pH<9.95时,苯酚以分子形式存在于溶液中,其与水的亲和力较弱,更容易吸附在生物炭表面;当pH>9.95时,苯酚以离子形式存在于溶液中,其与水的亲和力强,易与水形成化学键,不利于生物炭对苯酚的吸附.溶液pH从2增加到12苯酚吸附量降低,可归因于炭表面和溶液中的酚盐阴离子之间存在静电排斥作用〔9 〕 . ...
Surface chemistry of active carbon:Specific adsorption of phenols
1
1969
... 由图 4 可知,当生物炭投加量由1 g/L增大至10 g/L时,吸附量从19.588 mg/g下降至4.85 mg/g,而去除率从39.22%提高至96%.随着生物炭投加量的逐渐增大,吸附位点也随之增加,进而去除率增大.但是,由于吸附剂颗粒之间存在相互作用,如团聚,形成絮凝体,导致颗粒内扩散阻力增大,因此投加量增加,会导致吸附量下降〔10 〕 .当吸附剂投加量为3 g/L时,苯酚去除率已经达到71.4%,当吸附剂投加量增加到6 g/L时,去除率仅增加18.6%.考虑到吸附剂的成本问题,在后续试验中采用吸附剂投加量为3 g/L. ...
Adsorption of lead(Ⅱ) ions onto 8-hydroxy quinoline-immobilized bentonite
1
2009
... 结果表明,伪二级动力学模型可以更好地描述生物炭对苯酚的吸附过程,其吸附速率主要受化学吸附控制.大量研究表明,苯酚可以和含氧基团形成给-受体配合物〔11 〕 ,电子给体-受体机制更适用于生物炭上苯酚的吸附过程.随着初始苯酚质量浓度从30 mg/L增加到70 mg/L,苯酚平衡吸附量(Q e )在20.093 mg/g至35.387 mg/g之间变化,表明制备的生物炭具有较高的吸附容量.颗粒内扩散拟合曲线表明,生物炭对苯酚的吸附分为2个阶段,第1阶段在10 min内即可完成,为瞬时吸附;第2阶段为颗粒内部扩散过程;另外,3条线性曲线均没有通过原点,表明颗粒内部扩散作用不是吸附中唯一的限制机制. ...






 津公网安备 12010602120337号
津公网安备 12010602120337号