全程自养脱氮(CANON)工艺是一种高效、可持续性的新型脱氮工艺,该工艺利用氨氧化菌(AOB)将部分NH4+-N转化为NO2--N,再利用厌氧氨氧化菌(Anammox)将剩余的NH4+-N和NO2--N转化为氮气和少量的NO3--N,CANON工艺通过控制溶解氧(DO)的含量,可以在同一反应器内实现亚硝化所需的有氧环境和厌氧氨氧化所需的厌氧环境。CANON工艺具有不消耗有机碳源、曝气量较低等优点,目前主要应用在污泥消化液、畜禽养殖废水、垃圾渗滤液等高氨氮、低C/N比废水的处理中,工艺的启动和稳定控制是CANON工艺在工程应用中的主要难点。
由于亚硝化过程为厌氧氨氧化过程提供了基质,所以亚硝化是CANON工艺运行的基础,本研究采用先实现亚硝化,再逐渐驯化出厌氧氨氧化菌的试验方案构建CANON工艺。亚硝化工艺的关键是抑制亚硝酸盐氧化菌(NOB),将AOB和Anammox富集在系统中,为此针对亚硝化和CANON过程的研究大都采用SBR反应器,而实际工程中连续流反应器应用更为广泛。相关研究表明,利用悬浮填料载体培养微生物的移动床生物膜反应器(MBBR),在AOB和Anammox的持留方面具有显著的优势〔1-2〕,而且可以连续运行,降低了运行的难度。笔者借助MBBR反应器,考察了连续流情况下反应器的启动、长期运行和亚硝化向CANON的转变过程,探讨了亚硝化过程中NO2--N累积的实现机理以及亚硝化向CANON转变的条件。另一方面,目前对于亚硝化和CANON反应器内部的微生物群体还缺乏全面、深入的了解,针对亚硝化过程从启动到稳定运行到实现转变期间的功能菌群和种群变化的研究还较少,本研究借助16S rDNA宏基因组测序方法研究了系统运行不同阶段的微生物群落结构特征,为亚硝化工艺和CANON工艺的研究提供参考。
1 材料与方法
1.1 试验装置
试验采用完全混合反应器,由不锈钢制成,内径为30 cm,高55 cm,有效容积为32 L。反应器设有可调速搅拌器,底部安装砂芯曝气盘,采用空压机曝气,曝气量通过转子流量计控制,反应器依靠加热棒保持水温为(32±1)℃,通过蠕动泵控制进水流量。反应器内装填悬浮填料(SPR-1型),尺寸为D 25 cm× 10 cm,比表面积为450 m2/m3,填充率为40%。
1.2 试验用水
试验用水为自配水,以(NH4)2SO4作为氮源,配水中NH4+-N质量浓度为120~380 mg/L。按m(HCO3-):m(NH4+)为1~1.5的比例投加NaHCO3作为碱度。模拟污水组成(mg/L):KH2PO4 27、MgSO4·7H2O 300、CaCl2 136和微量元素Ⅰ和Ⅱ各1 mL/L。其中微量元素Ⅰ组成(mg/L):EDTA 5 000、FeSO4 5 000。微量元素Ⅱ组成(mg/L):EDTA 15 000、ZnSO4·7H2O 430、CoCl2·6H2O 240、MnCl2·4H2O 990、CuSO4·5H2O 250、Na2MoO4·2H2O 220、NiCl2·6H2O 190、Na2SeO4·10H2O 210。
1.3 试验方案
试验分为5个阶段,阶段Ⅰ~Ⅱ均为低氨氮启动,进水氨氮浓度较低,阶段Ⅲ~Ⅴ进水氨氮浓度较高,运行期间DO根据不同进水氨氮浓度进行调整,期间共启动了两个反应器,反应器A共运行了452 d,主要考察进水氨氮浓度对反应器启动的影响,反应器B运行了149 d,用于分析亚硝化反应器向CANON反应器转化的条件。
表1 研究期间反应器运行参数
| 试验阶段 | 反应器A | 反应器B | |||||
| 运行时期 | 进水氨氮/(mg·L-1) | DO/(mg·L-1) | 运行时期 | 进水氨氮/(mg·L-1) | DO/(mg·L-1) | ||
| 低氨氮启动(Ⅰ) | 第1天-第48天 第49天-第66天 | 120-140 | 0.5-0.8 0.1-0.2 | ||||
| 低氨氮启动(Ⅱ) | 第67天-第77天 第78天-第185天 | 180-220 | 0.8-1.5 0.3-0.6 | ||||
| 高氨氮启动(Ⅲ) | 第186天-第286天 | 320~280 | 0.5~0.8 | 第1天-第21天 | 320~280 | 1.0~1.5 | |
| 亚硝化稳定运行(Ⅳ) | 第287天-第367天 | 320~280 | 1.0~1.5 | 第22天-第149天 | 320~280 | 1.0~1.5 | |
| CANON稳定运行(Ⅴ) | 第368天-第452天 | 320~280 | 1.0~1.5 | ||||
1.4 测试指标和方法
NH4+-N采用纳氏试剂比色法;NO2--N采用N-(1-萘基)-乙二胺分光光度法;NO3--N采用紫外分光光度法;TN采用碱性过硫酸钾消解紫外分光光度法;游离氨(FA)的计算方法采用Anthonisen平衡方程。
1.5 宏基因组测序
采用E.Z.N.A.®DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒进行样品DNA抽提。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测DNA完整性。通过Covaris M220仪器(基因公司,中国)将DNA片段化,筛选约300 bp的片段,利用TruSeqTM DNA Sample Prep Kit试剂盒,构建PE文库,产生单链DNA片段后采用HiSeq 3000/4000 PE Cluster Kit进行桥式PCR,最后通过Illumina HiSeq 4000(Illu- mina,USA)平台,采用HiSeq 3000/4000 SBS Kits进行宏基因组测序。
2 结果与讨论
2.1 反应器的启动与亚硝化的形成
图1
图2
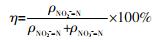
式中:ρ——NO2--N质量浓度,mg/L;
ρ——NO3--N质量浓度,mg/L。
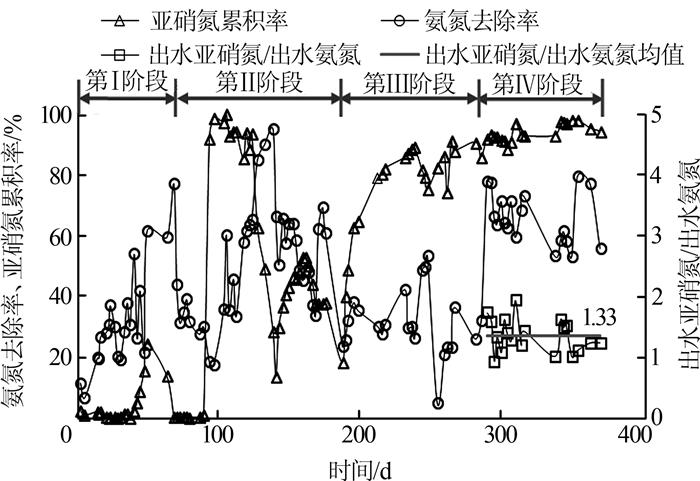
第Ⅰ阶段进水NH4+-N为120~140 mg/L,DO控制在0.5~0.8 mg/L。从图 1可以看出,启动48 d后,NH4+-N平均去除率达到61.5%,NO2--N累积率逐渐升高到24.5%,随后累积率开始下降,将DO降低到0.1~0.2 mg/L,仍无法提高累积率,运行至第66天,NO2--N累积率没有超过1%。NO2--N累积率下降主要是由于系统内NH4+-N浓度下降过快,维持不了FA的浓度。FA对NOB的抑制质量浓度范围为0.1~1 mg/L,当FA的质量浓度达到6 mg/L时就可完全抑制NOB的生长〔3〕。根据出水NH4+-N浓度和pH计算出系统内的FA浓度〔4〕,在启动初期,FA约为8.1 mg/L,在第48天NO2--N累积率开始下降时,出水NH4+-N为52.3 mg/L,FA为3.4 mg/L。
第Ⅱ阶段从运行第67天开始,该阶段将进水NH4+-N提高至180~220 mg/L,运行至第77天时,DO控制在0.8~1.5 mg/L,系统仍没有出现NO2--N累积,该阶段对NH4+-N的去除率为29%~44%,系统内FA质量浓度为6.4~8.8 mg/L仍然较高,所以仅通过FA无法实现抑制NOB。于是第78天时将DO降低至0.3~0.6 mg/L,至第91天—第122天,系统出现了NO2--N累积,同时NO3--N迅速降低,NO2--N累积率达到并维持在90%以上,对NH4+-N的去除率也逐渐上升,最后达65%左右,表明AOB菌已生长成熟,并在系统中起主导作用。第123天—第137天,系统进水配药泵出现故障,导致进水氨氮降低至130~136 mg/L,将DO降低至0.1 mg/L,NOB仍无法抑制,期间出水NH4+-N和FA分别为6.5~20.3 mg/L和0.4~1.3 mg/L,系统NO2--N累积率从93.4%逐渐降低至28.4%。第138天—第174天进水NH4+-N恢复至180~220 mg/L,DO控制在0.3~0.6 mg/L,NO2--N累积率逐渐提高,但只维持在37%~52%,无法继续升高。
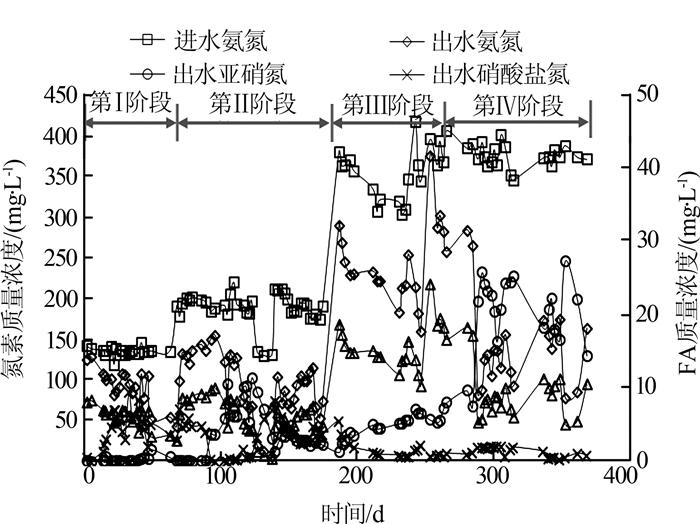
在第Ⅰ、第Ⅱ阶段的启动浓度下,试验没有实现稳定的亚硝化。可以看出,在系统启动初期,AOB菌还没有生长到一定规模时,必须保证一定的NH4+-N浓度,否则NOB将无法被抑制,从本试验结果来看,出水NH4+-N必须维持在50 mg/L以上,但是当进水NH4+-N较低时,实际运行过程很难保持出水NH4+-N浓度在此范围,而且系统一旦崩溃向全硝化过程转变时,也较难恢复。在第Ⅲ阶段,将进水NH4+-N提高至320~380 mg/L,在第186天—第284天将DO控制在0.5~0.8 mg/L,运行至第210天时NO2--N累积率从初始的18.3%增加至78.9%,之后维持在80%以上,系统迅速实现了亚硝化,运行至第284天,系统FA保持在10.3~19.5 mg/L,较高的FA浓度是实现亚硝化的主要原因。
在第Ⅳ阶段将DO提高至1.0~1.5 mg/L,系统对NO2--N的累积率一直稳定在90%以上,对NH4+-N的平均去除率提高至60.7%,出水亚硝氮和氨氮比值平均为1.33(见图 1),满足后续厌氧氨氧化的进水要求。在第Ⅲ阶段实现了稳定的亚硝化后,课题内部另一个作为对照的亚硝化反应器B直接以相同的进水浓度、HRT和水温等参数运行,DO控制在1.0~1.5 mg/L,该反应器经过21 d的运行实现了稳定的亚硝化,并且出水亚硝氮和氨氮比值平均达到了1.42(见后文),验证了此方法可以快速实现亚硝化,可以看出启动初期FA的抑制相对DO抑制更为重要。
2.2 反应器从亚硝化到CANON的转变
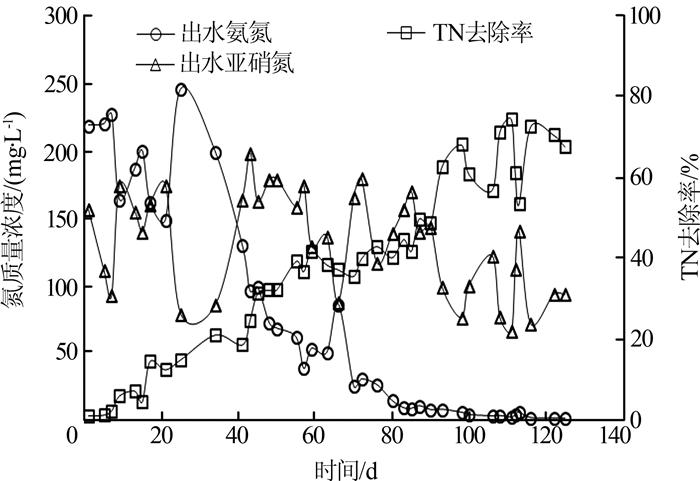
第Ⅴ阶段期间主要运行参数未做调整,该期间系统出水氮浓度的变化见图 3。结果显示系统对TN的去除率逐渐从15.0%增加至72.6%,表明系统逐渐从亚硝化反应器发展成为一体式CANON反应器,反应器对TN的去除负荷达0.16~0.2 kg/(m3·d)。主要原因是,系统内长期有NO2--N和NH4+-N存在,为厌氧氨氧化菌的生长提供了必需的基质。反应器B在启动运行期间氮浓度的变化见图 4,结果显示,反应器B在快速实现了亚硝化后,经149 d的继续运行并没有出现TN的去除。主要原因是,DO直接控制在1.0~1.5 mg/L,实现了较高的氨氮转化率,出水NO2--N平均达194 mg/L,一直处于较高的状态。研究表明,当NH4+-N高于100 mg/L时,厌氧氨氧化菌的活性被完全抑制〔5〕,因此反应器未发展成为CANON反应器。在第Ⅲ阶段(第186天—第286天)反应器A的DO为0.5~0.8 mg/L,低DO运行后反应器NO2--N仅为11.3~87.1 mg/L,为厌氧氨氧化菌的早期生长创造了条件,在第Ⅳ阶段DO增加后,即使NO2--N质量浓度达130~246 mg/L,厌氧氨氧化菌也没有被抑制。
图3
图4
2.3 微生物特征
为进一步研究系统脱氮相关的微生物结构,采用宏基因组测序的方法对种泥和不同时期填料生物膜的生态结构进行了分析,样品1是启动初期的种泥,样品2和样品3分别是系统稳定亚硝化时期和发展为CANON工艺时期取出的填料生物膜,对不同样品在门和属水平下的多样性进行了统计。结果表明,样品1主要以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)为主,相对丰度分别为49.95%、22.33%、12.36%、5.47%,Proteobacteria和Nitrospirae是主要的脱氮细菌。样品2和样品3的微生物主要以变形菌门(Proteobacteria)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、浮霉菌门(Plan- ctomycetes)、拟杆菌门(Bacteroidetes)等为主。样品2中相对丰度分别为36.04%、21.73%、17.89%、3.60%、3.89%,样品3中相对丰度分别为49.31%、17.40%、13.39%、3.92%、2.50%。样品2和样品3中占比最丰富的菌群为Proteobacteria,Proteobacteria是污水处理系统中的主要脱氮菌群,反应器从亚硝化状态转变为CANON状态时,Proteobacteria变化最为显著。Chlorobi和Chloroflexi在样品2和样品3中也占据了较大比例,这和其他研究的结果是一致的〔6-7〕,该类细菌和脱氮菌成共生关系,其代谢产物促进了厌氧氨氧化菌的生长〔8-9〕。
图 5是样品中主要脱氮菌属的相对丰度。
图5
可以看出,启动初期的样品1硝化菌属包括Nitrosomonadaceae(相对丰度为0.35%)、Nitrosospira(相对丰度为2.53%)、Nitrosomonas(相对丰度为0.76%)、Nitrospira(相对丰度为5.47%),前三种均为AOB菌属,后一种为NOB菌属。样品2和样品3中的硝化菌属均只有Nitrosomanas(相对丰度分别为13.81%和27.78%),表明NOB被系统淘汰。对比样品2和样品3,反应器从亚硝化状态转变为CANON状态时,Nitrosomona的相对丰度提高了1倍多,Nitrosomona是亚硝化过程最重要的功能菌属,表明随着状态的改变,整个系统的亚硝化稳定性趋向更好。
在属水平上选择厌氧氨氧化菌所在的Plancto- mycetes门进行分析,结果显示,其中的Candidatus_Brocadia、Candidatus_Jettenia、Candidatus_Kuenenia、Candidatus_Scalindua属是具有厌氧氨氧化功能的菌属。反应器从亚硝化状态转变为CANON状态时,Candidatus_Jettenia占比从30.96%降低至1.66%,Candidatus_Kuenenia则从32.13%升高至67.47%。研究表明,与其他厌氧氨氧化菌属相比,Candidatus_Jettenia对亚硝酸盐的耐受性更高〔10〕,而Candidatus_Kuenenia适合存在于低基质浓度污水中〔11〕。在亚硝化状态时,系统内亚硝酸盐浓度较高,Candidatus_Jettenia比例较高,而CANON状态系统整体基质浓度较低,Candidatus_Kuenenia则成为主要菌属。
3 结论
(1)在连续流反应器内投加悬浮填料作为生物载体,富集培养亚硝化细菌,可以成功实现NO2--N的累积。在进水NH4+-N为320~380 mg/L,温度为30.2~34.5 ℃的条件下,控制HRT为48 h、DO为1.0~1.5 mg/L、pH为8.0~8.6,系统对NO2--N累积率达90%以上,对NH4+-N平均去除率为60.7%,出水NO2--N和NH4+-N比值平均为1.33,采用该方法可在21 d内实现稳定的亚硝化。
(2)悬浮载体生物膜反应器达到稳定亚硝化状态后维持较低的DO,将系统NO2--N控制在100 mg/L以下,可以逐渐转变为CANON反应器。试验期间系统在实现亚硝化的基础上,又运行164 d后对TN的去除率从15.0%增加至72.6%,亚硝化期间的低DO运行为CANON系统中厌氧氨氧化菌的生长创造了条件。
(3)系统启动后微生物种群发生了较大变化,其中变形菌门(Proteobacteria)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)是启动后的优势菌群,Proteo- bacteria和Planctomycetes是主要的脱氮菌群。脱氮菌属的数据表明,启动后NOB菌属Nitrospira被逐渐淘汰,AOB菌属Nitrosomonas成为优势菌属。系统从亚硝化转变为CANON状态时,Nitrosomona属的相对丰度显著增加,Candidatus Kuenenia成为Plan- ctomycetes门的主要菌属。
参考文献
Roles of polyurethane foam in aerobic moving and fixed bed bioreactors
[J].DOI:10.1016/j.biortech.2009.05.062 [本文引用: 1]
移动床生物膜反应器(MBBR)技术解决方案及其应用
[J].DOI:10.3321/j.issn:1000-4602.2009.20.017 [本文引用: 1]
Effect of free ammonia on the respiration and growth processes of an enriched Nitrobacter culture
[J].DOI:10.1016/j.watres.2006.11.030 [本文引用: 1]
Inhibition of Nitrification by Ammonia and Nitrous Acid
[J].
Key Physiology of Anaerobic Ammonium Oxidation
[J].DOI:10.1128/AEM.65.7.3248-3250.1999 [本文引用: 1]
Insight into the aggregation capacity of Anammox consortia during reactor start-up
[J].
Successful start-up of the anammox process:Influence of the seeding strategy on performance and granule properties
[J].
Reinforcing carbon fixation:CO2 reduction replacing and supporting carboxylation
[J].DOI:10.1016/j.copbio.2017.07.014 [本文引用: 1]
Symbiotic relationship analysis of predominant bacteria in a lab-scale anammox UASB bioreactor
[J].DOI:10.1007/s11356-015-6016-z [本文引用: 1]
Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor
[J].DOI:10.1111/j.1462-2920.2008.01642.x [本文引用: 1]
The membrane bioreactor:A novel tool to grow anammox bacteria as free cells
[J].DOI:10.1002/bit.21891 [本文引用: 1]






 津公网安备 12010602120337号
津公网安备 12010602120337号