染料废水具有色度高、成分复杂、毒性大、难生物降解等特点,其常规处理方法包括混凝、膜分离、高级氧化和吸附等。然而这些方法普遍存在成本高、耗时长,产生二次污染等问题〔1-2〕,相比之下,生物法因操作简单、运行成本低、不会造成二次污染而被广泛应用。近年来,人们致力于研发一些处理染料废水的生物新方法,研究主要集中在发现和培育各种具有高效脱色效果的菌株,利用其生物降解染料废水中的污染物。已发现很多对染料废水有降解作用的微生物,如细菌、真菌和藻类等〔3-4〕。目前主要是依靠培育的特定细菌来降解染料废水,细菌可通过自身的新陈代谢将染料降解过程中产生的芳香胺等有毒物质分解成小分子物质〔5〕,大大降低了印染废水的危害。
本研究从活性污泥中筛选出对复杂染料废水具有高效脱色能力的功能菌,研究影响其脱色效果的因素,探究降解复杂染料废水的机理。旨在研发对复杂染料废水具有高效脱色性能的功能菌,为高效功能菌用于处理复杂染料废水提供一定理论基础。
1 材料与方法
1.1 染料废水
复杂染料废水取自某印染工厂排放的废水。
1.2 污泥驯化与菌种筛选
取200 mL天津市某污水处理厂的活性污泥加入到500 mL含复杂染料废水培养基中进行梯度驯化,每个梯度下染料废水的色度、COD趋于稳定时驯化完成。将驯化后的污泥按照不同倍数(10-4、10-5、10-6、10-7和10-8)稀释后,取0.3 mL均匀涂布于LB固体培养基上,30 ℃下静置培养2 d,重复此步骤3~4次,得到1株对复杂染料废水有高效脱色能力的功能菌。
1.3 培养基
LB固体培养基:蛋白胨、酵母浸膏、琼脂粉、氯化钠,pH为7.0。
富集培养基:蛋白胨、酵母浸膏、氯化钠,pH为7.0。
脱色培养基:复杂染料废水、葡萄糖、蛋白胨、氯化钠、硫酸镁、三氯化铁、磷酸二氢钾、无水氯化钙,pH为7.0。
1.4 菌种鉴定
提取菌株基因组DNA作为模板,使用上游引物27F:5’-AGAGTTTGATCMTGGCTCAG-3’和下游引物1492R:5’-AGAGTTTGATCMTGGCTCAG-3’进行16S rDNA扩增,凝胶电泳和纯化回收等,将获得的rDNA序列通过BLAST程序与GenBank中的核酸数据比对分析进行菌种鉴定。
1.5 菌种脱色试验
将菌株N1接种到200 mL液体培养基中,在30 ℃、转速为120 r/min条件下富集得到菌液,将20 mL菌液加入到200 mL脱色培养基中进行脱色试验。在30 ℃、pH=7、葡萄糖、蛋白胨为碳氮源条件下静置培养,每隔2 h取上清液离心15 min,在538 nm处测定离心后上清液的吸光度,按式(1)计算脱色率。
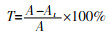
式中:T——脱色率,%;
A——复杂染料废水的初始吸光度;
At——染料废水反应后的吸光度。
1.6 菌株N1对复杂染料废水脱色的影响因素研究
由于大部分菌种最适生长温度在25~37 ℃,最适pH为5~9,所以本研究在该范围内研究碳氮源、温度、pH、复杂染料废水初始浓度、NaCl浓度以及菌种接种量对菌株N1脱色能力的影响。将20 mL富集后的菌株N1种子液接种到200 mL脱色培养基中,在表 1所示条件下进行脱色。
表1 影响因素
| 因素 | 数值 | |||||||
| 染料色度/度 | 600 | 300 | 120 | 60 | 30 | |||
| 温度/℃ | 20 | 25 | 30 | 35 | 40 | |||
| pH | 2 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 盐度/(g·L-1) | 1 | 2 | 3 | 5 | 6 | 7 | 9 | 10 |
| 接种量/% | 1 | 5 | 10 | 15 | 20 | |||
1.7 分析方法
将脱色液在8 000 r/min下离心10 min,对原水水样和上清液分别进行紫外-可见光谱扫描(200~ 900 nm)、红外光谱分析、固相萃取后GC-MS分析。
2 结果讨论与分析
2.1 脱色菌株鉴定
经筛选纯化后得到1株对复杂染料废水有高效脱色能力的菌株N1。菌株N1的氧化酶、MR实验、V-P实验及吲哚实验均为阳性,其过氧化氢酶、葡萄糖发酵、明胶液化实验、淀粉水解实验均为阴性。
对该菌进行PCR扩增后测序,该序列与路德维希氏肠杆菌(Enterobacter ludwigii strain)16S rDNA同源,一致性高达99.58%(见表 2),判断该菌为路德维希氏肠杆菌。
表2 菌株N1 16SrDNA部分序列与GenBank中其他序列的同源性对比
| 序列来源 | 一致性 | 编号 |
| Enterobacter ludwigii strain N1 16S ribosomal RNA gene,partial sequence | 99.58% | KC189896.1 |
| Pantoea agglomerans strain S5-44 16S ribosomal RNA gene,partial sequence | 99.58% | KC202283.1 |
| Uncultured bacterium clone Pure-1 16S ribosomal RNA gene,partial sequence | 99.50% | GQ372830.1 |
| Pantoea agglomerans partial 16S rRNA gene,strain WAB1951 | 99.36% | AM184290.1 |
| Citrobacter freundii strain GM1 16S ribosomal RNA gene,partial sequence | 99.36% | DQ133536.1 |
| Enterobacter sp. strain KUNi7 16S ribosomal RNA gene,partial sequence | 99.36% | KY829260.1 |
| Enterobacter roggenkampii strain DSM 16690 chromosome,complete genome | 99.36% | CP017184.1 |
| Enterobacter sp. E3-5 16S ribosomal RNA gene,partial sequence | 99.36% | KP058389.1 |
| Enterobacter ludwigii strain A-B11B 16S ribosomal RNA gene,partial sequence | 99.43% | KJ806423.1 |
| Enterobacter sp. JCM 28693 gene for 16S ribosomal RNA,partial sequence | 99.15% | LC133724.2 |
2.2 菌株N1脱色影响因素
在pH=7、接种量为10%、盐度1 g/L条件下,考察了温度对菌株N1脱色效果的影响。结果发现,20~40 ℃时菌株N1对复杂染料废水的脱色率随温度的升高呈先升高后降低的变化趋势,温度在28~35 ℃时脱色效果显著,脱色率都可达到80%以上,35 ℃时其脱色率高达91.2%,40 ℃下脱色率明显下降,仅为30%,因此菌株N1最适温度为35 ℃,属于嗜中温菌。一般微生物的生长、繁殖、生物降解活性及污染物的溶解性受温度的影响〔6〕,温度过高或过低都会影响细菌体内还原酶的活性,导致菌株脱色能力发生变化。Daizong Cui等〔7〕研究表明,染料细菌脱色的最佳温度范围较窄,在25~37 ℃之间。M. ElBouraie等〔8〕研究嗜水性气单胞菌降解染料活性黑5时发现,嗜水性气单胞菌在30~35 ℃下对活性黑5表现出良好的脱色能力,说明嗜水性气单胞菌属于嗜中温菌。
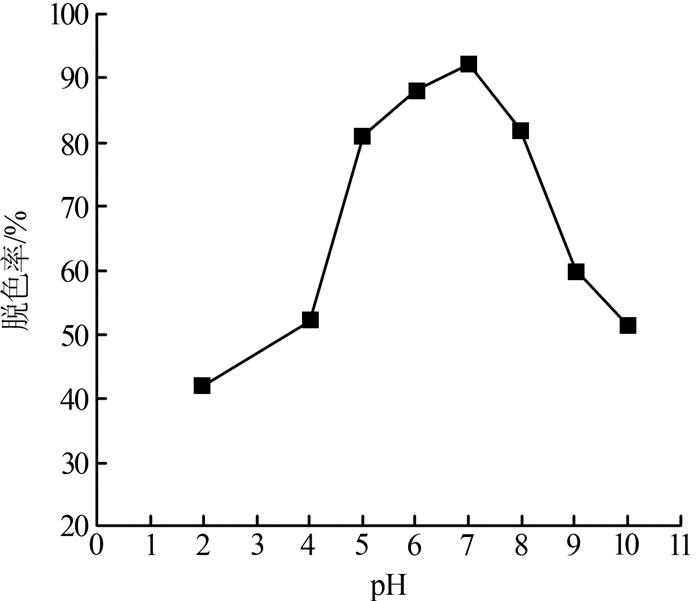
35 ℃下,盐度为1 g/L、接种量为10%时,pH对菌株N1脱色效果如图 1所示。
图1
在35 ℃、pH=7、接种量为10%条件下,考察盐度对菌株N1脱色效果的影响,结果如表 3所示。
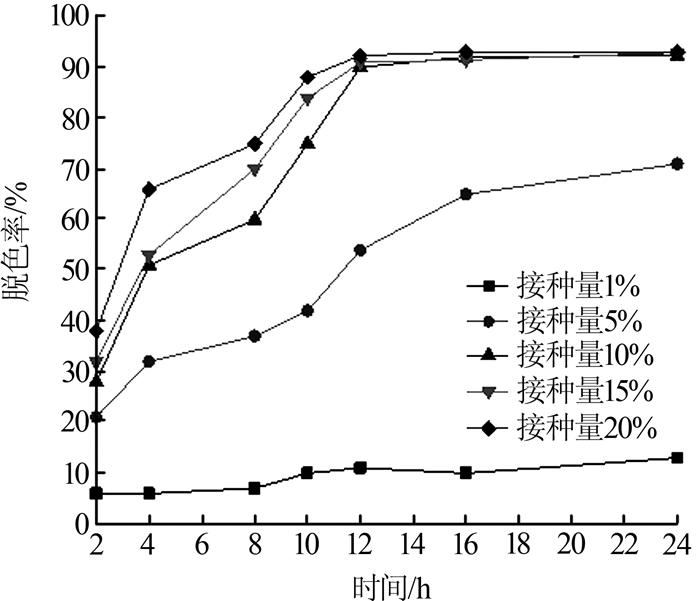
在35 ℃、pH=7、盐度为1 g/L条件下,考察接种量对菌株N1脱色效果的影响,结果见图 2。
图2
35 ℃、pH=7、接种量为10%、盐度为1 g/L时,碳氮源对菌株N1脱色效果的影响如表 4所示。
由表 4可见,葡萄糖、蔗糖和淀粉为碳源时脱色率最高,均可达到84%以上,未投加碳源的脱色率仅为36%左右。蛋白胨作氮源时脱色效果较为明显,脱色率达到92%,尿素作氮源时的脱色率为83%,硫酸铵和亚硝酸钠作为氮源时菌株N1对染料废水的脱色率均在70%左右,而未投加氮源的脱色率为49%。说明添加外源营养物后可显著提高菌株N1对复杂染料废水的脱色效率。这是由于碳源可以提供细胞生命活动所需能量,氮源是细菌合成蛋白质、核酸的主要原料,外加碳氮源提高菌株N1脱色能力表明产生了共代谢作用,即微生物从共代谢基质中获取能源降解一些难降解污染物的过程。在细菌降解脱色染料废水过程中,提供合适的共代谢基质能够促进细菌的降解脱色效果〔14-15〕。这与大多数偶氮染料降解菌的研究结论基本一致〔16〕。
2.3 紫外-可见光谱分析
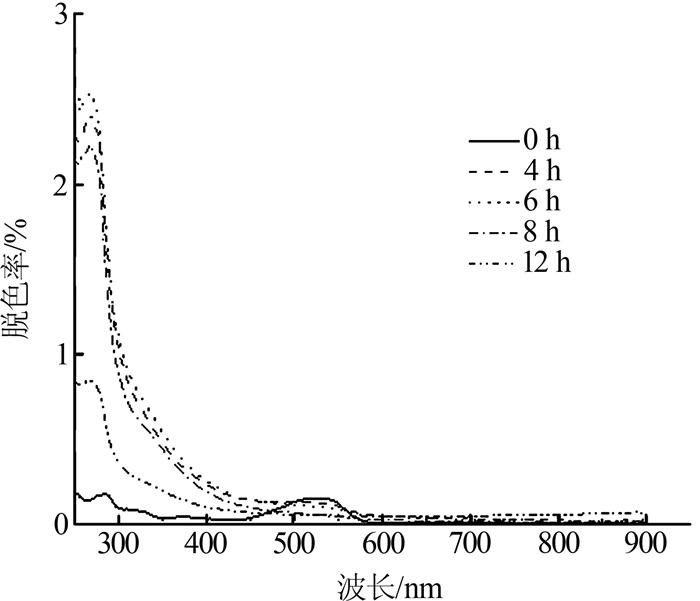
菌株N1降解复杂染料废水过程中的紫外-可见吸收光谱如图 3所示。
图3
由图 3可知,原水样在538 nm处出现最大吸收峰,随着降解反应的进行,4、6、8 h的脱色溶液在538 nm处的特征吸收峰逐渐减弱,但在270 nm处出现新的吸收峰且逐渐增强,反应12 h后538 nm处的吸收峰基本消失,270 nm处的吸收峰降低,此时脱色率为93.3%,说明废水中的染料分子结构发生变化,发色基团消失,同时含发色基团的污染物被降解转化为其他中间产物,12 h后中间产物大部分被降解,导致吸收峰降低(见270 nm处吸收峰)。
2.4 红外光谱分析
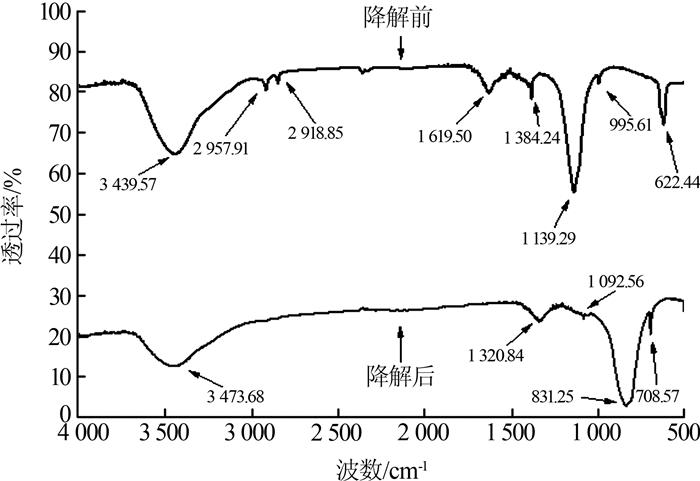
染料废水降解前后的红外光谱见图 4。
图4
如图 4所示,降解前,复杂染料废水在1 139.29 cm-1 处的峰归属于—C═O的伸缩振动,1 384.24、3 439.57 cm-1归属于—NH2和—OH的伸缩振动,1 619.50 cm-1归属于—N═N—的伸缩振动,2 918、2 957.91 cm-1归属于—CH2的伸缩振动。
2.5 GC-MS分析
为验证红外光谱中出现的—C═O、—N═N—降解为—OH和—NH2,采用GC-MS对染料废水的降解途径进一步分析,其降解产物有1-萘甲醛(含—C═O)、3,5-二叔丁基苯酚(含—OH)、2-氨基苯乙酸(含—NH2)、3-(癸基氧基)-N-(2-丙烯基)丙酰胺(含—NH2)等。由于实际染料废水成分复杂,含—N═N—类物质未被GC-MS检测到,但已检测到含—NH2芳香类物质,由此可推测染料废水中发色基团—C═O经菌株N1降解后可能转化为—OH,—N═N—经菌株N1降解后可能转化为—NH2。
3 结论
(1)从活性污泥中驯化分离出复杂染料废水高效脱色菌N1,经鉴定为路德维希氏肠杆菌。
(2)随着pH和温度的增加,菌株N1对复杂染料废水的脱色率均呈先升高后降低的趋势,温度为35 ℃、pH为7时其脱色率分别达91.2%、93%。增大NaCl浓度,菌株N1的脱色能力降低,盐度为10 g/L时其脱色率仅为28%。菌株N1对复杂染料废水降解的最佳条件:温度为35 ℃,pH=7,盐度低于5 g/L,最佳接种量为10%。将葡萄糖和蛋白胨作为碳、氮源时,可以显著提高菌株N1对复杂染料废水脱色率。
(3)根据红外光谱和GC-MS的分析结果,菌株N1降解复杂染料废水过程中显色基团—C═O和—N═N—消失,降解后出现—OH和—NH2,结合紫外-可见光谱在270 nm处出现新的吸收峰,判断可能是苯酚和芳香胺类物质,两者是染料分子降解过程中常出现的中间产物,表明菌株N1主要是通过生物降解途径处理染料废水。
参考文献
Magnetite nanoparticles with surface modification for removal of methyl violet from aqueous solutions
[J].DOI:10.1016/j.arabjc.2011.04.012 [本文引用: 1]
Interfacially crosslinked composite porous membranes for ultrafast removal of anionic dyes from water through permeating adsorption
[J].DOI:10.1016/j.jhazmat.2017.04.032 [本文引用: 1]
Decolourization of azo dye methyl red by Saccharomyces cerevisiae MTCC 463
[J].DOI:10.1016/j.chemosphere.2006.12.087 [本文引用: 1]
Treatment of simulated reactive Yellow 22(Azo) dye effluents using Spirogyra species
[J].DOI:10.1016/S0956-053X(02)00030-2 [本文引用: 1]
Long-term natural remediation process in textile dye-polluted river sediment driven by bacterial community changes
[J].DOI:10.1016/j.watres.2016.05.050 [本文引用: 1]
The removal of colour from textile wastewater using whole bacterial cells:a review
[J].
The comparative study on the rapid decolorization of azo, anthraquinone and triphenylmethane dyes by anaerobic sludge
[J].DOI:10.3390/ijerph13111053 [本文引用: 1]
Biodegradation of Reactive Black 5 by Aeromonas hydrophila strain isolated from dye-contaminated textile wastewater
[J].DOI:10.1016/j.serj.2016.04.014 [本文引用: 1]
Optimization of factors for accelerated biodegradation of reactive black-5 azo dye
[J].
Biodecolorization of azo dye acid red B under high salinity condition
[J].
Decolorization of Reactive Black 5 by a newly isolated bacterium Bacillus sp. YZU1
[J].
Decolorization of textile dyes and degradation of mono-azo dye amaranth by Acinetobacter calcoaceticus NCIM 2890
[J].
A sequential aerobic/microaerophilic decolorization of sulfonated mono azo dye Golden Yellow HER by microbial consortium GG-BL
[J].
Citrobacter sp. LW-3对偶氮染料甲基橙的降解脱色特性研究
[J].




 津公网安备 12010602120337号
津公网安备 12010602120337号