本研究对枯草芽孢杆菌进行了不同镉胁迫压力下的驯化处理,并对比研究了不同镉胁迫环境中正常菌株和驯化菌株的耐镉能力、镉去除效率及镉吸附特性差异,以期为枯草芽孢杆菌在含镉废水生物处理中的应用提供更多的理论和数据支撑。
1 材料与方法
1.1 菌株培养条件
枯草芽孢杆菌购自中国普通微生物菌种保藏管理中心。培养基组成:氯化钠5 g/L,蛋白胨10 g/L,牛肉膏3 g/L,pH调至7.0,灭菌备用。确定菌株的培养条件:温度37 ℃,振荡速率170 r/min[9]。
1.2 耐镉菌株驯化
将已活化的枯草芽孢杆菌按7%的接种量接种至含有不同镉质量浓度(25、50、150、200 mg/L)的新鲜培养基中,于37 ℃振荡培养48 h,进行耐镉能力第1次驯化。将经过1次驯化的枯草芽孢杆菌再重新转接至含有相同镉浓度的新鲜培养基中,于37 ℃振荡培养48 h,进行耐镉能力第2次驯化。
1.3 实验体系设置
设置3组实验体系:(1)正常菌株+含镉培养基;(2)驯化菌株+正常培养基;(3)驯化菌株+含镉培养基。体系1、体系3均设5个镉质量浓度:0、25、50、150、200 mg/L。向锥形瓶中加入适量正常培养基或含镉培养基,按7%的接种量接入已活化的正常菌株或驯化菌株菌悬液(培养体系总体积为200 mL),在振荡培养箱(37 ℃、170 r/min)中进行振荡培养。所有实验均设置3个平行样。
1.4 菌株生长情况监测
根据菌的生长情况,定期从实验体系中取样,测定菌液的OD600值。以培养时间为横坐标,OD600为纵坐标绘制枯草芽孢杆菌的生长曲线。
1.5 镉含量测定及计算
采用原子吸收光谱仪测定溶液中的镉含量。从培养体系中定期取0.5 mL菌悬液于离心管中,加入0.5 mL硝酸(体积分数为1%)抑制镉离子水解。离心过膜,将滤液稀释相应倍数后用原子吸收光谱仪测定镉含量。测定体系中镉含量变化时,根据每个体系中的实际情况选择取样时间点。
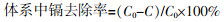
式中:C0和C—分别为溶液中的初始镉质量浓度和镉去除达到稳定期时的镉质量浓度,mg/L[10]。
2 结果与讨论
2.1 枯草芽孢杆菌耐镉能力及生长代谢活性
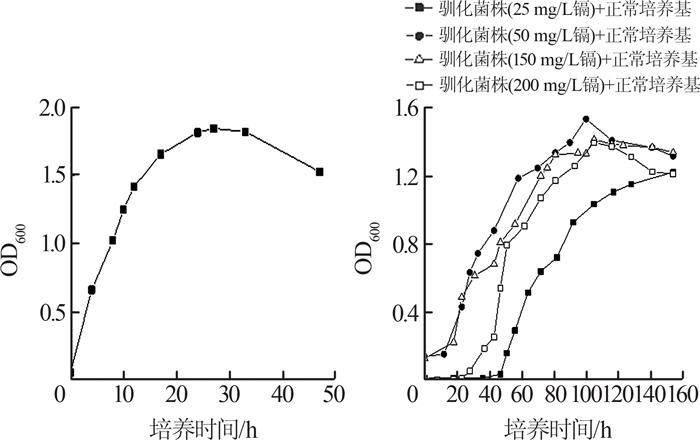
正常培养基中枯草芽孢杆菌的生长情况如图 1所示。
图1
由图 1(a)可知,正常菌株接种至新鲜培养基后,在0~24 h内生长迅速,无明显的延迟期。24~33 h期间生长缓慢,并逐渐趋于稳定。这是由于随着培养时间的延长,细菌数量大量增长,培养基中营养物质减少,导致细菌生长逐渐进入稳定期。33 h后由于体系中营养物质进一步减少,细菌代谢产物积累,细菌生长进入衰亡期。
由图 1(b)可知,驯化菌株的生长周期较正常菌株明显延长,主要表现在延迟期和稳定期,并且细菌的最大生长量有所降低,OD600最大值为1.2~1.53。4个不同浓度镉胁迫驯化菌株中,50 mg/L镉胁迫驯化菌株生长情况最佳,延迟期短,且OD600值最大能达到1.53。其次为150 mg/L镉胁迫驯化菌株。与之相比,在25、200 mg/L镉胁迫下,驯化菌株的生长情况较差。
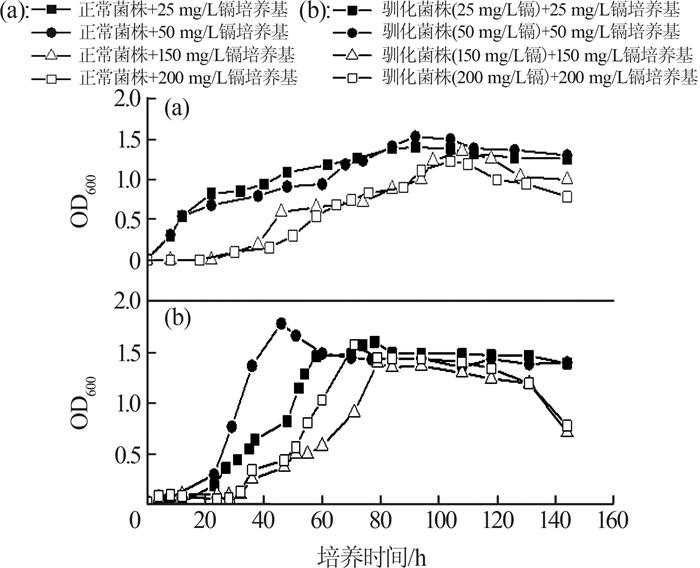
含镉培养基中枯草芽孢杆菌的生长情况如图 2所示。
图2
对于含镉培养体系中的正常菌株,镉浓度越高则延迟期越长,说明未驯化菌株对外界的镉胁迫压力反应较为敏感。对于驯化菌株,生长情况最佳的仍然为50 mg/L镉胁迫下的驯化菌株。其余镉浓度条件下,驯化菌株的生长曲线差别不大,且与正常培养基中驯化菌株的生长曲线亦无明显差别[图 1(b)]。说明经过2次驯化的菌株,其生长活性受到了一定的抑制和伤害,且这种伤害作用是长期的。
2.2 枯草芽孢杆菌对溶液中镉的去除情况
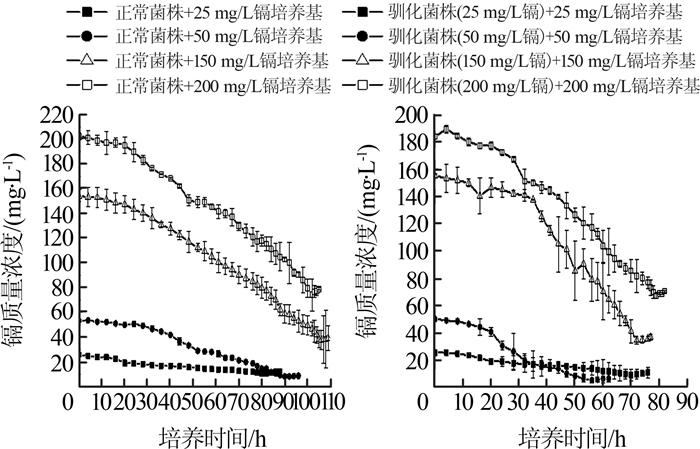
枯草芽孢杆菌对溶液中镉的去除情况如图 3所示。
图3
由图 3(a)可知,正常菌株投入不同浓度含镉培养基后,其镉去除过程可细分为2个阶段:第1阶段为0~20 h,溶液中镉的去除速率较慢;第2阶段为20 h以后,镉去除速率变快,溶液中的镉浓度逐渐下降至某一个较稳定的值。在含25、50、150、200 mg/L镉培养基中,正常菌株对镉去除达到稳定期分别需要82、90、106、102 h,与其对应的生长曲线到达稳定期的时间点基本一致,因此可以认为正常菌株在含镉培养基中生长至稳定期时,其镉去除效果达到最大。
对于驯化菌株,其镉去除过程和正常菌株类似,在延迟期镉去除速率较慢,但其到达镉去除稳定期所需的时间更短,在含25、50、150、200 mg/L镉培养基中,驯化菌株对镉去除达到稳定期分别出现在第70、56、72、79小时,该时间点也与驯化菌株在含镉培养基中生长到达稳定期的时间基本一致。
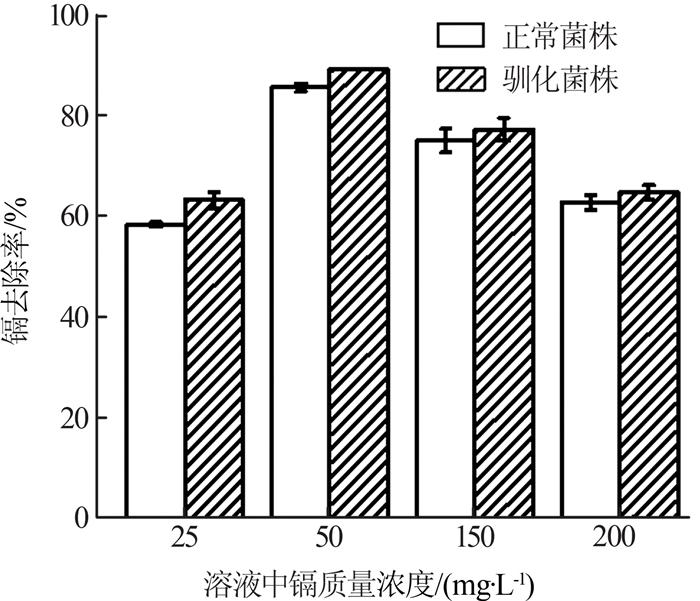
枯草芽孢杆菌驯化前后的镉去除率对比如图 4所示。
图4
由图 4可知,在本实验所设置的镉浓度范围内,驯化前正常菌株的镉去除率为58.27%~85.47%,驯化后枯草芽孢杆菌的镉去除率均有所增加,为63.14%~89.09%,说明驯化过程可以提高菌株的镉去除能力。
对比同一体系内的镉去除效果可以发现,在4个镉浓度条件下,不论是正常菌株还是驯化菌株,其对50、150 mg/L镉的去除效果更好。原因可能是在低浓度镉条件下,枯草芽孢杆菌的耐镉能力未被外界镉胁迫压力完全激活[2];而在高浓度镉条件下镉对细菌的毒性过高,会较强抑制细菌的生长活性。只有在适当的镉浓度范围内,外界镉胁迫环境并未过度抑制枯草芽孢杆菌的生长代谢活性,同时该环境下的镉胁迫压力可以刺激细菌的镉抵抗能力,促使其大量吸附或吸收外界环境中的镉,从而使细菌表现出较高的镉去除能力。
2.3 枯草芽孢杆菌镉吸附前后形态和化学特性变化
综合考虑枯草芽孢杆菌的生长情况和镉去除能力,选取50、150 mg/L的镉质量浓度体系进行红外光谱和扫描电镜-能谱分析。
2.3.1 枯草芽孢杆菌镉吸附前后官能团变化
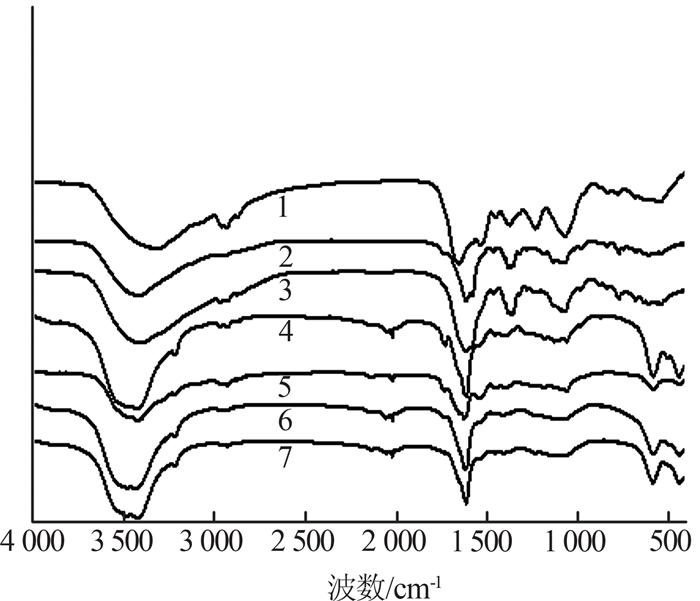
选取7个不同实验体系中的菌样进行红外光谱测试,结果如图 5所示。基于前期实验结果,测试样品均取自细菌生长的稳定期。
图5
图5
枯草芽孢杆菌镉吸附前后的红外光谱图
1-正常菌株+正常培养基;2-正常菌株+50 mg/L镉培养基;3-正常菌株+150 mg/L镉培养基;4-驯化菌株(50 mg/L镉)+正常培养基;5-驯化菌株(150 mg/L镉)+正常培养基;6-驯化菌株(50 mg/L镉)+50 mg/L镉培养基;7-驯化菌株(150 mg/L镉)+150 mg/L镉培养基。
从图 5可以看出,正常菌株在正常培养基中生长时,其细胞表面所含成分较为复杂[11],在400~4 000 cm-1内均存在吸收峰。其中,3 319.71 cm-1处的吸收峰是由蛋白质酰胺中C—H键和N—H键的伸缩振动、碳水化合物中O—H键的伸缩振动共同作用引起的;2 934.32 cm-1处的吸收峰是饱和—CH的伸缩振动峰;1 655.33 cm-1处的吸收峰来自蛋白质酰胺Ⅰ带(C=O伸缩振动)和酰胺Ⅱ带(N—H弯曲与C—N伸缩振动的迭加);1 374.29 cm-1处的吸收峰是由—COOH中的C—O伸缩和O—H弯曲引起的;1 234.12 cm-1处的吸收峰为P—O和C—S的伸缩振动以及C—O与O—H的叠加吸收峰;1 069.42 cm-1处的吸收峰是由—PO32-、胺基中C—N的伸缩振动和糖环的振动吸收带所形成的。
将正常菌株接种至含镉培养基后,其红外吸收光谱主要表现为酰胺谱带和—OH基团的变化。在50、150 mg/L镉胁迫环境中,枯草芽孢杆菌胞外吸附镉后其红外光谱图基本类似。但原先在3 319.71 cm-1处的吸收峰(正常培养基中)均迁移到3 420 cm-1附近,波数漂移了约100 cm-1,原先在1 655.33 cm-1处的酰胺峰均向低波数漂移了39 cm-1,1 069.42 cm-1处的吸收峰向低波数漂移了2 cm-1。说明细胞壁上—NH2、—OH、—COOH、—CONH、—PO32-基团对Cd2+的吸附作用明显。
对比正常培养基中驯化前后枯草芽孢杆菌的红外光谱(1和4、5)发现,驯化后—NH2和—OH基团吸收峰偏移最多,再次证明—OH和—NH2在枯草芽孢杆菌的胞外镉吸附过程中起到了重要作用。并且镉胁迫环境对菌株表面官能团的影响作用是长期的,导致驯化菌株在正常培养基中生长时仍然表现出细胞表面官能团的差异。此外,在正常菌株的红外谱图中并未发现在2 000 cm-1附近存在官能团,而在驯化菌株表面均发现在2 021 cm-1处存在炔烃,说明驯化过程会造成枯草芽孢杆菌表面炔烃官能团的产生。对比含镉培养基中正常菌株和驯化菌株的红外光谱图(2、3和6、7)发现,含镉培养基中正常菌株(2、3)细胞表面亦无炔烃官能团,然而在含镉培养基中驯化菌株(6、7)表面则同样发现炔烃官能团,证明了炔烃官能团在枯草芽孢杆菌耐镉能力驯化过程中的参与和作用。
综上所述,枯草芽孢杆菌在耐镉能力驯化及胞外镉吸附过程中起重要作用的官能团有:—NH2、—OH、—COOH、—CONH、—C≡C—。可见枯草芽孢杆菌表面具有丰富的活性基团,可以在恶劣环境下为细胞提供屏障,减轻外界有毒物质对细胞的影响[12]。
2.3.2 枯草芽孢杆菌镉吸附前后扫描电镜及能谱观察
正常培养基中枯草芽孢杆菌的扫描电镜观察结果如图 6所示。
图6
图6
正常培养基中枯草芽孢杆菌扫描电镜
(a)-正常菌株+正常培养基;(b)-驯化菌株(50 mg/L镉)+正常培养基;(c)-驯化菌株(150 mg/L镉)+正常培养基。
由图 6可以看出,在正常培养基中,正常菌株的菌体外形清晰,且表面光滑,细菌呈圆柱状,长约2 μm,直径约0.5 μm,细菌聚集较为松散。经驯化处理后,菌体收缩呈短节状,长约1 μm,直径约为0.3 μm,镉浓度越高,细胞皱缩越厉害,且细菌聚集密而杂乱。
能谱分析结果表明,正常菌株细胞表面主要含有C、H、O、N、P等元素,其中C、O、N含量较高,质量分数在90%以上。驯化后枯草芽孢杆菌细胞表面出现镉元素,其质量分数仅分别为0.09%(50 mg/L镉)和0.14%(150 mg/L镉),证明了枯草芽孢杆菌的胞外镉吸附作用;此外,细胞表面C质量分数由正常菌株的62.82%降低为60.33%(50 mg/L镉)和50.23%(150 mg/L镉),O质量分数由正常菌株的19.24%上升为23.74%(50 mg/L镉)和27.19%(150mg/L镉),N质量分数由正常菌株的13.45%上升至14.50%(50 mg/L镉)和18.67%(150 mg/L镉)。驯化菌株表面C含量降低,N、O含量升高,表明驯化过程会对枯草芽孢杆菌细胞表面结构及组分产生影响,驯化菌株细胞表面蛋白质含量可能较正常菌株更多。
含镉培养基中枯草芽孢杆菌的扫描电镜观察结果如图 7所示。
图7
图7
含镉培养基中枯草芽孢杆菌扫描电镜
(a)-正常菌株+50 mg/L镉培养基;(b)-正常菌株+150 mg/L镉培养基;(c)-驯化菌株(50 mg/L镉)+50 mg/L镉培养基;(d)-驯化菌株(150 mg/L镉)+150 mg/L镉培养基。
由图 7可以看出,正常菌株和驯化菌株在急性镉胁迫压力下均表现出菌体表面模糊、外壁皱缩和细胞内陷,反映了镉胁迫对枯草芽孢杆菌形态上的影响。且细胞之间孔隙变小,这可能是由于在外界急性压力下,细菌会分泌出更多的胞外聚合物来保护自己免受伤害,使得细菌间黏连现象明显。
能谱分析结果表明,在培养基中镉浓度相同的情况下,正常菌株表面的镉含量均高于驯化菌株。但镉去除率数据显示,驯化菌株对溶液中镉的去除效果明显高于正常菌株(图 4)。这说明在去除溶液中的镉时,驯化菌株的胞内镉积累作用要明显强于正常菌株。此外,溶液中镉质量浓度从50 mg/L增加至150 mg/L时,正常菌株表面C质量分数由63.23%增加为68.06%,O质量分数则从26.08%下降至21.03%,其余元素含量无明显变化;与之相比,驯化菌株表面C质量分数从65.18%上升为69.17%,N质量分数从10.33%降低为6.88%,其余元素含量无明显变化。说明正常菌株和驯化菌株在吸附镉时起作用的细胞表面物质并不相同。
3 结论
(1)驯化菌株的生长周期较正常菌株明显延长,镉胁迫驯化过程对枯草芽孢杆菌生长活性产生的影响是长期且不可逆的。
(2)菌株生长至稳定期时,其镉去除效果达到最大。此外,驯化过程可以提高菌株的镉去除能力。
(3)枯草芽孢杆菌细胞表面参与镉吸附过程的官能团主要有—OH、—NH2、—COOH、—CONH、—PO32-,驯化过程造成细胞表面炔烃的产生。
(4)正常菌株和驯化菌株在吸附镉时起作用的细胞表面物质并不相同。
参考文献
Heavy metals and lead isotopes in soils, road dust and leafy vegetables and health risks via vegetable consumption in the industrial areas of Shanghai, China
[J].
Optimization of copper, lead and cadmium biosorption onto newly isolated bacterium using a Box-Behnken design
[J].DOI:10.1016/j.ecoenv.2017.12.008 [本文引用: 1]
Characteristics of microbial community involved in early biofilms formation under the influence of wastewater treatment plant effluent
[J].
Effects of Bacillus subtilis and nanohydroxyapatite on the metal accumulation and microbial diversity of rapeseed(Brassica campestris L.) for the remediation of cadmium-contaminated soil
[J].DOI:10.1007/s11356-018-2616-8 [本文引用: 1]
Immobilization of cadmium in soils by UV-mutated Bacillus subtilis 38 bioaugmentation and NovoGro amendment
[J].
Cadmium and nickel toxicity for Sinapis alba plants inoculated with endophytic strains of Bacillus subtilis
[J].DOI:10.1134/S1021443718010077 [本文引用: 1]
Self-mediated pH changes in culture medium affecting biosorption and biomineralization of Cd2+ by Bacillus cereus Cd01
[J].
Influence of extracellular polymeric substances(EPS) on Cd adsorption by bacteria
[J].DOI:10.1016/j.envpol.2011.01.006 [本文引用: 1]
Role of extracellular polymeric substances in biosorption of Pb2+ by a high metal ion tolerant fungal strain Aspergillus niger PNT31
[J].DOI:10.1016/j.jece.2018.04.005 [本文引用: 1]







 津公网安备 12010602120337号
津公网安备 12010602120337号