过一硫酸盐(PMS)单独在水体中较为稳定,需通过加热、紫外光、过渡金属离子、金属氧化物等〔4〕活化产生SO4·-。铁酸锰(MnFe2O4)是一种尖晶石类纳米复合材料,在水溶液中较为稳定,不同金属的协同作用可增强电子转移效率,从而提高催化活性。Yunjin Yao等〔5〕发现MnFe2O4活化PMS降解亚甲基蓝性能良好,但存在活性点位不足和纳米粒子易团聚的缺点。将尖晶石类纳米材料与碳质材料复合,可提高电子迁移率,并分散纳米材料。三维石墨烯具有更大的比表面积,可有效固定与分散纳米材料,石墨烯自身的高导电性也可帮助电子转移,提高催化效率〔6〕。此外,有研究表明聚乙烯亚胺能够帮助石墨烯气凝胶形成〔7〕。笔者采用水热法和冷冻干燥法制备了MnFe2O4-rGO气凝胶并进行表征,考察其活化PMS降解酸性红B的效果。
1 实验部分
1.1 材料与试剂
天然石墨片(0.002 1 mm,1 200目);过一硫酸盐(KHSO5·0.5KHSO4·0.5K2SO4,PMS)、酸性红B、硝酸钠、硫酸、高锰酸钾、H2O2、聚乙烯亚胺(相对分子质量1 800)、硝酸锰、硝酸铁、盐酸、氢氧化钠、叔丁醇、甲醇,购自国药集团化学试剂有限公司,均为分析纯;实验用水为超纯水。
1.2 MnFe2O4-rGO气凝胶的制备
(1)采用改良Hummers法制备GO〔8〕。将30 mL无水乙醇加入到25 mL GO水溶液(4 g/L),超声30 min形成溶液A。
(2)将5 mL含0.087 mol/L Mn(NO3)2·4H2O和0.174 mol/L Fe(NO3)3·9H2O的混合溶液加入溶液A中,超声30 min形成溶液B。
(3)将聚乙烯亚胺水溶液(0.03 g/L)加入到溶液B中,至pH为10.5,超声30 min后转移到100 mL聚四氟乙烯高压反应釜,180 ℃反应24 h(制备单一MnFe2O4时将GO水溶液换为纯水,其余步骤一致,产物从反应釜中取出清洗烘干后,研磨备用)。
(4)将反应釜中产物浸于氨水(体积分数10%)6 h,然后冷冻干燥48 h(-54.3 ℃,9~20 Pa),得到MnFe2O4-rGO气凝胶。
1.3 实验方法
将500 mL酸性红B溶液倒入烧杯中,磁力搅拌,先加入一定量PMS,用稀硫酸或稀NaOH调节pH后,立即加入一定量MnFe2O4-rGO气凝胶开始反应,在规定时间取样,水样经0.45 μm滤膜过滤后立即测定。
1.4 分析方法
采用D-8 PC紫外可见分光光度计(美国Philes公司),在酸性红B最大吸收波长515 nm处测定滤液的吸光度,由标准曲线求得浓度;用TOC-LCPH总有机碳分析仪(日本岛津公司)测定总有机碳;用Quanta400FEG热场发射扫描电镜(美国FEI公司)、D8型X射线衍射仪(德国Bruker公司)、LabRAM Aramis型拉曼光谱仪(美国Horiba公司)、2460型全自动比表面及孔隙度分析仪(美国麦克公司)对材料进行表征。
2 结果与讨论
2.1 MnFe2O4-rGO气凝胶表征
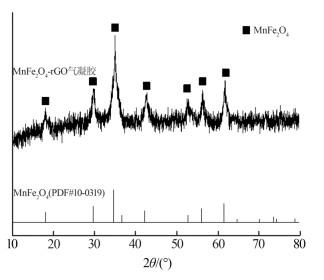
2.1.1 XRD分析
MnFe2O4-rGO气凝胶的XRD谱图如图 1所示。
图1
2.1.2 SEM和EDS分析
图 2为MnFe2O4-rGO气凝胶的SEM和EDS谱图。
图2
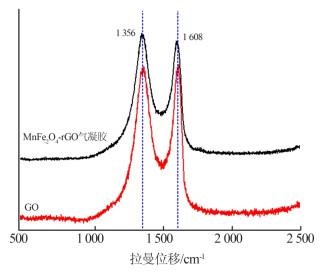
2.1.3 FT-IR和Raman分析
对GO和MnFe2O4-rGO进行傅里叶变换红外光谱分析。其中3 450 cm-1处的峰归属于O—H伸缩振动吸收峰,1 635 cm-1处的峰归属于C=C伸缩振动吸收峰,1 400 cm-1处的峰归属于—CH伸缩振动吸收峰,1 078 cm-1处的峰归属于C—O伸缩振动吸收峰;与GO谱图相比,以上官能团在复合材料中均衰减明显,证实GO在水热法过程中被有效还原〔10〕。此外,611、480 cm-1处的峰分别归属于Mn—O和Fe—O伸缩振动吸收峰。
MnFe2O4-rGO气凝胶和GO的Raman衍射谱图如图 3所示。
图3
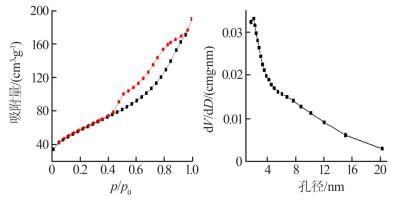
2.1.4 BET分析
通过N2吸附-解吸测试MnFe2O4-rGO气凝胶的多孔结构,结果如图 4所示。
图4
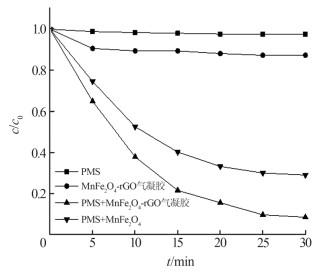
2.2 不同体系中酸性红B的降解效果
在pH为7、反应温度为20 ℃、酸性红B浓度为0.03 mmol/L、PMS为0.6 mmol/L、MnFe2O4-rGO气凝胶投加量为0.15 g/L、MnFe2O4投加量为0.15 g/L的条件下,考察酸性红B在不同反应体系中的降解情况,如图 5所示。
图5
由图 5可见,单独加入PMS难以氧化降解酸性红B;MnFe2O4-rGO气凝胶单独存在时,降解率仅有12.7%,这归因于材料对染料有一定吸附性;PMS和MnFe2O4同时存在下,反应30 min对酸性红B的降解率为70.9%;当PMS和MnFe2O4-rGO气凝胶同时存在时,反应30 min对酸性红B的降解率可达到91.5%。石墨烯气凝胶作为载体能良好分散MnFe2O4,且MnFe2O4-rGO气凝胶的比表面积较高,可减少MnFe2O4因团聚而导致的活性点位减少,石墨烯也能提高电子迁移率,从而提高降解率。
2.3 MnFe2O4-rGO气凝胶投加量的影响
在pH为7、反应温度为20 ℃、酸性红B浓度为0.03 mmol/L、PMS浓度为0.6 mmol/L的条件下,考察MnFe2O4-rGO气凝胶投加量对酸性红B降解效果的影响。当MnFe2O4-rGO气凝胶投加量为0.05 g/L时,酸性红B的降解率为45.4%;投加量增至0.2 g/L,反应30 min时酸性红B几乎能完全降解,继续增加MnFe2O4-rGO气凝胶投加量至0.3 g/L,反应20 min酸性红B就能完全降解,可能是因为随着MnFe2O4-rGO投加量的增大,活性点位更多,活化效果得以增强。
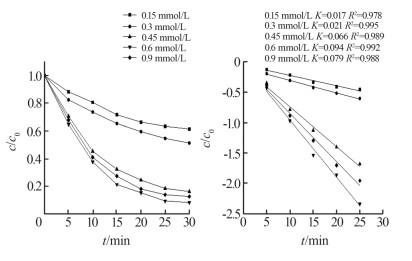
2.4 PMS浓度的影响
在pH为7、反应温度为20 ℃、酸性红B浓度为0.03 mmol/L、MnFe2O4-rGO气凝胶投加量为0.15 g/L条件下,考察PMS浓度对酸性红B降解效果的影响,结果见图 6。
图6
图 6中,PMS浓度为0.15 mmol/L时,酸性红B降解率为38.4%,当PMS增至0.45、0.6 mmol/L时,降解率分别提升到83.5%、91.5%,降解速率常数从0.017 min-1升至0.066、0.094 min-1;PMS浓度继续增加到0.9 mmol/L,降解速率常数下降为0.079 min-1,降解率也略微下降。这可能是由于PMS过量加入时生成大量自由基,自由基之间发生猝灭反应,同时过量SO4·-与HSO5-发生反应,如式(1)、式(2)所示。
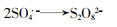
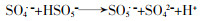
2.5 初始pH的影响
在反应温度为20 ℃、酸性红B浓度为0.03 mmol/L、PMS浓度为0.6 mmol/L、MnFe2O4-rGO气凝胶投加量为0.15 g/L条件下,考察初始pH对酸性红B降解效果的影响。pH为3~9时酸性红B均有不错的降解效果,pH为3时酸性红B降解率为92.9%;此后随着pH的上升,降解率持续降低,pH为11时降解率为57.8%。这可能与MnFe2O4-rGO气凝胶的表面零点电荷有关:当体系pH>pHpzc时,MnFe2O4-rGO气凝胶表面带负电,当体系pH<pHpzc时,MnFe2O4- rGO气凝胶表面带正电〔13〕。测得MnFe2O4-rGO气凝胶的pHpzc为7.35,因此当体系pH<7.35时,MnFe2O4-rGO气凝胶表面带正电,同时酸性红B是阴离子偶氮染料,此时MnFe2O4-rGO气凝胶与酸性红B能更好地接触反应。而碱性条件下体系中大量OH-会猝灭HO·,如式(3)、式(4)所示。


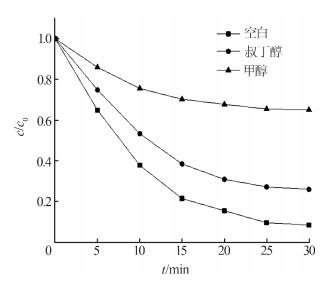
2.6 自由基捕获剂的影响
PMS体系中的活性物质主要为SO4·-和HO·,可用自由基捕获剂(叔丁醇和甲醇)来判断体系中以哪种活性物质为主。在pH为7、反应温度为20 ℃、酸性红B浓度为0.03 mmol/L、PMS浓度为0.6 mmol/L、MnFe2O4-rGO气凝胶投加量为0.15 g/L、叔丁醇及甲醇浓度均为0.2 mol/L的条件下,自由基捕获剂对酸性红B降解效果的影响如图 7所示。
图7
2.7 降解效果分析
对降解过程中的酸性红B进行紫外可见光谱测试,结果表明,酸性红B在310 nm处的萘环结构特征峰和515 nm处偶氮键特征峰〔15〕不断下降,表明萘环结构和偶氮键不断被氧化。此外,反应终点时TOC去除率为30.8%,表明MnFe2O4-rGO气凝胶/ PMS体系对酸性红B不仅有良好的脱色降解作用,还具有矿化能力。
3 结论
(1)通过水热法和冷冻干燥法制备了MnFe2O4-rGO气凝胶,活化PMS对酸性红B进行脱色降解,效果良好,当MnFe2O4-rGO气凝胶投加量为0.15 g/L、PMS浓度为0.6 mmol/L、pH=7时,反应30 min,对酸性红B降解率为91.5%,矿化率为30.8%。
(2)酸性红B的降解效果随MnFe2O4-rGO气凝胶投加量和PMS浓度的增加而提高,酸性和中性条件均有利于反应进行。
(3)MnFe2O4-rGO气凝胶比单独的MnFe2O4对酸性红B的脱色降解效果更好,降解率从70.9%提升到91.5%,MnFe2O4-rGO气凝胶活化PMS产生的自由基有SO4·-和HO·,主要的活性物质为SO4·-。
参考文献
Fe incorporated mesocellular foam as an effective and stable catalyst: effect of Fe concentration on the characteristics and activity in Fenton-like oxidation of acid red B
[J].DOI:10.1016/j.molcata.2016.01.006 [本文引用: 1]
Comparison of performances of hydrodynamic cavitation in combined treatments based on hybrid induced advanced Fenton process for degradation of azodyes
[J].DOI:10.1016/j.jece.2019.103171 [本文引用: 1]
新型Fe3O4@α-MnO2活化过一硫酸盐降解水中偶氮染料
[J].DOI:10.3969/j.issn.1000-6923.2018.08.028 [本文引用: 1]
Activation of persulfate(PS) and peroxymonosulfate(PMS) and application for the degradation of emerging contaminants
[J].DOI:10.1016/j.cej.2017.11.059 [本文引用: 2]
Magnetic recoverable MnFe2O4 and MnFe2O4-graphene hybrid as heterogeneous catalysts of peroxymonosulfate activation for efficient degradation of aqueous organic pollutants
[J].DOI:10.1016/j.jhazmat.2014.01.027 [本文引用: 1]
Facile fabrication of elastic CoO@graphene aerogel for recycled degradation of chloramphenicol
[J].DOI:10.1016/j.matlet.2018.12.132 [本文引用: 1]
3D self-assembly polyethyleneimine modified graphene oxide hydrogel for the extraction of uranium from aqueous solution
[J].DOI:10.1016/j.apsusc.2017.07.203 [本文引用: 1]
Improved synthesis of graphene oxide
[J].DOI:10.1021/nn1006368 [本文引用: 1]
MnFe2O4活化过一硫酸盐降解废水中LAS
[J].DOI:10.3969/j.issn.1000-6923.2019.08.025 [本文引用: 1]
Reduced graphene oxide wrapped Fe3O4-Co3O4 yolk-shell nanostructures for advanced catalytic oxidation based on sulfate radicals
[J].DOI:10.1016/j.apsusc.2016.11.066 [本文引用: 1]
Fabrication of 3D ultra-light graphene aerogel/Bi2WO6 composite with excellent photocatalytic performance: a promising photocatalysts for water purification
[J].DOI:10.1016/j.jtice.2019.02.016 [本文引用: 1]
Synthesis of magnetic graphene aerogels for microwave absorption by in-situ pyrolysis
[J].DOI:10.1016/j.carbon.2019.02.005 [本文引用: 1]
Activation of peroxymonosulfate by magnetic carbon supported Prussian blue nanocomposite for the degradation of organic contaminants with singlet oxygen and superoxide radicals
[J].DOI:10.1016/j.chemosphere.2018.11.197 [本文引用: 1]
Degradation of bisphenol A by persulfate activation via oxygen vacancy-rich CoFe2O4-x
[J].DOI:10.1016/j.chemosphere.2019.01.049 [本文引用: 1]
Heterogeneous photo-Fenton degradation of acid red B over Fe2O3 supported on activated carbon fiber
[J].DOI:10.1016/j.jhazmat.2014.10.057 [本文引用: 1]






 津公网安备 12010602120337号
津公网安备 12010602120337号