污泥膨胀是污水处理厂一直以来难于解决的问题之一。污泥膨胀的主要原因有非丝状膨胀以及丝状菌过量繁殖引发的丝状膨胀。对国内外污水处理厂的调查发现,由丝状菌引起的污泥膨胀达90%以上〔1〕。诱发丝状菌引起污泥膨胀的主要因素有pH、温度、溶解氧、营养物质配比等,其中温度是丝状菌生长的一个重要参数。调查表明,污泥膨胀一般发生在春冬季节〔2-3〕,夏季基本不会发生。S. Knoop等〔2〕通过研究发现,温度和污泥容积指数(SVI)呈负相关,温度是诱发微丝菌过量繁殖导致污泥膨胀的重要原因。王杰等〔4〕在考察温度对污泥沉降性的影响中发现,微生物胞内储存物PHA和糖原的储存会随温度的升高而降低,同时温度会影响丝状菌的种群结构,不同温度下会呈现出不同的优势丝状菌。
为进一步探究温度对污泥膨胀影响的本质规律,本研究采用SBR反应器,研究了不同温度下污泥膨胀过程中丝状菌的演替过程,分析了相应的微生物菌群优势菌演替规律。
1 实验部分
1.1 反应器进水
反应器进水采用人工模拟废水,按照MgSO4 0.4 mg/L,CH3COONa 0.384 7 mg/L,(NH4)2SO4 0.141 6 mg/L,KH2PO4 0.021 8 mg/L,微量元素浓缩液1 mL/L进行配制,其中微量元素的配制方法参照参考文献〔5〕。经测定,该废水中COD约为300 mg/L,BOD、总氮、总磷质量比约为300:30:5。
1.2 反应器种泥
反应器种泥取自某污水处理厂二沉池回流污泥,其中丝状菌数量较少。
1.3 反应器构造及运行
实验采用2套SBR反应器(SBR1和SBR2),反应器有效容积4 L。每周期进出水2 L,1天3个周期。每周期运行8 h,其中:进水10 min,厌氧140 min,好氧240 min,沉淀80 min,排水7 min,闲置3 min。SBR1运行温度(11±1)℃,SBR2运行温度(21±1)℃。运行过程中,溶解氧控制在1~2 mg/L,污泥质量浓度控制在3 000 mg/L左右,污泥龄为20 d,水力停留时间为16 h。
1.4 测试方法
2 结果与讨论
2.1 SVI检测分析
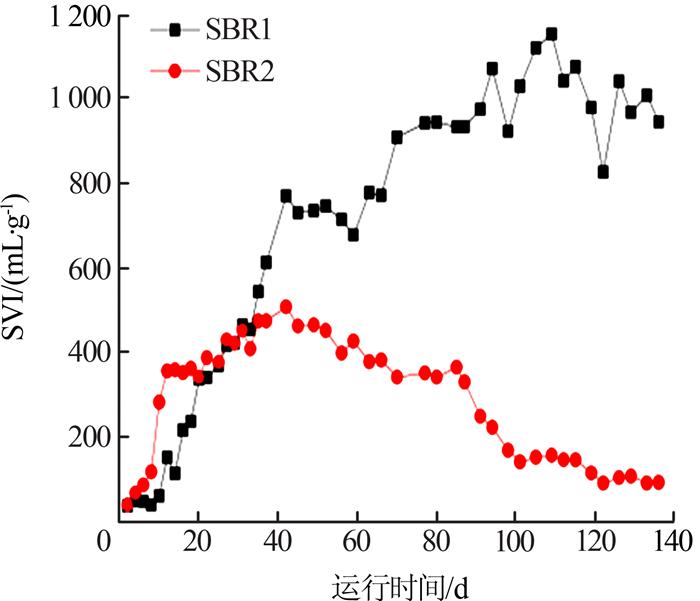
SVI值是判定污泥膨胀最直观的指标之一。反应器运行过程中SVI的变化如图 1所示。
图1
由图 1可知,在运行初期,SBR2的SVI值高于SBR1,率先发生污泥膨胀。这是因为SBR2的温度与室外环境温度接近,种泥更易适应。在适应低温环境后,SBR1在运行20 d左右开始出现污泥膨胀,SVI值大幅度上升,运行至40 d时SVI值达到800 mL/g左右,运行至110 d达到最高的1 156.54 mL/g,而SBR2在40 d后SVI值开始下降,直至恢复不膨胀。
在温度为唯一变量的反应器系统中,2个反应器呈现的污泥状态直接反映出温度是引起SBR反应器污泥膨胀的重要因素。低温环境下的SBR1适合丝状菌的大量繁殖,引起了严重的污泥膨胀;常温下的SBR2并不适合丝状菌繁殖,因此SBR2仅出现短暂的污泥膨胀后恢复至不膨胀状态。同时也证明了污泥膨胀大多发生在冬春季节,而在夏季很少出现污泥膨胀。
2.2 丝状菌镜检分析
丝状菌种类和数量的变化是污泥膨胀的微观表现,本实验对不同运行温度下的污泥絮体进行镜检,分析污泥膨胀过程中丝状菌种类及丰度的变化。
2.2.1 种泥镜检分析
图2
图3
2.2.2 反应器活性污泥的镜检分析
图4
图5
图5
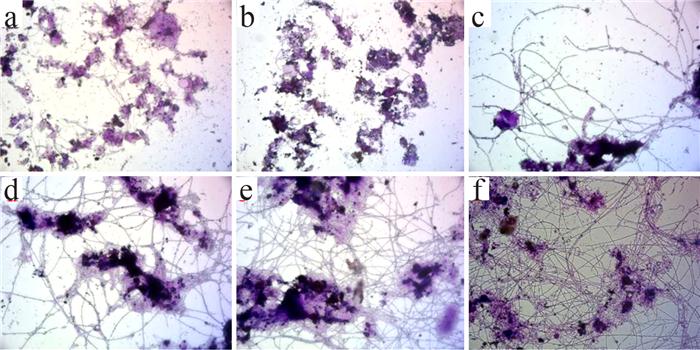
SBR1运行过程中不同时期丝状菌的变化(革兰氏染色,1 000×)
a-种泥;b-运行初期;c-膨胀初期;d-轻微膨胀时期;e-严重膨胀时期;f-运行后期。
图6
图6
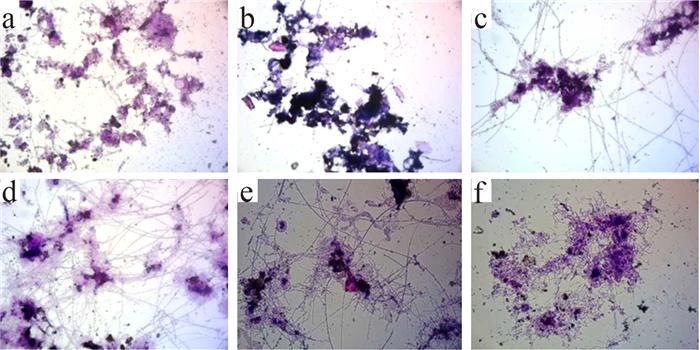
SBR2运行过程中不同时期丝状菌的变化(革兰氏染色,400×)
a-种泥;b-运行初期;c-膨胀初期;d-严重膨胀时期;e-膨胀恢复时期;f-不膨胀时期。
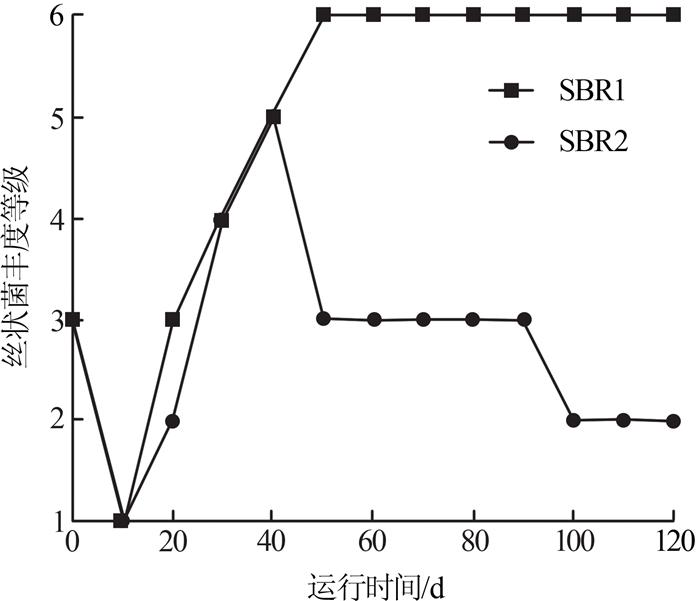
2组反应器在污泥膨胀程度与时间上都呈现较大差别。低温条件下的SBR1丝状菌丰度远高于室温的SBR2,SBR2仅出现短暂的5级,而后丝状菌丰度迅速下降。这表明低温条件下更易引起丝状菌膨胀,且低温下的污泥膨胀持续时间更长。
2.3 丝状菌丰度分析
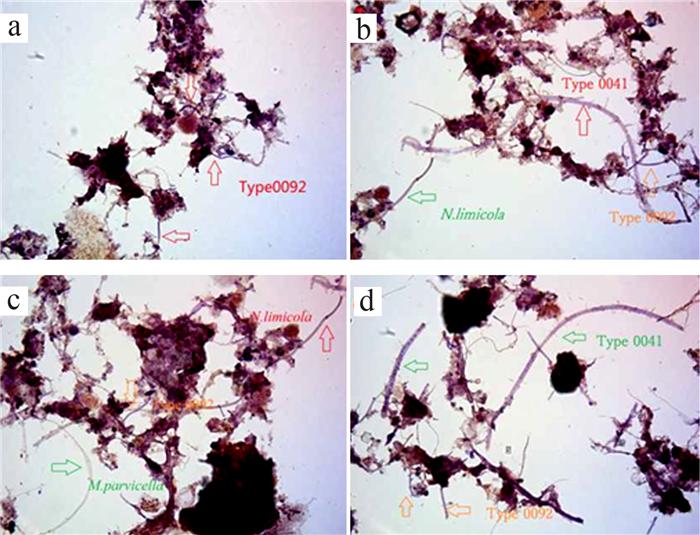
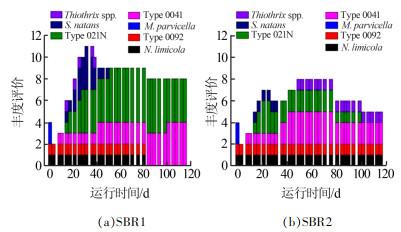
在反应器的整个运行过程中,选取出现的典型丝状菌M. parvicella、Type 021N、Type 0092、N. limicola、Type 0041、S. natans和Thiothrix spp.等进行丰度分析,结果如图 7所示。
图7
由图 7可知,种泥中以M. parvicella相对较多,丰度为2级,同时有少量的Type 0092和N. limicola,丰度等级均为1级。在种泥接种后,2个反应器污泥中的丝状菌数量明显减少,丝状菌丰度降低,且种泥中的M. parvicella消失,逐渐能观察到Type 021N、S. natans和Thiothrix spp.,即在活性污泥未膨胀时,表现出丝状菌的多样性。
SBR1在运行30 d左右开始出现污泥膨胀,优势菌为Type 021N和S. natans,丰度达4级。随着污泥膨胀的加剧,S. natans逐渐消失,Type 0041的丰度等级达到2级,Type 021N升至5级。在污泥膨胀后期,丝状菌多样性被破坏,至膨胀末期,污泥膨胀严重,Type 021N与Type 0041的丰度等级为4级,丝状菌种类单一。
运行初期SBR2污泥中的主要丝状菌为Type 021N和Type 0041,在运行20 d时活性污泥开始膨胀,Type 021N达到最大丰度3级,在运行30 d时Type 0041丰度升高。在接下来的运行中,SBR2保持以Type 0041为主要优势菌,Type 021N为次要优势菌的状态至运行后期。在运行后期,Type 0041的丰度下降,Type 021N消失,活性污泥逐渐转为不膨胀状态。
实验证明,温度是影响污泥膨胀的一个重要原因,且由于温度的不同,2个反应器在丝状菌演替上也体现了明显的差异。SBR1的主要优势菌由Type 021N和S. natans转为Type 021N和Type 0041,SBR2的主要优势菌由Type 021N和Type 0041转变为Type 0041和Thiothrix spp.。
2.4 丝状菌定量分析
图8
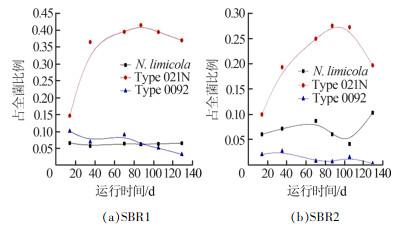
实验结果表明,SBR1中,Type 021N在运行14 d时仅占14.67%,但其作为膨胀过程中的优势菌,数量增长迅速,运行至35 d左右时,比例上升到35%以上,运行至87 d左右时,达到最大的41.51%;在运行后期,Type 0041数量逐渐增加,对Type 021N丰度产生一定影响。随着膨胀程度的不断加剧,活性污泥大量流失,丝状菌的多样性受到影响,在运行90 d后,Type 021N占全菌比例略有下降。Type 0092含量虽少,但较为稳定,后期因污泥膨胀越来越严重,污泥结构松散,流失严重,造成其浓度较低,因此在运行70 d左右时,Type 0092的含量开始迅速下降。
对于SBR2,在污泥膨胀阶段,Type 021N逐渐成为优势菌,其占全菌的比例由9.98%升到27.55%。而后随着污泥膨胀降低,优势菌Type 021N的含量开始下降,在运行末期,降至19.69%。在这个过程中,Type 0041丰度逐渐增加,成为新的优势菌。Type 0092整体变化不大,在运行到45 d左右时,由于Type 021N丰度不断增加,致使Type 0092含量相对有所降低。反应器运行中,N. limicola占全菌的比例全程高于Type 0092,且在反应前期N. limicola占全菌的比例呈上升的趋势。在运行后期,N. limicola占全菌的比例下降,在运行至105 d左右时,其比例降为4.13%。
3 结论
(1)低温运行的SBR1污泥膨胀的发生晚于室温运行的SBR2,但其污泥膨胀程度远大于SBR2。在运行后期,SBR1持续高度污泥膨胀,SBR2恢复至不膨胀状态。这表明低温环境更容易引发及保持污泥膨胀。
(2)在温度不同的条件下,活性污泥呈现不同的优势丝状菌,且在反应器运行过程中,丝状菌间存在一定的演替关系。SBR1运行前期以Type 021N为优势菌,后期以Type 021N和Type 0041为优势菌。SBR2运行前期主要优势菌为Type 021N和Type 0041,后期转为Type 0041和Thiothrix spp.。SBR1在运行的中后期,即在严重的污泥膨胀下,污泥丝状菌膨胀严重,絮体结构松散,丝状菌种类单一,丝状菌多样性下降。
参考文献
Control of Microthrix parvicella and sludge bulking by ozone in a full-scale WWTP
[J].
Influence of temperature and sludge loading on activated sludge settling, especially on Microthrix parvicella
[J].
碳源类型对污泥沉降性能及丝状菌生长的影响
[J].DOI:10.3969/j.issn.0438-1157.2011.12.025 [本文引用: 1]
Experimental attempt at using lecane inermis rotifers to control filamentous bacteria Eikelboom Type 0092 in activated sludge
[J].DOI:10.2175/106143015X14212658613037 [本文引用: 1]
Identification of filamentous microorganisms from activated sludge: A compromise between wishes, needs and possibilities
[J].DOI:10.1016/0043-1354(89)90013-4 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号