随着社会的发展和科技的进步,水质安全问题正受到广泛关注。生活废水和工业废水若未经处理直接排放到自然水体中,将会对水生态环境造成严重威胁。高铁酸盐(Ⅵ,FeO42-)是一种多功能净水剂,可以起到氧化、混凝和消毒的作用〔1-3〕。在酸性和碱性条件下,高铁酸盐的氧化还原电位分别可达+2.2 V和+0.72 V,高于常用的Cl2、ClO2、O3、KMnO4等净水剂〔4〕。与含氯净水剂相比,高铁酸盐净水剂不会产生氯代烷烃、氯酚等有害物质,安全性更高〔5〕。此外,采用高铁酸盐处理废水时,高铁酸盐还原生成的氢氧化铁可用作混凝剂,进一步实现水体颗粒物和胶体污染物的去除〔6-7〕。基于高铁酸盐在水处理方面的优异特性,高铁酸盐的合成及其在废水处理中的应用引起了越来越多的关注。
高铁酸盐的制备方法主要有干式氧化法、湿式氧化法和电化学氧化法〔8〕。干式氧化法制备高铁酸盐需要高温和强碱性条件,存在反应不易控制、安全性差和设备要求高等问题。湿式氧化法在强碱性条件下利用次氯酸盐或臭氧氧化Fe(Ⅲ)制备高铁酸盐,与干式氧化法相比,反应条件要求相对较低,且制得的产物纯度有所提升;然而湿式氧化法制备高铁酸盐也存在反应产物纯度低、操作复杂、设备腐蚀严重和对环境污染大等问题〔9〕。电化学氧化法制备高铁酸盐具有工艺简单、产品纯度高、成本低和环境友好等优点,受到科研工作者的广泛关注〔10〕。孙旭辉等〔11〕利用电化学氧化法实现了高铁酸钠的制备,该方法具有高效、低能和合成快速的特点。夏庆余等〔12〕以灰铸铁为阳极,采用电化学氧化法制备高铁酸盐,经150 min电解后即可获得较高浓度的高铁酸盐。
本研究以铁电极为阳极、金属钛板为阴极,在阳离子交换膜电解槽中进行了高铁酸钠的制备。探析了电解液浓度、制备温度、电流密度对高铁酸钠生成的影响机理,获得了阳离子交换膜电解槽制备高铁酸钠的最优参数。在此基础上,研究了高铁酸钠制备过程中铁阳极的钝化机理,为实现高铁酸钠的高效、连续制备奠定了理论与实验基础。
1 实验材料与方法
1.1 实验材料
NaOH(质量分数≥96%,不同)、硫酸铁铵(≥99%)、盐酸羟胺(≥99%)、醋酸钠(≥99%)、醋酸(36%,AR)、次氯酸钠(AR)、1,10-菲啰啉(≥99%),均购自阿拉丁试剂有限公司;无水乙醇(≥99.5%)购自天津永大化学试剂有限公司;高纯铁片(≥99.99%)购自清河腾丰金属材料有限公司。
1.2 实验方法
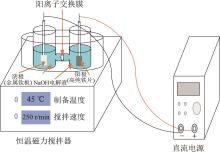
采用电化学氧化法制备高铁酸钠,电解装置见图1。
图1
图1
电化学合成高铁酸钠实验装置
Fig. 1
The experimental setup used for synthetizing sodium ferrate(Ⅵ)
如图1所示,实验装置主要包括隔膜式H型电解槽、阳极、阴极、阳离子交换膜、恒温磁力搅拌器和直流电源。阳极为高纯铁片,阴极为金属钛片,尺寸均为10 mm×10 mm×1 mm。采用阳离子交换膜将H型电解槽的阴极室和阳极室隔开,并向电解槽中注入NaOH溶液作为电解液。使用铜导线将阴、阳极分别连接在直流电源的负极和正极。电解后即可在阳极室获得高铁酸钠溶液。
1.3 分析方法
采用直接分光光度法〔15〕测定高铁酸钠溶液的浓度,并基于法拉第定律计算了制备高铁酸钠的电流效率,公式见
式中:η——电流效率,%;
Z——转移的电子数;
F——法拉第常数,96 500 C/mol;
V——高铁酸钠溶液的体积,mL;
C——高铁酸钠溶液的浓度,mol/L;
j——电流密度,mA/cm2;
S——电极的有效面积,cm2;
t——电解时间,s。
采用三电极体系研究了高铁酸钠制备过程中阳极的电化学行为。工作电极为高纯铁片,尺寸为10 mm×10 mm×1 mm;对电极为铂片,尺寸为10 mm×10 mm×0.1 mm;参比电极为Hg/HgO电极。将工作电极、对电极和参比电极分别插入隔膜式三电极电化学分析池中,注入NaOH溶液,采用CHI660E型电化学工作站对工作电极进行循环伏安(CV)测试,扫描范围为-1.3~0.7 V,扫描速率为10 mV/s。
对钝化后铁阳极的物相组成进行分析。FESEM-EDS分析采用SU8020型高分辨场发射扫描电镜,XPS分析采用Therom Escalab 250Xi光电子能谱仪。
2 结果与讨论
2.1 铁阳极循环伏安分析
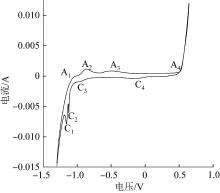
图2为高铁酸钠制备时铁阳极的循环伏安曲线。
图2
由图2可以看出,正向扫描时,在CV曲线的-1.05 V(A1)、-0.9 V(A2)、-0.5 V(A3)和0.55 V(A4)处可观察到4个氧化峰,分别对应Fe(0)→Fe(Ⅱ)、Fe(Ⅱ)→Fe(Ⅲ,Ⅱ)/Fe(Ⅲ)、Fe(Ⅲ)→Fe(Ⅴ)和Fe(Ⅴ)→Fe(Ⅵ)的氧化反应〔16-17〕;当电位高于0.55 V时,随着电位的进一步升高,阳极电流表现出急剧增加的趋势,说明高电位会加快Fe(Ⅵ)的生成速率。负向扫描时,CV曲线上可观察到C4、C3、C2、C1共4个还原峰,分别对应Fe(Ⅵ)→Fe(Ⅲ)、Fe(Ⅲ)→Fe(0)、Fe(Ⅲ,Ⅱ)→Fe(Ⅱ)和Fe(Ⅱ)→Fe(0)的还原反应〔18-19〕。
2.2 NaOH浓度对高铁酸钠生成的影响
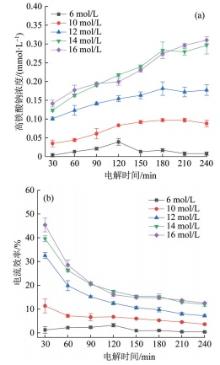
在制备温度为25 ℃、电流密度为5 mA/cm2的条件下,设定NaOH浓度分别为6、10、12、14、16 mol/L,探析NaOH浓度对高铁酸钠生成量以及电流效率的影响,结果见图3。
图3
图3
NaOH浓度对高铁酸钠生成量(a)及电流效率(b)的影响
Fig. 3
Influence of NaOH concentration on Na2FeO4 generation concentration(a) and current efficiency(b)
由图3可知,当NaOH浓度由6 mol/L提高至14 mol/L、铁阳极电解240 min时,高铁酸钠的浓度从0.008 mmol/L提高到0.296 mmol/L,电流效率从0.32%提升至11.90%,高铁酸钠的生成量提高了36倍,电流效率增加了11.58%。由此可知,NaOH浓度对高铁酸钠的生成有重要影响。然而,当进一步将NaOH浓度由14 mol/L提高至16 mol/L时,高铁酸钠生成量以及电流效率并未发生显著变化。基于此,综合考虑电流效率和生产成本,14 mol/L是电化学合成高铁酸盐的最佳NaOH浓度。
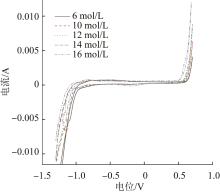
为探析NaOH浓度对高铁酸钠生成的影响机理,在不同NaOH浓度条件下对铁阳极进行了循环伏安分析,结果见图4。
图4
图4
不同NaOH浓度下铁阳极的循环伏安曲线
Fig. 4
Cyclic voltammetry curves of ferrous anode under different NaOH concentration
由图4可知,随着NaOH浓度的升高,CV曲线上Fe(Ⅵ)的生成峰向低电位区域移动。此外,同电位条件下,高浓度NaOH对应的阳极电流值也要高于低浓度NaOH。因此,提高NaOH浓度既有利于高铁酸钠生成的热力学,也有利于其动力学。K. BOUZEK等〔20〕的研究也表明,NaOH浓度对高铁酸钠的合成速率有显著影响,高浓度NaOH更有利于高铁酸钠的合成。当NaOH浓度>14 mol/L时,浓度的进一步提高对高铁酸钠生成的影响较小,这可能归因于2点:(1)碱度过高降低了高铁酸钠的溶解度,氧化生成的高铁酸根吸附在铁阳极表面,阻碍了反应进一步进行;(2)碱度过高导致电解液黏度过大,电解过程中生成的气体不易排出,电解液的电导率降低,不利于电流效率的提高。
2.3 制备温度对高铁酸钠生成的影响
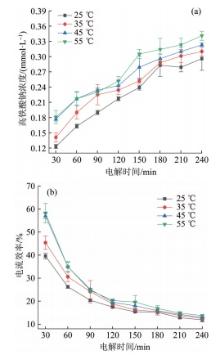
在NaOH浓度为14 mol/L、电流密度为5 mA/cm2的条件下,设定制备温度分别为25、35、45、55 ℃,研究制备温度对高铁酸钠生成量以及电流效率的影响,结果见图5。
图5
图5
制备温度对高铁酸钠生成量(a)及电流效率(b)的影响
Fig. 5
Influence of preparation temperature on Na2FeO4 generation concentration(a) and current efficiency(b)
由图5可知,当制备温度由25 ℃提高至55 ℃、铁阳极电解240 min时,高铁酸钠的生成浓度从0.296 mmol/L提高到0.341 mmol/L,电流效率从11.90%提升至13.71%,高铁酸钠的生成浓度增加了0.045 mmol/L,电流效率增加了1.81%。由此可知,随着温度的升高,高铁酸钠的生成量和电流效率均略有升高,但提升并不显著。当制备温度由45 ℃升高到55 ℃时,高铁酸钠合成的电流效率几乎没有发生变化。基于此,45 ℃是电化学合成高铁酸钠的最佳制备温度。
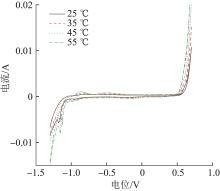
为探析制备温度对高铁酸钠生成的影响机理,在不同温度条件下对铁阳极进行了循环伏安分析,结果见图6。
图6
图6
不同制备温度下铁阳极的循环伏安曲线
Fig. 6
Cyclic voltammetry curves of ferrous anode under different preparation temperature
2.4 电流密度对高铁酸钠生成的影响
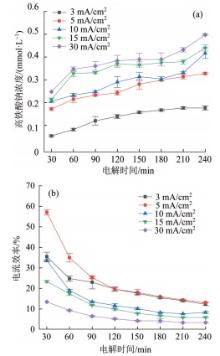
在NaOH浓度为14 mol/L、制备温度为45 ℃条件下,设定电流密度分别为3、5、10、15、30 mA/cm2,研究电流密度对高铁酸钠生成量以及电流效率的影响,结果见图7。
图7
图7
电流密度对高铁酸钠生成量(a)及电流效率(b)的影响
Fig. 7
Influence of current density on Na2FeO4 generation concentration(a) and current efficiency(b)
2.5 铁阳极的钝化机理
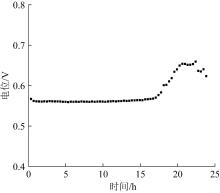
在获得电化学合成高铁酸钠最优参数的基础上,探析了电解合成过程中铁阳极的钝化机理,结果见图8。
图8
图8
电化学合成高铁酸钠恒流实验
Fig. 8
Constant current experiment of electrochemical synthesis of Na2FeO4
由图8可知,在0~17 h的电解时间内,阳极电位较为平稳。当电解时间>17 h时,阳极电位开始急剧上升,此时铁阳极表面开始出现钝化现象,阳极电导率降低,阻止了高铁酸根的生成。
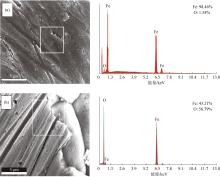
为探析铁阳极的钝化机理,对电解前和钝化后(24 h)的铁阳极分别进行了FESEM-EDS分析,结果见图9。
图9
图9
电解前(a)和钝化后(b)铁阳极形貌及微区元素组成
Fig. 9
FESEM-EDS analysis of fresh ferrous anode(a) and the passivated ferrous anode(b)
采用XPS分析钝化后铁阳极表面Fe的价态组成,进一步确定铁阳极钝化生成的氧化物种类,结果见图10。
图10
从XPS全谱〔图10(a)〕可以观察到钝化后铁阳极表面存在Na、Fe、O和C元素,其中C元素为碳污染峰,Na元素可归因于电解过程中黏附在铁阳极表面的NaOH。为确定铁阳极表面Fe元素的价态组成,对Fe 2p的能谱区域进行了分析〔图10(b)〕,708.4 eV和721.9 eV处的Fe 2p3/2和Fe 2p1/2特征峰证明了铁阳极表面存在Fe2+,而710.2 eV和723.7 eV处的Fe 2p3/2和Fe 2p1/2特征峰证明了铁阳极表面存在Fe3+。参考M. C. BIESINGER等〔24〕的研究可知,XPS分析检测到的Fe2+和Fe3+均存在于Fe3O4中。因此,XPS分析结果有效证明了电化学合成高铁酸钠过程中,铁阳极被氧化生成Fe3O4是阳极钝化的主要原因。
综上,以铁电极为阳极、NaOH为电解液,采用电化学氧化法制备高铁酸钠过程中,铁阳极钝化生成Fe3O4是导致高铁酸钠生产连续性差的主要原因。基于此,为提升高铁酸钠生产的连续性,可从两方面进行改进:(1)对铁阳极进行改性处理,如控制铁阳极中的碳含量或掺入其他元素,提升铁阳极的抗氧化性;(2)对电解液进行改性处理,如向电解液中掺入NaCl等改性剂,抑制高铁酸钠制备过程中析氧副反应的发生〔14〕。
3 结论
本研究采用电化学氧化法合成了高铁酸钠,研究了NaOH电解液浓度、制备温度和电流密度对高铁酸钠生成的影响,探析了高铁酸钠制备过程中铁阳极的钝化机理。
(1)提高NaOH浓度和制备温度均有利于高铁酸钠的生成,同时也有利于提高电流效率;提高电流密度虽会增加高铁酸钠的生成量,但也会显著降低电流效率。
(2)从电流效率和生产成本两方面考虑,NaOH浓度为14 mol/L、制备温度为45 ℃、电流密度为5 mA/cm2是电化学合成高铁酸钠的最佳条件。
(3)电化学氧化合成高铁酸钠过程中,铁阳极钝化生成Fe3O4是其失效的主要原因。
参考文献
Chlorine decay and trihalomethane formation following ferrate(Ⅵ) preoxidation and chlorination of drinking water
[J].
Ferrate(Ⅵ) decomposition in water in the absence and presence of natural organic matter(NOM)
[J].
Rapid removal of acesulfame potassium by acid-activated ferrate(Ⅵ) under mild alkaline conditions
[J].
绿色高效新型水处理剂高铁酸盐的性质及应用进展
[J].
Properties and development of a new environment and high efficient water treatment chemical-ferrate
[J].
低强度交变磁场对盐水中紫铜的缓蚀作用
[J].
The Effects of low-intensity alternating magnetic field on corrosion inhibition of copper in NaCl solution
[J].
Ferrate(Ⅵ)-prompted removal of metals in aqueous media:Mechanistic delineation of enhanced efficiency via metal entrenchment in magnetic oxides
[J].
Progress in the development and use of ferrate(Ⅵ) salt as an oxidant and coagulant for water and wastewater treatment
[J].
Ferrates:Greener oxidants with multimodal action in water treatment technologies
[J].
新型高效水处理剂高铁酸钾的研究进展
[J].
Progress in development of potassium ferrate as new,highly efficient water treatment agent
[J].
Drinking water treatment by in situ generated ferrate(Ⅵ)
[J].
电化学法制备高铁酸盐条件优化的研究
[J].
Optimization on the process of electrochemical ferrate(Ⅵ) synthesis
[J].
电解制备高铁酸盐及其处理苯胺废水的研究
[J].
Study on preparation of ferrate by electrolysis and its application in aniline wastewater treatment
[J].
Research progress in the electrochemical synthesis of ferrate(Ⅵ)
[J].
铁阳极钝化对高铁酸盐电化合成工艺的影响
[J].
Effect of iron anode passivation on the electrosynthesis technique of ferrate(Ⅵ)
[J].
直接分光光度法测定高铁酸盐的含量
[J].
Determination of ferrate content by direct spectrophotometry
[J].
Influence of anode material on current yield during ferrate(Ⅵ) production by anodic iron dissolution.Part Ⅲ:Current efficiency during anodic dissolution of pure iron to ferrate(Ⅵ) in concentrated alkali hydroxide solutions
[J].
On the interpretation of cyclic voltammograms of iron electrode in alkaline solution at elevated temperatures
[J].
Electrochemical synthesis of ferrate(Ⅵ) using sponge iron anode and oxidative transformations of antibiotic and pesticide
[J].
The cyclic voltammetric study of ferrate(Ⅵ) production
[J].
Influence of electrolyte composition on current yield during ferrate(Ⅵ) production by anodic iron dissolution
[J].
Electrosynthesis of ferrate(Ⅵ) ion using high purity iron electrodes:Optimization of influencing parameters on the process and investigating its stability
[J].
Novel KOH electrolyte for one-step electrochemical synthesis of high purity solid K2FeO4:Comparison with NaOH
[J].
The influence of electrolyte composition on electrochemical ferrate(Ⅵ) synthesis. Part Ⅱ:Anodic dissolution kinetics of a steel anode rich in silicon
[J].
Resolving surface chemical states in XPS analysis of first row transition metals,oxides and hydroxides:Cr,Mn,Fe,Co and Ni
[J].






 津公网安备 12010602120337号
津公网安备 12010602120337号