目前,研究人员已经对去除废水中NP的方法进行了大量研究,其主要包括物理法、化学法和生物法。如C. LEON-CONDES等〔10〕采用臭氧-电氧化耦合体系在pH=7.5、电流密度20 mA/cm2条件下对NP进行降解,得到了68%的NP降解率;W. LIMMUN等〔11〕在酸性条件下,使用含六价铁〔Fe(Ⅵ)〕的高铁酸钾(K2FeO4)作为氧化剂对模拟废水中质量浓度为1 mg/L的NP进行氧化降解,NP的最大去除率可达98%;赵晓祥等〔12〕利用纯菌恶臭假单胞菌对NP进行降解,NP降解率可达75.28%。虽然这些方法均可以有效去除水中的NP,但物理化学法存在反应过程中易产生毒性更大、更难降解的副产物的缺点,相对来讲,生物降解是一种较为环保的方法,其在降解过程中不会产生二次污染,在NP去除领域具有更广阔的应用前景。但是目前,研究人员对NP的生物处理研究主要集中在对纯菌株的富集及其降解特性的研究方面,对于以混合菌株作为主要降解菌的生物处理工艺处理含NP废水的研究尚少。此外,由于NP具有高毒性,传统的生物处理技术很难将其从废水中高效去除〔13〕。基于此,寻找一种低耗高效的NP生物降解技术已经成为研究热点。
本研究将NP作为单基质碳源,探究弱电强化厌氧生物反应系统的生物阳极对废水中NP的降解效率以及矿化程度,并探讨生物阳极对NP的降解规律,同时通过记录微生物驯化期电流的变化趋势及功率密度检测弱电强化厌氧生物反应系统的产电性能,最后利用大肠杆菌对降解产物进行生物毒性分析,从而验证该工艺对去除废水中NP的有效性。
1 材料与方法
1.1 实验装置
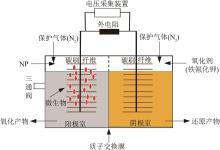
实验采用的厌氧生物反应系统的反应器为双极室反应器,如图1所示,其由阴极室、阳极室、电极、质子交换膜和外电路等组成。阴、阳极室体积各为250 mL,用质子交换膜隔开,三通阀固定于阳极室用于中间取样。阴、阳极室通入N2进行保护,使之均保持厌氧状态。两极均以碳刷纤维(长7 cm,直径5 cm的圆柱体)作为负载电极,外电路串联一个1 000 Ω的电阻,并用导线与碳刷相连形成闭合回路。实验装置中的电流和电压由数据记录仪(2700型,Keithley Instruments)记录,每10 min记录一次输出电压。
图1
1.2 微生物接种与反应器运行
污泥取自某污水处理厂浓缩池。使用前,先将污泥在4 ℃下沉淀24 h,再弃去上清液。之后为防止系统淤塞,将污泥用40目(425 μm)筛网过滤备用。阳极反应液为人工模拟NP废水,由一定浓度的NP和营养液组成,pH为7。营养液组分为:Na2HPO4·12H2O 5.775 g/L、NaH2PO4·2H2O 1.385 g/L、NH4Cl 0.31 g/L、KCl 0.13 g/L、Wolfe维生素微量元素10 mL/L、Wolfe矿质元素液10 mL/L。阴极室反应液为25 mmol/L的铁氰化钾溶液。
反应器启动之前,首先利用厌氧瓶培养具有降解NP能力的菌群。将污泥以与NP模拟废水1∶10的体积比接种于500 mL厌氧瓶中,初始NP质量浓度为5 mg/L,在30 ℃的恒温震荡培养箱中培养,每个周期为6 d,待1个周期结束后,将厌氧瓶内上清液倒出,仅留下底部污泥,继续接种少量新鲜污泥。若NP降解较少,则保持当前NP浓度,继续进行厌氧培养驯化;若NP降解较多,则逐渐增大NP质量浓度至10、20、30 mg/L,继续在30 ℃下恒温培养。待在NP质量浓度30 mg/L条件下总有机碳(TOC)和NP降解率均维持在稳定范围内,表示厌氧瓶中降解NP的功能微生物驯化成功。之后,将微生物富集液混合转接到厌氧生物反应系统阳极室,在微生物富集液与NP模拟废水体积比为1∶3,NP质量浓度为30 mg/L,室温条件下进行生物阳极功能微生物的驯化培养,每个周期为6 d,每周期结束后更换反应液,同时设置NP开路组反应器作为对照组,考察系统对NP的降解特性。
1.3 分析方法
每个周期定期取样,用0.22 μm的有机滤膜去除样品中微生物后分析样品中NP浓度和总有机碳(TOC)。其中NP浓度通过高效液相色谱(UPLC,Agilent Technologies 1260 Infinity Ⅱ,USA)进行测定,测定条件为:波长222 nm,流动相为超纯水和甲醇,其体积比为1∶9,流速1.0 mL/min,柱温30 ℃。TOC由TOC分析仪(日本岛津TOC-VCPH)测定。
为了检测弱电强化厌氧生物反应系统在降解NP过程中的产电性能,测定反应器功率曲线和极化曲线。在反应周期内电压最大时,先断开电路,开路连接2 h以上,再测定电阻分别为10 000、7 000、5 000、3 000、2 000、1 500、1 200、1 000、500、100、50、10 Ω时反应器的电压和电流,之后用电流除以碳刷横截面积得到电流密度,依据P=E2/R=I2R得出功率后除以碳刷横截面积得到各个电流下的功率密度。
采用电化学工作站(Chenhua CHI660,China)扫描循环伏安曲线(CV),扫速为6 mV/s,扫描范围为 -0.58~-0.28 V,并在0.01~1×106 Hz的频率范围内进行电化学阻抗(EIS)扫描,用于分析反应系统的内部阻抗。
为了分析NP在降解过程中产生的中间产物,采用气相色谱-质谱联用(GC-MS)对取样进行测定。气相色谱柱为HP-5MS型毛细管色谱柱(60 m×0.25 mm×0.25 μm),测试条件为进样口温度280 ℃、气质接口温度280 ℃、载气流速1.5 mL/min、进样量1 μL、分流比10∶1,升温程序设置初始温度50 ℃,保持4 min,以10 ℃/min升温到250 ℃保持5 min,再以5 ℃/min升温到280 ℃保持10 min。MS测试采用EI电离源,测试条件为离子源温度230 ℃、四级杆温度150 ℃、电离电位70 eV、全扫描模式,扫描范围为35~550 u。
选择大肠杆菌作为试验菌,检测反应器出水中剩余NP及降解产物对其的生物毒性。设计空白组(超纯水)、对照组(含15 mg/L NP的模拟废水)和实验组(弱电强化厌氧生物反应系统反应器出水)共计3组实验,考察反应器出水对大肠杆菌的生长抑制作用。具体操作步骤如下:(1)将3组溶液制成LB培养基;(2)从-80 ℃冰箱中取出大肠杆菌,在4 ℃冰箱中放置20 min后用空白组的LB培养基将0.1 mL大肠杆菌扩培10倍;(3)在空白组培养基、对照组培养基和实验组培养基中分别接种扩培过的大肠杆菌;(4)测定3组培养基的OD600值,37 ℃下在96孔板上通过酶标仪微孔板阅读器测定大肠杆菌24 h的生长趋势。
2 结果与讨论
2.1 NP和TOC的降解特性
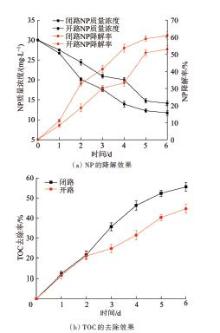
实验考察了弱电强化厌氧生物反应系统对NP和TOC的降解特性,结果见图2。
图2
图2
弱电强化厌氧生物反应系统对NP和TOC的去除效果
Fig.2
Removal effect of NP and TOC by weak current enhanced anaerobic biological reaction system
2.2 产电特性研究
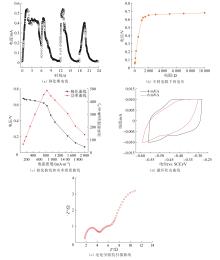
为探究弱电强化厌氧生物反应系统降解NP的产电特性,对反应器在能量转换/存储应用中的关键参数及性能曲线,即电流变化、最大输出功率、CV扫描及EIS扫描曲线进行测定,结果见图3。
图3
图3
弱电强化厌氧生物反应系统降解NP的产电特性
Fig.3
Electrogenic characteristics of NP degradation in weak current enhanced anaerobic bioreactor system
在弱电强化厌氧生物反应系统反应器启动后,通过数据记录仪收集驯化初期的电流数据,持续收集3个周期,结果如图3(a)所示,厌氧生物反应系统的产电周期为6 d左右,每个周期初始电流均迅速上升,在反应17 h左右电流达到最大,随后电流逐渐下降,直至到达最低值,周期结束。从4个周期电流整体变化趋势来看,每周期的最大电流逐渐变小,第1个周期的最大电流约为0.54 mA,而第4个周期最大电流仅为0.40 mA。这是由于在NP的存在下,微生物发生了优胜劣汰现象,部分产电微生物死亡或数量降低,同时NP降解优势菌不断富集,从而达到NP降解菌群驯化的目的。
本实验目标是在降解污染物同时获得最大输出功率,在最高电压下获得最大电流密度。在反应器对NP的降解达到稳定后,通过绘制功率密度曲线和极化曲线来反映反应器产电性能。改变反应器外接电阻,使其从10 000 Ω开始逐渐减少至0,测定不同电阻下的系统电压,结果如图3(b)所示,随着电阻由0增加到1 000 Ω,反应器两端的电压迅速增加,在电阻为1 000 Ω时,电压达到0.58 mV,之后随着电阻的增加,电压增加趋于平缓,当电阻为10 000 Ω时,电压为0.68 mV。通过不同电阻下测得的电压进一步计算进而得出极化曲线和功率密度曲线,极化曲线用来表示电流与电压的关系,可表征弱电强化厌氧生物反应系统在一定电流下能得到的最大电压。由图3(c)可知,在电流密度接近0(电阻无穷大)时,反应器两端电压最大〔18〕,通过线性拟合得出最大电压约为0.72 V。从功率密度曲线可以看出,随着电流密度的增加,功率密度呈现出先增加后减小的变化趋势,当电流密度为830.27 mA/m2时,功率密度最大,为487.37 mW/m2,根据功率密度峰值法计算得出反应器内阻约为1 000 Ω。
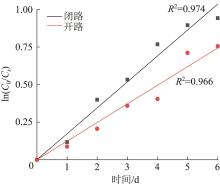
2.3 NP降解的反应动力学分析
图4
表1 厌氧生物反应系统中NP降解的动力学参数
Table 1
| 反应器状态 | 一级动力学方程式 | R2 | C0/(mg·L-1) | k/d-1 | t1/2/d |
|---|---|---|---|---|---|
| 闭路 | lnC=0.17t | 0.974 | 30 | 0.17 | 4.03 |
| 开路 | lnC=0.12t | 0.966 | 30 | 0.12 | 5.59 |
2.4 NP降解路径推测
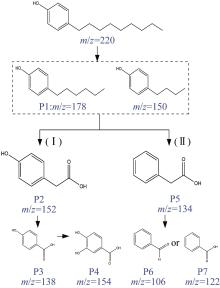
为了探索弱电强化厌氧生物反应系统中NP的降解路径,收集了同一周期不同阶段的出水样品并将其混合,经过二氯甲烷萃取后采用GC-MS检测NP降解中间产物,并结合质谱标准谱库,对降解过程中出现的未知化合物进行结构分析,最终推测出7种降解产物。之后根据所推测产物,结合NP降解过程中可能涉及到的反应机理,推测出2条降解路径,所推测降解路径及各路径相应的降解产物见图5。
图5
路径Ⅰ:NP的烷基链经羟基化后生成了短链烷基酚产物(P1),短链烷基酚产物(P1)经氧化生成了对羟基苯乙酸(P2)。随后,对羟基苯乙酸(P2)的芳香环经原位羟基化反应生成了对羟基苯甲酸(P3),该降解途径与报道的Gliocephalotrichum simplex对壬基酚的降解方式相似〔24〕。之后对羟基苯甲酸(P3)邻位羟基化生成了3,4-二羟基苯甲酸(P4),根据以往的报道,这是芳香环裂解前的最后一个中间体,体系未检测到芳香环裂解后的产物。
路径Ⅱ:NP经过羟基化反应生成短链烷基苯酚(P1)后,在微生物的进一步代谢下,短链烷基苯酚(P1)在氧化作用下生成了苯乙酸(P5),苯乙酸(P5)进一步氧化生成了苯甲醛(P6)或苯甲酸(P7)〔25〕。
2.5 NP降解产物毒性评价
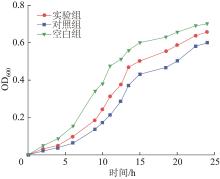
为了进一步检测NP及其降解产物的生物毒性,以大肠杆菌作为受试菌体对周期末出水中的NP及其降解产物进行了毒性检测。具体方法为:分别采用弱电强化厌氧生物反应系统(NP初始质量浓度为30 mg/L)生物阳极闭路出水的LB培养基(实验组)、含15 mg/LNP的LB培养基(对照组)和超纯水LB培养基(空白组)培养大肠杆菌24 h,每小时测定大肠杆菌生长变化,大肠杆菌的生长趋势见图6。
图6
由图6可知,大肠杆菌的培养在24 h内经历了3个阶段,即延迟期、对数期和稳定期。空白组大肠杆菌的生长速度最快,实验组次之。当大肠杆菌进入稳定期时,实验组的OD600值明显高于对照组。这表明,含15 mg/LNP的LB培养基对大肠杆菌的生长有明显的抑制作用,而初始质量浓度为30 mg/L的NP模拟废水经过弱电强化厌氧生物反应系统反应器处理后,在周期末的出水对大肠杆菌的生长抑制作用显著降低。因此,实验结果表明,反应器出水中残留的有机物和无机物的生物毒性降低,弱电强化厌氧生物反应系统对废水中NP的降解属于绿色环保的去除工艺。
3 结论
采用弱电强化厌氧生物反应系统对废水中NP的降解进行研究,实验结果表明:
(1)在微生物驯化完成后,NP初始质量浓度为30 mg/L 时,生物阳极闭路的NP最大降解率可达61.23%,TOC的去除率为54.02%,均优于生物阳极开路的表现。
(2)NP的微生物降解反应符合一级反应动力学模型,其一级反应速率常数大于生物阳极开路的相应值。
(3)弱电强化厌氧生物反应系统的产电周期约为6 d,最高电压约为0.72 V,最大功率密度为487.37 mW/m2。
(4)NP生物降解过程中共检测到7种降解产物,生物降解机理主要涉及到羟基化反应和氧化反应。
(5)生物毒性检测结果表明,NP经弱电强化厌氧生物反应体系降解后生物毒性明显降低。
参考文献
A review
[J].
Effects of xenoestrogen treatment on zona radiata protein and vitellogenin expression in Atlantic salmon(Salmo salar)
[J].
壬基酚对中华乌塘鳢精子发生及活力的影响
[J].
Effects of nonylphenol on spermatogenesis and sperm motility in bostrichthys sinensis lacépède
[J].
环境内分泌干扰物研究进展
[J].
Research progress of environmental endocrine disruptors
[J].
Acidogenic bacteria assisted biodegradation of nonylphenol in waste activated sludge during anaerobic fermentation for short-chain fatty acids production
[J].
重庆流域嘉陵江和长江水环境中壬基酚污染状况调查
[J].
A survey of nonylphnol in aquatic environment of Chongqing valley
[J].
Determination of 4-tert-octylphenol,4-nonylphenol and bisphenol A in surface waters from the Haihe River in Tianjin by gas chromatography-mass spectrometry with selected ion monitoring
[J].
城市污水处理过程中壬基酚的迁移转化途径研究
[J].
Study on translation and conversion behavior of nonylphenol in municipal wastewater treatment
[J].
Photodegradation of nonylphenol in aqueous solution by simulated solar UV-irradiation:The comprehensive effect of nitrate,ferric ion and bicarbonate
[J].
A coupled ozonation-electrooxidation treatment for removal of bisphenol A,nonylphenol and triclosan from wastewater sludge
[J].
Removal of nonylphenol and nonylphenol monoethoxylate from water and anaerobically digested sewage sludge by Ferrate(Ⅵ)
[J].
恶臭假单胞菌降解壬基酚的条件优化及产物分析
[J].
Optimal biodegradation conditions of Pseudomonas putida for nonylphenol and the analyses of its degradation products
[J].
Sono-catalytic activation of persulfate by nZVI-reduced graphene oxide for degradation of nonylphenol in aqueous solution:Process optimization,synergistic effect and degradation pathway
[J].
微生物燃料电池应用及性能优化研究进展
[J].
Research progress on application and performanceoptimization of microbial fuel cells
[J].
典型大环内酯类抗生素污染物生物电化学降解研究
[J].
Research on typical macrolides degradation bymicrobial electrochemical technologies
[J].
Chemical impact of catholytes on Bacillus subtilis-catalysed microbial fuel cell performance for degrading 2,4-dichlorophenol
[J].
零价铁强化厌氧-MFC耦合降解喹啉效果影响探究
[J].
Research on the influence of enhanced anaerobic zero valent iron-microbial fuel cell combination on the effect of quinoline degradation
[J].
阴阳室微生物燃料电池对磺胺嘧啶的降解性能及其产物生物毒性
[J].
Removal of sulfadiazine by cathode-anode microbial fuel cells and the biotoxicity of the intermediate
[J].
游离亚硝酸强化剩余污泥电发酵产氢同步磷释放及机制研究
[D].
Study on hydrogen recovery and phosphorus release mechanism in electro-fermentation system enhanced by free nitrous acid
[D].
Extracellular polymeric substance decomposition linked to hydrogen recovery from waste activated sludge:Role of peracetic acid and free nitrous acid co-pretreatment in a prefermentation-bioelectrolysis cascading system
[J].
Enhancement of hydrogen production in a single chamber microbial electrolysis cell through anode arrangement optimization
[J].
光催化辅助微生物燃料电池对广谱抗菌类抗生素的降解性能研究
[D].
Study on the degradation performance of broad-spectrum antimicrobial antibiotics by photocatalytically assisted microbial fuel cells
[D].
微生物燃料电池对磺胺间甲氧嘧啶的降解研究
[J].
Effects of microbial fuel cells on sulfamonomethoxine degradation
[J].
Biodegradation and toxicity reduction of nonylphenol,4-tert-octylphenol and 2,4-dichlorophenol by the ascomycetous fungus Thielavia sp HJ22:Identification of fungal metabolites and proposal of a putative pathway
[J].
壬基酚初级生物降解产物的辨认
[J].
Recognition and analysis on primary metabolites of nonylphenol
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号