FCM利用荧光染料染色后与SYBR Green结合,从背景信号中区分微小的微生物细胞。在系统中引入自动细胞计数,阈值设置为SYBR Green-800(B530通道),采用50 μL上样体积,35 μL/min的上样速度,可以精确地确定细菌数量。
1 材料与方法
1.1 试剂、材料和仪器
SYBR Green染料(美国赛默飞世尔);4’,6-二脒基-2-苯基吲哚二盐酸盐(DAPI,碧云天公司Beyotime C1005);LB培养基;平板计数琼脂;实验室自备E. coli菌株。
0.1 μm过滤器(美国密理博,SLW033LS);流式细胞仪(美国安捷伦,NovoCyte)。
1.2 样品处理
取12支1.5 mL EP管,分别标记为1、2、4、8、16、32、64、128、256、512、1 024和2 048,其中2~2 048管中加入250 μL过滤后的超纯水。1号管中加入500 μL水样原液,从1号管中取250 μL水样到2号管中混匀。再从2号管中取250 μL水样到4号管中混匀,依次梯度稀释下去。最终2 048管中共有500 μL水样,移出250 μL即可。
1.3 荧光染色
1.4 FCM测定
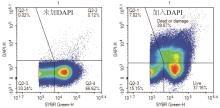
采用安捷伦NovoCyte流式细胞仪,50 μL上样体积,35 μL/min的上样速度,阈值设置为SYBR Green-800(B530通道),使用自动上样器自动采集上样。测定细胞死活时,加入DAPI,稀释1 000倍,室温染色5 min上机。
1.5 平板计数法活菌计数
采用平板计数法统计样品中活性菌浓度,采用FCM法分别统计样品中活菌数、死菌数和细菌总数。平板计数法检测:无菌操作吸取1 mL水样,注入一次性无菌平皿中,倒入46 ℃平板计数琼脂,重复三次。同时在另一个平皿直接注入培养基做空白对照。将平板放置(36±1) ℃培养箱中培养48 h后计数。
1.6 FCM与平板计数法的验证试验
根据GB 5749—2006生活饮用水卫生标准,微生物主要检测指标为总大肠菌群和菌落总数,因此本实验采用具有代表性的Escherichia coli斜面菌种。取E. coli斜面菌种1支,无菌操作挑取菌苔,接种于LB液体培养基中,37 ℃培养过夜后,作为菌悬液备用。用无菌移液枪移取1 mL菌悬液于9 mL蒸馏水样中,作为样品原液,用无菌磷酸盐缓冲液(PBS)对样品原液进行10倍梯度稀释,每个稀释度样品分别进行FCM检测和平皿计数检测〔参见(GB 4789.2—2016)食品卫生微生物学检验 菌落总数测定〕〔16〕。
1.7 数据分析
利用Excel软件对数据进行统计学分析和处理。
2 结果与分析
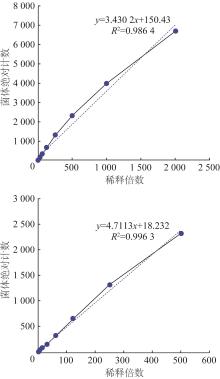
2.1 流式体积法绝对计数的准确性和线性范围
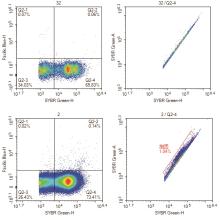
调节荧光信号选择合适的细胞群,图1显示了各稀释度下流式细胞仪测定图谱,其中最后两张图是密度图,样本浓度高时,密度图更容易看出分群情况。
图1
实验的浓度倍数、折算后浓度倍数以及折算后浓度倍数对应的菌体绝对数见表1。
表1 浓度倍数、折算后浓度与对应菌体的绝对计数
Table 1
| 浓度倍数 | 2 007.84 | 1 003.92 | 501.96 | 250.98 | 125.49 | 62.75 | 31.37 | 15.69 | 7.84 | 3.92 | 1.96 | 0.98 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 折算后浓度倍数 | 2 048 | 1 024 | 512 | 256 | 128 | 64 | 32 | 16 | 8 | 4 | 2 | 1 |
| 菌体绝对计数 | 3.96 | 6.78 | 17.00 | 34.70 | 84.00 | 156.00 | 326.00 | 653.00 | 1 307.00 | 2 319.00 | 3 965.00 | 6 704.00 |
由表1可知,1、2、4、8、16、32、64、128、256、512、1 024、2 048这12个管子测得的菌体绝对计数随着稀释倍数的增大而减少,通过数据分析对比,可以建立水样FCM快速检测技术。
梯度稀释流式体积法所得绝对计数与稀释倍数的线性关系见图2。
图2
图2
菌体绝对计数与稀释倍数的线性关系
count of bacteria and the dilution dilution times
Fig.2
The linear relationship between the absolute
图3
由图3可知,浓度低时几乎无抱团现象,浓度高时会出现抱团;低浓度时阴性和阳性区分良好,但高浓度样本阳性群会左移,这是因为染料浓度一定,细菌数增多,而浓度不够导致信号偏弱。
2.2 FCM法测定活细菌浓度及总菌浓度
图4
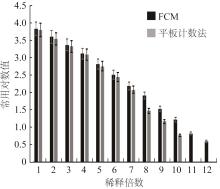
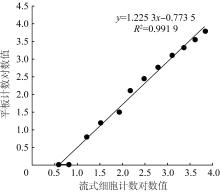
2.3 FCM法与平板计数法的准确性
图5
图5
流式细胞仪与平板计数准确性比较
Fig. 5
Comparison of accuracy between flow cytometer and plate count
图6
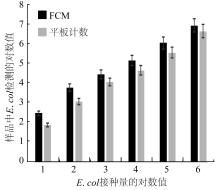
2.4 FCM法与平板计数法的验证试验
图7
图7
FCM与平板计数法的验证试验
Fig. 7
Validation test of flow cytometer and plate colony counting method
图8
3 结论
流式细胞仪可快速高通量对细菌进行绝对计数,无需计数微球,节省成本,且流式细胞仪检测线性范围宽,灵敏度高。本研究利用流式细胞仪,对环境水中细菌总数测定方法进行了研究,建立了FCM检测环境水中细菌总数的方法,利用SYBR Green和DAPI可以检测活菌和死亡的菌体,更能反应出实际细菌总数,同时与国家标准检测方法进行了比较,验证了其准确性和灵敏度,检测的结果更准确,更可靠。
参考文献
影响检测生活饮用水中菌落总数的相关因素探讨
[J].
Discussion on related factors affecting detection of total bacterial count in drinking water
[J].
菖蒲湿地处理含油废水中微生物与净化效果
[J].
Microorganisms and purification efficiency in oily wastewater treatment by calamus wetland
[J].
循环冷却水微生物调节水质机理研究进展
[J].
Advance on mechanism of water quality conditioning for recirculating cooling water by microorganisms
[J].
A 210-Min solid phase cytometry test for the enumeration of Escherichia coli in drinking water
[J].
Rapid detection,identification,and enumeration of Escherichia coli cells in municipal water by chemiluminescent in situ hybridization
[J].
流式细胞术快速检测生乳中细菌总数
[J].
Rapid detection of total bacteria in raw milk by flow cytometry
[J].
A flow cytometry method for rapid detection and enumeration of total bacteria in milk
[J].
Gram-typing of mastitis bacteria in milk samples using flow cytometry
[J].
Taking advantage of the flow cytometry technique for improving malolactic starters production
[J].
流式细胞术在超高压诱导大肠杆菌O157:H7亚致死研究中的应用
[J].
Flow cytometric assessment of sublethal injury of escherichia coli O157:H7 cells caused by high hydrostatic pressure
[J].
乳酸菌计数结果的比较研究
[J].
Comparative study on counting results in Lactobacillus counting method
[J].
应用流式细胞术鉴定死活结核分枝杆菌的实验研究
[J].
Experimental study on detection of dead and live mycobacterium tuberculosis by flow cytometry
[J].
粪悬液中肠道细菌的活性检测
[J].
Investigation of bacterial viability in gut microbiota of fecal slurry
[J].
Assessment and interpretation of bacterial viability by using the LIVE/DEAD BacLight Kit in combination with flow cytometry
[J].
余氯对河流水体微生物灭活效应的评价
[J].
Disinfection effect of residue chlorine on riverine bacterial communities
[J].
流式细胞术对生乳中微生物检测的应用研究
[J].
The application of flow cytometry in testing bacteria of raw milk
[J].
饮用水微生物的安全快速检测
[J].
Fast and safety detection of drinking water in respect of microbial quality
[J].
流式细胞术在饮用水微生物检测中的应用及挑战
[J].
Applications and challenges of microbial detection in drinking water by flow cytometry
[J].
三种自来水中微生物检测方法比较
[J].
Comparison of three detection methods of microorganism in tap water
[J].







 津公网安备 12010602120337号
津公网安备 12010602120337号