高级氧化(AOPs)是指通过产生活性羟基自由基(·OH)、超氧自由基(O2·-)等对废水中的有机物进行矿化降解的过程,因具备安全高效、操作简单、反应条件温和等优点而备受研究者的关注〔1〕。过氧化氢(H2O2)因安全性高、绿色无污染的优势成为AOPs中的常用氧化剂,其经活化产生的·OH会与水中的有机物发生反应且不会造成二次污染。通过二电子氧还原反应(ORR,2H++2e-+O2
目前,影响电化学高级氧化的电极材料〔4-5〕、反应器构型〔6〕等因素受到普遍关注,对电解液的研究相对较少,但电解液对电化学体系至关重要,电解液的电导率会影响电压、电流效率等〔7〕。从电化学反应的角度来说,电解质的电导率越高,体系的离子迁移能力越强;但从实际应用的角度来说,电解质是二次污染的来源之一。在实验室规模中,Na2SO4和NaCl是2种最常见的电解质,但体系中的Cl-及SO42-均是二次污染源,所以寻找一种不会造成二次污染的绿色电解液至关重要。在以NH4HCO3为电解液的研究中,因为该介质较为温和,电极表面的电化学反应相对缓慢〔8〕;但由于NH4HCO3具有热不稳定性,反应结束后可以通过热处理的方式将其分解挥发,避免了电解液残留的问题,因此NH4HCO3可被认为是一种绿色无污染的电解液。
本研究以NH4HCO3作为电解液,在双电极电化学系统中原位高效合成H2O2,结合紫外光催化H2O2产生·OH来降解苯酚。反应结束后,体系中残留的NH4+和HCO3-等二次污染物可以通过加热或曝气的方式快速去除。
1 材料与方法
1.1 试剂与仪器
试剂:石墨(40 μm,HTF0325,碳质量分数>99.9%)、炭黑(30 nm,Vulcan XC-72R,碳质量分数>99.9%)、聚四氟乙烯乳浊液(质量分数60%)、无水乙醇、碳酸氢铵、硫酸钠、苯酚,均为分析纯。
仪器:SX-H-10箱式电阻炉、磁力搅拌器、酶标仪、电子天平、直流电源、AutoLab电化学工作站、Ag/AgCl参比电极。
1.2 分析方法
采用AutoLab电化学工作站对反应体系进行线性伏安扫描(LSV)和电化学交流阻抗谱(EIS)的电化学测试。电化学测试在100 mL的三电极体系中进行,电解质溶液为50 mmol/L的NH4HCO3,以超疏水空气呼吸阴极为工作电极、Ti/IrO2板(4 cm×7 cm)为对电极、Ag/AgCl(3.5 mol/L KCl,0.197 V vs. SHE)为参比电极〔9〕。LSV电位窗口为+0.3~-2.0 V,扫描速度为10 mV/s;交流阻抗施加电位为-0.5 V,从高频100 kHz扫到低频0.1 Hz,振幅为10 mV。
电解池产生H2O2的电流效率(即法拉第电流效率),定义为产生H2O2所需要的电荷占总电荷产生量的比值〔12〕,可通过
式中:CE——电流效率,%;
n——O2还原生成H2O2的电子转移数,2;
F——法拉第常数,96 485 C/mol;
C
V——电解液体积,L;
I——电流,A;
t——时间,s。
1.3 实验方法
在H2O2原位合成的过程中,使用100 mL单室反应器和140 mL双室反应器在双电极体系中进行实验,采用50 mmol/L NH4HCO3为电解液,以Ti/IrO2板为阳极、疏水性空气呼吸阴极〔13〕为阴极,将阴阳极连接到直流电源上,设置磁力搅拌速度为600 r/min后进行实验。
苯酚降解装置在H2O2原位合成单室反应器的基础上进行改造,在反应器上方放置紫外灯(UV 256 nm,功率为4、6、8 W),光程为1 cm,苯酚质量浓度为100 mg/L。
2 结果与讨论
2.1 电流密度对合成H2O2的影响
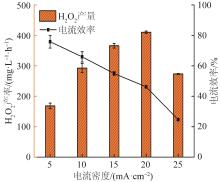
在单室反应器中分别设置电流密度为5、10、15、20、25 mA/cm2进行H2O2合成实验。在预实验过程中发现,随反应时间的延长,每个电流密度下的电流效率均逐渐下降,因此选用10 min电流效率最高时计算H2O2产量,结果如图1所示。
图1
图1
不同电流密度下的H2O2产率及电流效率
Fig. 1
H2O2 productivity and current efficiency under different current density
由图1可知,随着电流密度从5 mA/cm2增加至20 mA/cm2,H2O2产率明显上升,20 mA/cm2下的H2O2产率达到(410±4) mg/(L·h),而25 mA/cm2时H2O2产率下降至(273±2) mg/(L·h)。20 mA/cm2电流密度下的H2O2产率最佳,且达到发生高级氧化反应所需的H2O2浓度〔14〕。电流效率随电流密度的升高逐渐下降,这是由于随着电流密度的升高,阴阳极过电位均增加,且H2O2累计浓度逐渐升高,体系内H2O2在阴阳极发生的副反应增多,最显著的是H2O2在阴极会进一步被还原为H2O〔
2.2 反应器构型对合成H2O2的影响
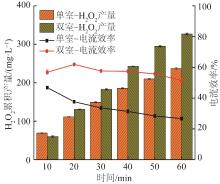
在单室和双室反应器中分别施加20 mA/cm2的电流密度进行H2O2累积实验,结果如图2所示。
图2
图2
不同反应器构型下的H2O2累积产量及电流效率
Fig. 2
Cumulative production of H2O2 and current efficiency under different reactor configurations
由图2可知,在单室反应器连续反应60 min内,H2O2累积产量呈现缓慢增长的趋势,60 min时H2O2累积产量为(237±2) mg/L。电流效率总体呈现下降的趋势,从10 min时的47%逐渐降低至60 min时的27%,这主要是由于在单室反应器中,产生的H2O2除了在阴极发生还原副反应外,还会在阳极发生氧化反应。而在20 mA/cm2电流密度下,双室反应器中的H2O2累积产量明显提升,60 min时H2O2累积产量达到(327±2) mg/L,较相同条件下单室反应器H2O2产量增长38%。双室反应器电流效率保持在55%左右,未发生明显下降的现象。所以通过改变反应器构型,利用双室反应器将阴阳极分开以减少副反应的产生,可实现提高H2O2累积产量的目的。
2.3 NH4HCO3浓度对合成H2O2的影响
图3
图3
不同浓度NH4HCO3电解液下的H2O2累积产量(a)及电流效率(b)
Fig. 3
Cumulative production of H2O2(a)and current efficiency(b)under different concentrations of NH4HCO3 electrolyte
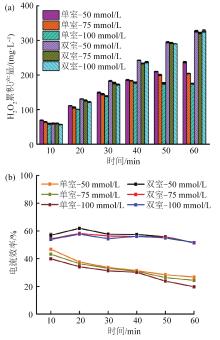
如图3(a)所示,在NH4HCO3电解液体系中,当NH4HCO3浓度从50 mmol/L逐渐增加到100 mmol/L时,单室条件下60 min时H2O2累积产量从(237±2) mg/L降至(175±1) mg/L,呈现下降的趋势;双室条件下不同电解液浓度对H2O2累积产量的影响相差不大。同时,2种反应器构型中不同浓度电解液对应的电流效率相差较小。这是由于NH4HCO3电解液中的HCO3-可以活化H2O2〔18〕,NH4HCO3电解液浓度增高造成了部分H2O2的损失,使单室中H2O2的累积产量出现下降趋势。综合考虑成本和效益,50 mmol/L是NH4HCO3电解液用于电化学原位合成H2O2的适宜浓度。
2.4 NH4HCO3与Na2SO4电解液对比
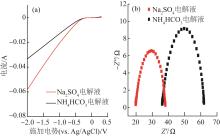
在电化学合成H2O2的过程中,Na2SO4被普遍认为是良好稳定的电解质溶液。使用浓度同为50 mmol/L的Na2SO4及NH4HCO3电解液进行实验,对比不同电解质溶液对电化学合成H2O2的影响。图4为2种不同电解质溶液体系下的LSV极化曲线和交流阻抗谱图。
图4
图4
不同电解液类型下的LSV极化曲线(a)及EIS拟合Nyquist图(b)
Fig. 4
LSV polarization curve(a)and Nyquist fitting diagram(b)under different electrolyte types
表1 不同电解液种类下电化学体系电阻组成
Table 1
| 电解液 | 溶液内阻Rs/Ω | 电荷转移内阻Rct/Ω |
|---|---|---|
| 50 mmol/L Na2SO4 | 20.1 | 7.6 |
| 50 mmol/L NH4HCO3 | 36.2 | 26.1 |
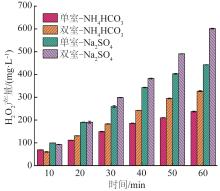
在电流密度为20 mA/cm2时,2种不同电解质溶液体系的H2O2产量对比见图5。
图5
图5
不同电解液类型下H2O2累积产量
Fig. 5
Cumulative production of H2O2 under different electrolyte types
由图5可知,NH4HCO3体系双室反应器60 min时H2O2的累积产量为(327±2) mg/L,Na2SO4体系双室反应器的H2O2累积产量高达(601±2) mg/L,约为NH4HCO3体系H2O2产量的1.8倍。NH4HCO3电解液体系内阻大是造成H2O2产量相对较小的主要原因。但NH4HCO3电解液相较于Na2SO4电解液的一大优势是其在增加体系电导率、加快H2O2产生的同时,又可以通过加热或曝气的方式被移除降解体系,避免在体系中引入杂质离子。
2.5 UV/H2O2对苯酚降解的影响
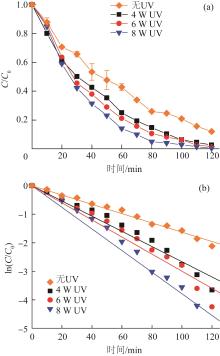
H2O2在UV的激发下可以产生高效降解污染物的·OH。单室反应器中,在以50 mmol/L的NH4HCO3为电解液电化学原位合成H2O2的体系中,不同功率UV对UV/H2O2降解100 mg/L苯酚的效果见图6。
图6
由图6(a)可知,在不同功率UV条件下,苯酚均被快速降解。UV功率为4、6、8 W的UV/H2O2体系,单室反应器60 min时的苯酚降解率分别为75.0%、78.9%和85.9%;120 min后苯酚降解率分别为97.4%、98.6%和99.6%,苯酚基本被完全降解。同时,不同功率UV条件下苯酚降解均符合准一级动力学方程,在UV功率分别为4、6、8 W时,UV/H2O2降解苯酚的一级动力学常数分别为0.026 7、0.030 0、0.035 5 min-1〔图6(b)〕。一级动力学常数随着UV功率的增大而提高,这是由于高功率的紫外光能更快速地激发H2O2产生·OH,促进反应速率进一步提升,苯酚被快速降解。
3 结论
(1)NH4HCO3作为一种绿色无污染的电解液,可高效合成H2O2,在电流密度为20 mA/cm2时,双室反应器条件下60 min时H2O2累积产量最高可达(327±2) mg/L。
(2)UV可以催化在NH4HCO3电化学体系中原位合成的H2O2快速产生·OH,进而高效降解苯酚,且苯酚降解过程符合一级动力学方程,UV功率为8 W时单室反应器60 min时的苯酚降解率为85.9%,120 min内苯酚基本被完全降解。
(3)以NH4HCO3作为电解液,在电化学体系中原位合成H2O2的过程中存在溶液内阻和电荷转移内阻大的缺点,即在一定程度上会增加电耗和影响传质。但由于其易分解的特性,可以在反应结束后通过加热的方式将NH4HCO3转变为气态NH3和CO2移除电化学体系,避免污水处理过程中引入杂质离子,造成二次污染。
参考文献
高级氧化技术水处理研究进展
[J].
Research progress of advanced oxidation technology in water treatment
[J].
Selective electrochemical H2O2 production through two-electron oxygen electrochemistry
[J].
高级氧化技术处理1,4-二噁烷污染研究进展
[J].
A critical review of advanced oxidation technology to treat 1,4-dioxane pollution
[J].
Electrosynthesis of hydrogen peroxide using modified gas diffusion electrodes(MGDE) for environmental applications:Quinones and azo compounds employed as redox modifiers
[J].
Mesoporous nitrogen-doped carbon for the electrocatalytic synthesis of hydrogen peroxide
[J].
Efficient in situ production of hydrogen peroxide using a novel stacked electrosynthesis reactor
[J].
Hydrogen peroxide generation from O2 electroreduction for environmental remediation:A state-of-the-art review
[J].
电解液对PAN基碳纤维电化学改性效果的影响
[J].
Effect of the electrolytes on the electrochemical treatment of the PAN-based carbon fibers
[J].
Highly efficient electro-generation of H2O2 by adjusting liquid-gas-solid three phase interfaces of porous carbonaceous cathode during oxygen reduction reaction
[J].
钛盐光度法测定Fenton体系中过氧化氢浓度的试验研究
[J].
Experimental study on the determination of hydrogen peroxide concentration in Fenton system by titanium salt spectrophotometry
[J].
4-氨基安替比林分光光度法测定水中的挥发酚
[J].
Determination of volatile phenols calibration curve’s slope and intercept by using 4-aminobirin spectrophotometry
[J].
IrO2/Ti-Fe电极电化学降解四氯化碳的研究
[J].
Electrochemical degradation of carbon tetrachloride using IrO2/Ti-Fe electrode
[J].
The UV/H2O2 process based on H2O2 in situ generation for water disinfection
[J].
UV/H2O2高级氧化降解水中GSM和2-MIB试验研究
[D].
Experimental study on oxidative degradation of GSM and 2-MIB by UV/H2O2
[D].
Electrochemistry:As cause and cure in water pollution—An overview
[J].
Hydrogen peroxide production in the oxygen reduction reaction at different electrocatalysts as quantified by scanning electrochemical microscopy
[J].
Drastic enhancement of H2O2 electro-generation by pulsed current for ibuprofen degradation:Strategy based on decoupling study on H2O2 decomposition pathways
[J].
Synergistic degradation of phenols by bimetallic CuO-Co3O4@γ-Al2O3 catalyst in H2O2/HCO3 - system
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号