社会工业化进程中,大量工业废水未经处理直接排入自然水体造成严重污染,威胁生态环境的正常运行和人类健康〔1〕。工业废水中的Pb(Ⅱ)、Hg(Ⅱ)、Cd(Ⅱ)和Cr(Ⅵ)等重金属离子可在生物体内累积并对人体造成伤害,因此被列为废水排放标准中需严格控制的第一类污染物〔2〕。Pb(Ⅱ)具有较强的环境毒性,并且可经皮肤、呼吸系统和消化道进入人体,对人体的神经系统、造血系统以及肾脏功能等造成损伤〔3〕。Hg(Ⅱ)在冶金、电子等行业被广泛应用,具有较强的生物毒性,可在生物体内累积并可通过食物链实现生物放大,被美国环保署列为13种已知对人类健康和生态功能产生负面影响的污染物之一〔4〕。Cd(Ⅱ)作为被美国环保署列为可能的致癌物质,会对人体的肾脏造成不可逆的危害,影响人体内酶的活性,导致血压升高〔5〕。环境中Cr的存在形式主要有Cr(Ⅲ)和Cr(Ⅵ),Cr(Ⅵ)在环境中的溶解度、流动性较强,毒性要远大于Cr(Ⅲ),具有致癌和致畸性,对动植物和生物体形成长期危害〔6〕。
1 实验部分
1.1 材料与仪器
实验所用给水厂污泥取自北京某大型水厂,该厂处理流程在常规絮凝沉淀的基础上,增加了活性炭吸附深度处理单元。将脱水后自然风干的污泥置于温度恒为105 ℃的烘箱中烘6.0 h。利用钢筛筛选出不同粒径(2.0~5.0 mm、1.0~2.0 mm、<0.125 mm)的污泥。利用Pb(NO3)2、HgCl2、CdCl2·5/2H2O、K2Cr2O7配制质量浓度为1 000 mg/L的金属离子标准储备液。
实验仪器:X射线荧光光谱仪(XRF,ZSX PrimusⅡ,日本 Rigaku理学公司);光电子能谱分析仪(ESCALAB 250Xi,Thermo Fisher公司);电感耦合等离子体发射仪(iCAP-7200);水浴恒温震荡器(THZ-82);电热鼓风干燥箱(101A-2)。
1.2 实验方法
1.2.1 pH影响
在二元和三元体系下探究以上4种重金属离子的竞争吸附,重铬酸钾和硝酸铅的混合体系中会出现沉淀现象,因此不进行Cr(Ⅵ)和Pb(Ⅱ)共存下的吸附竞争模拟实验。
利用标准储备液配制100 mL质量浓度均为100 mg/L的Pb(Ⅱ)、Hg(Ⅱ)、Cr(Ⅵ)和Cd(Ⅱ)的二元重金属离子混合溶液〔Pb(Ⅱ)-Hg(Ⅱ)、Cr(Ⅵ)-Hg(Ⅱ)、Pb(Ⅱ)-Cd(Ⅱ)〕置于250 mL锥形瓶中,利用电子天平称取0.2 g粒径为1.0~2.0 mm的WTR投入配制的二元混合溶液中。采用0.1 mol/L盐酸和0.1 mol/L氢氧化钠溶液调节溶液pH分别为2.0、3.0、4.0、5.0、6.0、7.0,在25 ℃的恒温水浴振荡器中以130 r/min的转速振荡48 h。间隔相同时间取一次上清液,经0.45 μm的微膜过滤后检测计算重金属离子的吸附量。由Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)- Cd(Ⅱ)组成的三元体系的实验方法同上。
1.2.2 时间影响
利用标准储备液配制100 mL质量浓度均为100 mg/L的Pb(Ⅱ)-Hg(Ⅱ)、Cr(Ⅵ)-Hg(Ⅱ)、Pb(Ⅱ)-Cd(Ⅱ)的二元重金属离子混合溶液置于250 mL锥形瓶中,利用电子天平称取0.2 g粒径为1.0~2.0 mm的WTR投入配制的二元混合溶液中。采用0.1 mol/L的盐酸和0.1 mol/L氢氧化钠调整溶液pH为5.0,在25 ℃的恒温水浴振荡器中以130 r/min的转速振荡48 h。间隔相同时间取一次上清液,经0.45 μm的微膜过滤后检测计算重金属离子的吸附量。由Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)组成的三元体系的实验方法同上。
1.2.3 投加量影响
利用标准储备液于250 mL锥形瓶中配制100 mL Pb(Ⅱ)、Hg(Ⅱ)、Cd(Ⅱ)质量浓度均为100 mg/L的三元重金属离子混合液,利用电子天平分别称取0.1、0.2、0.3、0.4 g给水厂污泥投入混合体系。采用0.1 mol/L的盐酸和0.1 mol/L氢氧化钠调整溶液pH为5.0,在25 ℃的恒温水浴振荡器中以130 r/min的转速振荡48 h。间隔相同时间取一次上清液,经0.45 μm的微膜过滤后检测计算重金属离子的吸附量和去除率。Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系的实验方法同上。
2 结果与讨论
2.1 给水厂污泥的元素质量分数分析
采用X射线荧光光谱仪(XRF)测量污泥各元素的质量分数,结果见表1。
表1 给水厂污泥成分分析
Table 1
| 元素 | C | Al | Si | Fe | N | Ca | S | O | Mg | Na | Cl | K |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 质量分数/% | 32.8 | 7.21 | 4.55 | 4.47 | 2.07 | 1.76 | 0.57 | 44.6 | 0.24 | 0.18 | 0.14 | 0.13 |
由表1可知,WTR中铝、铁的质量分数分别为7.21%和4.47%,这主要是由给水厂投加的混凝剂种类决定的,铁、铝盐混凝剂水解产物和胶体类颗粒沉淀后,主要是以羟基聚合铁、铝的形式存在。硅、钙主要来自于原水中携带的无机颗粒物,由于活性炭滤池反冲洗排泥水和沉淀池排泥一起脱水处理,因此给水厂污泥中碳的质量分数相对较高(质量分数为32.8%)。
使用电子天平称取20.0 g粒径<0.125 mm的WTR于锥形瓶中,并加入50 mL去离子水,得到泥水比为1∶2.5的混合液。利用pH计测得混合液的pH为7.25,呈弱碱性。
2.2 pH对WTR处理多元重金属系统的影响
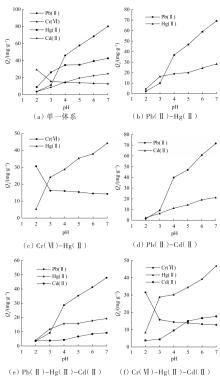
在pH为2.0~7.0的条件下,WTR对单一系统中4种重金属的吸附量变化以及对Pb(Ⅱ)-Hg(Ⅱ)、Cr(Ⅵ)- Hg(Ⅱ)、Pb(Ⅱ)-Cd(Ⅱ)、Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)等多元体系中重金属的吸附量趋势变化见图1。
图1
图1
pH对给水厂污泥处理多元重金属体系的影响
Fig. 1
The influence of pH on the treatment system of multiple heavy metals by WTR
二元体系中重金属的竞争吸附趋势分别如图1(b)、1(c)、1(d)所示,通过与图1(a)单一体系进行对比分析发现,在pH为2.0~7.0的实验条件下,各重金属在二元体系中的吸附量趋势变化与单一体系中的相似。Pb(Ⅱ)、Hg(Ⅱ)和Cd(Ⅱ)的吸附量随pH的升高而增加,而Cr(Ⅵ)的吸附量则与之相反。在Pb(Ⅱ)-Hg(Ⅱ)二元体系中,WTR对Pb(Ⅱ)和Hg(Ⅱ)的吸附量均小于单一体系的吸附量,当pH=5.0时的单一体系中WTR对Pb(Ⅱ)、Hg(Ⅱ)的吸附量分别为57.71、35.03 mg/g,而在二元体系中吸附量各下降了18.87%和42.68%,说明Pb(Ⅱ)和Hg(Ⅱ)处于同一体系时存在竞争吸附;当pH<3.0时,Hg(Ⅱ)的竞争能力强于Pb(Ⅱ),随着pH的逐渐增大,WTR对Pb(Ⅱ)的吸附量发生显著变化,超过其对Hg(Ⅱ)的吸附。Cr(Ⅵ)-Hg(Ⅱ)体系中,Cr(Ⅵ)的吸附量变化趋势与单一体系中的相似,吸附量随pH的增大而减小,但较单一体系中的吸附量均出现不同程度的增加;Hg(Ⅱ)无明显变化。在Pb(Ⅱ)- Cd(Ⅱ)体系中,WTR对Cd(Ⅱ)吸附量远低于Pb(Ⅱ),说明WTR与Pb(Ⅱ)的亲和性较强;但Pb(Ⅱ)和Cd(Ⅱ)的吸附量相较于单一体系均呈现下降的趋势。
不同pH条件下WTR在Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系中对各重金属吸附量的趋势变化如图1(e)和图1(f)所示。Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)体系中3种重金属的吸附量随pH的升高而增加,当溶液pH较大时,混合阳离子氢氧化物的生成速率将随着pH的升高而加快,因此pH较大时金属阳离子的去除率较高〔20〕。相较于单一体系,该体系中Pb(Ⅱ)、Hg(Ⅱ)、Cd(Ⅱ)3种重金属离子的吸附量均下降,分别下降了40.41%、54.61%、64.48%,说明这3种重金属离子间存在较强的竞争。Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系中,Hg(Ⅱ)和Cd(Ⅱ)对Cr(Ⅵ)的吸附没有产生实质性的影响。给水厂污泥对Hg(Ⅱ)和Cd(Ⅱ)的去除率在低pH环境中较低,并随着pH的增大而逐渐增大。对比图1(e)和1(f)可以发现WTR对重金属的去除受竞争的影响。低pH时,溶液中的H+将与重金属离子强烈竞争吸附位点,随着pH的增大,溶液中的H+对吸附位点的竞争性减弱,同时表面功能的质子化程度降低,因此对重金属离子的吸附量增大〔21〕,重金属离子在碱性条件下会发生沉淀〔22〕。
2.3 时间对WTR处理多元重金属系统的影响
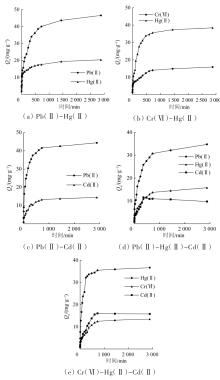
WTR对多元体系中各重金属离子的吸附量随时间的变化趋势见图2。
图2
图2
时间对给水厂污泥处理多元重金属体系的影响
Fig. 2
The influence of time on the treatment system of multiple heavy metals by WTR
图2(a)为Pb(Ⅱ)-Hg(Ⅱ)体系中Pb(Ⅱ)和Hg(Ⅱ)吸附量随时间变化的情况,该混合体系中的两种重金属离子的吸附量随时间的增加而增加,相比于单一体系,Hg(Ⅱ)的平衡吸附量明显降低,说明Pb(Ⅱ)对Hg(Ⅱ)的最大吸附量影响较大,二者存在竞争吸附机制。Hg(Ⅱ)在240 min时的吸附量为15.96 mg/g,为最大吸附量的80%,而480 min时Pb(Ⅱ)的吸附量为36.13 mg/g,为最大吸附量的77%,之后反应速率逐渐降低至平衡状态。在Cr(Ⅵ)-Hg(Ⅱ)体系中〔图2(b)〕,Cr(Ⅵ)和Hg(Ⅱ)的平衡吸附量较单一体系都有所增加,说明Cr(Ⅵ)和Hg(Ⅱ)存在协同吸附机制,在pH=5.0的条件下,给水厂污泥表面呈正电性(本实验给水厂污泥等电点pHzpc=8.3),Cr(Ⅵ)主要以HCrO4-和Cr2O72-形式存在,通过静电引力与WTR结合使得WTR表面正电性减弱,同时HCrO4-、Cr2O72-与铝污泥表面的羟基(—OH)发生配位交换形成更稳定的结构,释放出OH-使溶液pH升高,从图1(a)可以看出,pH升高,Hg2+吸附量增加。WTR吸附Hg2+后使其正电性更强,通过静电引力的作用促进了HCrO4-和Cr2O72-的进一步吸附,因而Cr(Ⅵ)和Hg(Ⅱ)的吸附具有协同作用,Cr(Ⅵ)的饱和吸附量为15.35 mg/g,并在600 min时的吸附量达到饱和吸附量的85%左右;Hg(Ⅱ)的饱和吸附量为35.29 mg/g,并在300 min时达到饱和吸附量的80%左右。Pb(Ⅱ)-Cd(Ⅱ)混合体系中〔图2(c)〕Pb(Ⅱ)和Cd(Ⅱ)两种重金属离子呈竞争状态,Pb(Ⅱ)对Cd(Ⅱ)的吸附量的影响较大。由图2(a)~2(c)可知,WTR对Pb(Ⅱ)、Cr(Ⅵ)、Hg(Ⅱ)和Cd(Ⅱ)的吸附速率Hg(Ⅱ)>Pb(Ⅱ)>Cd(Ⅱ)>Cr(Ⅵ);吸附能力Pb(Ⅱ)>Hg(Ⅱ)>Cd(Ⅱ)>Cr(Ⅵ)。
图2(d)和2(e)分别为随着时间变化WTR在三元体系Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)- Cd(Ⅱ)的混合溶液中对各重金属离子的吸附变化趋势图。在Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)体系中,WTR对Pb(Ⅱ)、Hg(Ⅱ)和Cd(Ⅱ)3种重金属离子的吸附速率在前360 min较快,而360 min后Cd(Ⅱ)的吸附量出现下降现象,这是因为被吸附的Cd(Ⅱ)出现脱附现象重新进入体系。反应初期WTR上的吸附位点较多,并且重金属离子的浓度也较高,WTR和重金属离子的吸附不存在选择性,随着反应的进行,吸附位点不断减少直至饱和,这时由于结合能力不同,溶液中剩余的Pb(Ⅱ)、Hg(Ⅱ)将取代吸附在WTR上的Cd(Ⅱ)。在Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系中,Cr(Ⅵ)和Cd(Ⅱ)的吸附量较单一体系相近,Hg(Ⅱ)在240 min后进入平衡状态,其最大吸附量为36.59 mg/g;Cr(Ⅵ)于720 min后进入平衡状态,其最大吸附量为13.51 mg/g,出现这个现象的原因可能是主导WTR吸附这3种重金属离子的作用力不同,其中Hg(Ⅱ)和Cd(Ⅱ)主要是以和WTR形成金属络合物的形式,而Cr(Ⅵ)的吸附是靠静电-还原作用完成的。
2.4 WTR投加量对多元重金属系统重金属去除率的影响
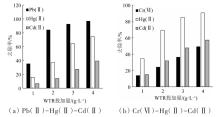
WTR投加量对多元体系〔Pb(Ⅱ)-Hg(Ⅱ)- Cd(Ⅱ)和Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)〕中重金属离子去除率的影响见图3。
图3
图3
多元系统中WTR投加量对重金属去除率的影响
Fig.3
The removal rate of heavy metals with different dosage in a multi-component system
由图3可知,重金属离子的去除率与WTR投加量呈正相关,增加投加量可提高竞争力弱的金属离子的去除率。在Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)体系中,当WTR的投加量提高到3.0 g/L时,Pb(Ⅱ)的去除率超过90%,继续提高吸附剂投加量对提高Pb(Ⅱ)的去除率无明显作用,但Hg(Ⅱ)和Cd(Ⅱ)的去除率仍不断增加,导致出现这种情况的原因可能是在吸附剂量较少时,由于Pb(Ⅱ)的竞争能力较强,首先被吸附,随着投加量的不断增加,体系中Pb(Ⅱ)含量降低,可用吸附位点增加,这时竞争能力相对较弱的Hg(Ⅱ)和Cd(Ⅱ)被吸附,从而使这两种重金属离子的去除率随WTR投加量的增加明显增加。在Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系中出现相似的情况,其中Hg(Ⅱ)为竞争能力较强的离子。
2.5 给水厂污泥对多元重金属的吸附特征及机理
分配系数(Kd)可作为金属潜在迁移率的研究指标,其计算公式如
式中: C0——溶液初始质量浓度,mg/L;
V——溶液体积,L;
m——吸附剂的质量,g;
Ce——溶液平衡质量浓度,mg/L。
本实验的分配系数采用初始质量浓度为100 mg/L的重金属离子表征,记作Kd100,不同体系中重金属离子的分配系数见表2。
表2 不同体系中重金属离子的分配系数
Table 2
| 体系 | Kd100 /(L·g-1) | ||||
|---|---|---|---|---|---|
| Pb(Ⅱ) | Cr(Ⅵ) | Hg(Ⅱ) | Cd(Ⅱ) | ||
| 单一 | 1.34 | 0.18 | 0.53 | 0.21 | |
| 二元 | Pb(Ⅱ)-Hg(Ⅱ) | 0.85 | — | 0.23 | — |
| Cr(Ⅵ)-Hg(Ⅱ) | — | 0.15 | 0.56 | — | |
| Pb(Ⅱ)-Cd(Ⅱ) | 0.87 | — | — | 0.16 | |
| 三元 | Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ) | 0.52 | — | 0.21 | 0.05 |
| Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ) | — | 0.17 | 0.51 | 0.15 | |
由表2可知,Pb(Ⅱ)-Hg(Ⅱ)二元体系中Pb(Ⅱ)和Hg(Ⅱ)的Kd100相较于单一体系分别降低了36.6%和56.6%;Pb(Ⅱ)-Cd(Ⅱ)二元体系中Pb(Ⅱ)和Cd(Ⅱ)的Kd100相较于单一体系分别降低了35.1%和23.8%,说明Pb(Ⅱ)、Hg(Ⅱ)和Cd(Ⅱ)共存时能够产生吸附竞争。Pb(Ⅱ)-Hg(Ⅱ)-Cd(Ⅱ)体系中Pb(Ⅱ)、Hg(Ⅱ)和Cd(Ⅱ)的Kd100相较于单一体系分别降低了61.2%、60.4%和76.2%,说明该混合体系中3种重金属离子之间发生吸附竞争,其中Pb(Ⅱ)的竞争能力最强,Cd(Ⅱ)的竞争能力最弱。Cr(Ⅵ)-Hg(Ⅱ)-Cd(Ⅱ)体系中,Cr(Ⅵ)和Hg(Ⅱ)的吸附几乎不受影响,Cd(Ⅱ)的Kd100相较于单一体系下降了28.6%。出现上述现象主要是因为Pb(Ⅱ)、Hg(Ⅱ)和Cd(Ⅱ)是在WTR表面形成络合物或产生共价键的形式完成吸附,而Cr(Ⅵ)在体系中的存在形式为阴离子,能够与WTR表面的正电荷通过静电吸附还原从而完成吸附。根据多元体系中的实验结果,重金属的吸附竞争能力与单一体系中的一致,说明影响竞争吸附的因素主要是重金属离子本身的性质。
实验所采用的4种重金属离子的基本性质见表3。
表3 4种重金属离子的基本物化性质
Table 3
| 重金属离子 | Pb(Ⅱ) | Hg(Ⅱ) | Cd(Ⅱ) | Cr(Ⅵ) |
|---|---|---|---|---|
| 相对原子质量 | 207.20 | 200.60 | 112.40 | 51.99 |
| 水解常数负对数pKH | 7.71 | 5.90 | 10.10 | 3.90 |
| 水合半径/nm | 0.401 | 0.421 | 0.426 | 0.43 |
| 电负性 | 2.33 | 2.00 | 1.69 | 1.66 |
| 离子半径/pm | 119 | 102 | 95 | 44 |
固体颗粒的吸附竞争力与离子半径呈正相关〔23〕,Cd(Ⅱ)、Hg(Ⅱ)、Pb(Ⅱ)的离子半径分别为95、102、119 pm,并且这3种离子具有相同的价态,因此理论吸附顺序为Cd(Ⅱ)<Hg(Ⅱ)<Pb(Ⅱ)。Cd(Ⅱ)、Hg(Ⅱ)、Pb(Ⅱ)的水合离子半径分别为0.426、0.421、0.401 nm,由于吸附竞争力与水合半径呈负相关,因此WTR与Pb(Ⅱ)的吸附亲和力较强。除离子半径和离子水合半径外,电负性也是决定重金属离子与WTR之间竞争吸附性强弱的重要因素,Cr(Ⅵ)、Cd(Ⅱ)、Hg(Ⅱ)、Pb(Ⅱ)的电负性分别为1.66、1.69、2.00、2.33,因此WTR与Pb(Ⅱ)更容易形成化学键,其表面的含氧官能团对Pb(Ⅱ)吸附亲和力最好〔24〕。实验结果表明,当重金属离子的相对原子质量高、离子半径大、电负性强和水合半径小时,重金属离子和WTR上含氧官能团的亲和能力更强,更有利于在WTR表面形成络合物以加强吸附。
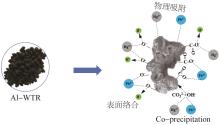
WTR与Pb(Ⅱ)、Hg(Ⅱ)之间的吸附机理示意图如图4所示。WTR作为吸附剂时可以通过其多孔结构使Hg(Ⅱ)产生内扩散作用或与Pb(Ⅱ)、Hg(Ⅱ)之间产生范德华力从而实现物理吸附;重金属离子也可通过与体系中的CO32-和OH-形成稳定物质的间接作用或通过与WTR表面的含氧官能团发生络合反应实现吸附。
图4
3 结论
(1)不同pH下,Pb(Ⅱ)、Hg(Ⅱ)、Cr(Ⅵ)、Cd(Ⅱ) 4种重金属离子在多元体系中的吸附量趋势与单一体系相似,当Pb(Ⅱ)和Hg(Ⅱ)或Cd(Ⅱ)存在于同一体系时会出现相互抑制现象,Hg(Ⅱ)和Cr(Ⅵ)处于同一体系时能够相互促进,上述现象与重金属离子在溶液中的吸附机制和存在形式相关;Hg(Ⅱ)在反应初期能够迅速被吸附,因此其达到平衡的时间要远小于其他3种重金属离子;在三元体系中,重金属离子的去除率随WTR投加量的增加而提高,可以通过提高WTR的投加量来提高竞争较弱的重金属离子的去除率。
(2)WTR与Pb(Ⅱ)、Hg(Ⅱ)、Cr(Ⅵ)、Cd(Ⅱ) 4种重金属离子的亲和力不同,从而导致出现吸附顺序不同〔Pb(Ⅱ)>Hg(Ⅱ)>Cd(Ⅱ)>Cr(Ⅵ)〕,但其与单一体系中的吸附顺序一致,说明重金属离子自身的相对原子质量、水解常数、电负性和离子半径等可影响吸附顺序。其中电负性、离子半径、相对原子质量和水解常数较大的重金属离子更易被WTR吸附。
(3)WTR作为吸附剂时可以通过其多孔结构使Hg(Ⅱ)产生内扩散作用或与Pb(Ⅱ)、Hg(Ⅱ)之间产生范德华力从而实现物理吸附;重金属离子也可通过与体系中的CO32-和OH-形成稳定物质的间接作用或通过与WTR表面的含氧官能团发生络合反应实现吸附。Cr(Ⅵ)在体系中以阴离子存在与WTR表面所带正电荷的电性相反,使得其在混合体系中的吸附量不受其他离子的影响,Pb(Ⅱ)、Hg(Ⅱ)、Cd(Ⅱ)与WTR间的亲和力受水解常数和电负性影响,Pb(Ⅱ)能够在WTR表面形成更加稳定的络合物。
参考文献
Fast microwave-assisted preparation of a low-cost and recyclable carboxyl modified lignocellulose-biomass jute fiber for enhanced heavy metal removal from water
[J].
Effective utilization of iron ore slime,a mining waste as adsorbent for removal of Pb(Ⅱ) and Hg(Ⅱ)
[J].
Synthesis and micro-mechanistic studies of histidine modified montmorillonite for lead(Ⅱ) and copper(Ⅱ) adsorption from wastewater
[J].
Adsorption of mercury ions from synthetic aqueous solution using polydopamine decorated SWCNTs
[J].
Sorption of cadmium(Ⅱ) and zinc(Ⅱ) from aqueous solution by water treatment residuals at different pHs
[J].
Removal and reduction of Cr(Ⅵ) in simulated wastewater using magnetic biochar prepared by co-pyrolysis of nano-zero-valent iron and sewage sludge
[J].
Release behavior of heavy metals during treatment of dredged sediment by microwave-assisted hydrogen peroxide oxidation
[J].
The facile synthesis of zoledronate functionalized hydroxyapatite amorphous hybrid nanobiomaterial and its excellent removal performance on Pb2+ and Cu2+
[J].
Optimizing the preparation parameters of mesoporous nanocrystalline titania and its photocatalytic activity in water:Physical properties and growth mechanisms
[J].
Removal of Pb(Ⅱ),Cr(Ⅲ) and Cr(Ⅵ) from aqueous solutions using alum-derived water treatment sludge
[J].
Novel polyvinylidene fluoride nanofiltration membrane blended with functionalized halloysite nanotubes for dye and heavy metal ions removal
[J].
Purification and reuse of heavy metals containing wastewaters from electroplating plants
[J].
Removal of heavy metal〔Hg(Ⅱ) and Cr(Ⅵ)〕 ions from aqueous solutions using Fe2O3@SiO2 thin films as a novel adsorbent
[J].
Adsorption of myo-inositol hexakisphosphate in water using recycled water treatment residual
[J].
X-ray absorption spectroscopy as a tool investigating arsenic(Ⅲ) and arsenic(Ⅴ) sorption by an aluminum-based drinking-water treatment residual
[J].
净水厂干化铝污泥对水中Pb2+和Cu2+的吸附研究
[J].
Adsorption of Pb2+ and Cu2+ in water by dried alum-sludge from a water treatment plant
[J].
Aluminum drinking water treatment residuals(Al-WTRs) as sorbent for mercury:Implications for soil remediation
[J].
Evaluating a drinking-water waste by-product as a novel sorbent for arsenic
[J].
Effect of particle size of drinking-water treatment residuals on the sorption of arsenic in the presence of competing ions
[J].
Reaction condition effects on nickel sorption mechanisms in illite-water suspensions
[J].
Enhanced removal of Cd(Ⅱ) and Pb(Ⅱ) by composites of mesoporous carbon stabilized alumina
[J].
A comparison of the properties of natural clinoptilolites and their ion-exchange capacities for silver removal
[J].
Cu2+、Cd2+、Zn2+在高炉水淬渣上的竞争吸附特性
[J].
Competitive adsorption characteristics of water-quenched blast furnace slag(WBFS) towards Cu2+,Cd2+ and Zn2+
[J].
Selective removal of copper and lead ions by diethylenetriamine-functionalized adsorbent:Behaviors and mechanisms
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号