随着社会的快速发展,复杂有机污染物排放量急剧增加,且呈现出高毒性、高危害和难降解的趋势,对人体健康、经济发展和生态安全带来的危害不容忽视,研究开发一种高效实用的有机污染物处理技术意义重大〔1〕。过氧乙酸高级氧化技术(PAA-AOPs)是一种符合要求的新兴水处理技术。
PAA是小分子有机物,由C、H、O等元素组成,在使用过程中不会产生元素污染,符合我国目前大力倡导的环境友好的价值导向〔5〕。此外,PAA做AOPs的氧化剂比H2O2更有优势〔6〕。作为一种类似H2O2的过氧化物,PAA的最低空分子轨道能(-0.25 eV)低于H2O2(0.57 eV),且PAA的过氧键键能(159.1 kJ/mol)远低于H2O2(213.5 kJ/mol),这些都表明PAA更容易被活化〔7-8〕。据J. HOLLMAN等〔7〕报道,氧化剂质量浓度都为50 mg/L时,UV/PAA体系降解文拉法辛(VEN)、卡马西平(CBZ)、氟西汀(FLU)比UV/H2O2体系分别快55%、75%、33%。
1 PAA-AOPs反应机理
PAA-AOPs即通过外加能量或添加催化剂的方式使PAA反应,生成因含有未成对电子而极易发生反应的自由基和单线态氧(1O2)等活性物质,这些活性物质进而与目标污染物中的特定结构反应使其降解的水处理技术。本综述将对PAA-AOPs的反应机理、研究现状和独特性质进行总结与分析,并整理了不同PAA活化方式的优点和缺点。
1.1 活化机理
目前研究最多的活化方式有光照活化、过渡金属活化和碳质材料活化三种〔10〕。
1.1.1 光照活化
图1
1.1.2 过渡金属活化
Co〔8〕、Fe〔15〕、Mn〔16〕和Cu〔12〕等过渡金属易得失电子,可作为催化剂活化PAA。据J. KIM等〔6〕报道,Fe(Ⅱ)/PAA体系在120 min内可以完全降解亚甲基蓝(MBA)、萘普生(NAP)和双酚A(BPA)等有机污染物。Co是加速PAA分解的高效催化剂,与Fe、Mn和Cu等其他过渡金属相比,其效率更高〔4〕。但有研究发现,Co2+和Cu2+会引起人体健康问题,相比之下,Fe2+和Mn2+更为绿色环保〔17-18〕。过渡金属催化剂可分为均相催化剂〔8〕和非均相催化剂〔19〕。过渡金属非均相催化剂主要包括各类过渡金属的氧化物,其活化PAA具有反应条件易达到和催化剂易回收等特点〔19〕。相比之下,主要包括各类过渡金属离子的过渡金属均相催化剂则存在易金属浸出引起二次污染的缺点〔19-20〕。但在同等物质的量的情况下,金属均相催化剂对过氧化物的活化效果更好〔17〕。笔者以过渡金属离子活化PAA为例(以M表示过渡金属),介绍活化过程中的主要反应。如图2所示,M n+与M(n+1)+可在体系内部自循环转换,符合绿色循环发展理念〔8,19〕。过渡金属离子/PAA体系中关于活化的主要反应如
图2
图2
过渡金属离子/PAA体系反应机理
Fig. 2
Reaction mechanism of transition metal ion/PAA system
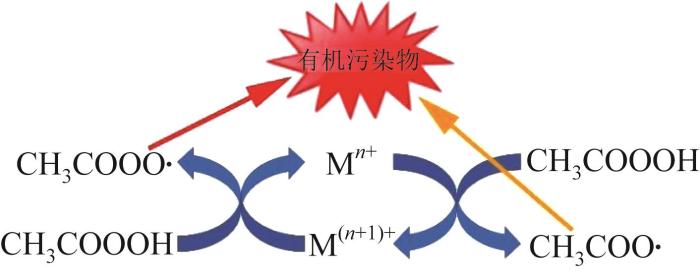
1.1.3 碳质材料活化
图3
图3
碳质材料/PAA体系反应机理
Fig. 3
Reaction mechanism of carbonaceous material/PAA system
综上,笔者对活化机理的分析主要集中于不同活化方式在活化PAA过程中表现出的特点,比较结果见表1。
表1 不同类型PAA-AOPs优缺点比较
Table 1
1.2 降解机理
1.2.1 优势活性物质
表2 不同类型PAA-AOP的优势活性物质
Table 2
| 活化方式 | 体系 | 有机污染物 | 优势活性物质种类 | 去除率/% |
|---|---|---|---|---|
| 光照 | UV/PAA〔11〕 | NAP | ·OH和R—C· | 94 |
| UV/PAA〔24〕 | 氯酚同类物质 | ·OH | 100 | |
| UV/PAA〔25〕 | 双氯芬酸(DCF) | ·OH和R—C· | 80 | |
| 过渡金属 | Co(Ⅱ)/PAA〔4〕 | SMX | CH3COO·和CH3COOO· | 89.4 |
| Co(Ⅱ)/PAA〔8〕 | BPA | CH3COOO· | 100 | |
| Co(Ⅱ)/PAA〔8〕 | NAP | CH3COOO· | 100 | |
| Co(Ⅱ)/PAA〔8〕 | SMX | CH3COOO· | 98.5 | |
| Fe(Ⅱ)/PAA〔6〕 | MBA | ·OH、R—C·和Fe(Ⅳ) | 90 | |
| Mn(Ⅱ)/PAA〔16〕 | 橙黄Ⅱ | ·OH和CH3COOO· | 100 | |
| 碳质材料 | ACFs/PAA〔22〕 | 活性艳红X-3B | R—C·和·OH | 97 |
| N-Rgo/PAA〔29〕 | SMX | CH3COO·和CH3COOO· | 96 | |
| 碳纳米管/PAA〔23〕 | 金橙G | ·OH | 90 |
除·OH和R—C·外,PAA-AOPs产生的·O2-和1O2都有可能是优势活性物质,但目前关于PAA-AOPs的研究仍然较少,暂未发现·O2-和1O2是优势活性物种的研究,与PAA-AOPs相似的过硫酸盐高级氧化技术(PS-AOPs)有发现1O2是优势活性物质的研究〔34〕,可加强PAA-AOPs此方面的研究。
1.2.2 易反应结构和具体反应路径
活性物质主要通过与目标污染物中某些特定结构反应使目标污染物降解成毒性更小、更容易降解的小分子有机物,或完全矿化成CO2和H2O〔4,19〕。与其他AOPs相比,PAA-AOPs更倾向于降解含有偶氮键或萘环结构的有机污染物,其主要原因是PAA-AOPs中特有的R—C·更易与偶氮键和萘环结构反应〔11,19〕。在面对含有偶氮键或萘环结构的有机污染物时,可优先选用PAA-AOPs。田丹等〔27〕发现,Co(Ⅱ)/PAA体系中自由基主要与酸性橙(AO7)的偶氮键和萘环结构反应使AO7降解;据Wei WU等〔19〕报道,Co3O4/PAA体系中的活性物质主要与金橙G(OG)的偶氮键和萘环结构反应使OG发生降解。
2 PAA-AOPs的主要影响因素
PAA-AOPs的主要影响因素包括pH、PAA浓度、无机阴离子和天然有机质(NOM)等。为了优化PAA-AOPs,必须对这些影响因素进行深入研究,笔者将以这四个主要影响因素为重点进行讨论分析。
2.1 pH
表3 不同类型PAA-AOPs的pH相关分析
Table 3
但是PAA-在254 nm处具有比PAA0更高的摩尔吸光系数〔24,26〕,导致UV/PAA体系降解目标污染物的最佳pH偏碱性〔36-37〕。而OH-与·OH的二级反应速率常数是1.2×1010 L/(mol·s),因此OH-浓度高的强碱性条件也不利于目标污染物的降解〔12〕。综上所述,弱碱性环境最适于UV/PAA体系降解目标污染物。据Li ZHANG等〔25〕报道,Cu2+强化UV/PAA体系降解DCF的最佳pH为8.5;M. MUKHOPADHYAY等〔35〕发现,在pH为9.5的环境下,UV/PAA体系对对氯苯酚(4-CP)的降解效果最好;Tianqi ZHANG等〔26〕构建了反应动力学模型,发现pH为8.0时,PAA被活化分解的效果最好。
2.2 PAA浓度
将PAA-AOPs应用于实际生产中必须研究PAA浓度对降解效果的影响。PAA浓度的升高会使目标污染物的降解率随之升高,这主要归因于自由基的生成速率和积累浓度随体系中PAA浓度的升高而升高〔8,38〕。J. KIM等〔8〕发现,将PAA浓度从20 μmol/L升高到200 μmol/L,CBZ在Co(Ⅱ)/PAA体系中的降解率从22%升高到90%。然而,自由基的大量产生可能会导致自由基的自猝灭,且高浓度的PAA不仅会吸收紫外光还会与污染物竞争·OH反应〔kPAA/·OH=(9.33±0.3)×108 L(mol·s)〕〔4,25,39〕。因此,升高体系中PAA浓度至过量的水平,目标污染物的降解率先快速升高后缓慢升高,甚至会出现降低的现象〔6,22,25,28,33,40〕。张李等〔12〕发现,将PAA浓度从10 μmol/L升高到200 μmol/L,Cu2+/UV/PAA体系降解DCF的降解速率常数(kobs)在10~100 μmol/L范围内增长较快,从0.082 5 min-1增加到0.2 min-1,在100~200 μmol/L范围内增长较慢,仅从0.2 min-1增加到0.255 0 min-1。
2.3 无机阴离子
无机阴离子广泛存在于天然水体中,对PAA-AOPs影响较大的无机阴离子包括Cl-、CO32-和NO3-等。笔者将以这些阴离子对PAA-AOPs的影响为重点进行总结和分析。
2.3.1 Cl-
含氯活性物质对不同种类污染物的敏感性不同〔10〕。因此,Cl-对降解的影响也取决于目标污染物的种类。田丹等〔27〕发现Cl-的存在(0~500 mmol/L)不利于AO7的降解;F. GHANBARI等〔33〕在降解ACT的过程中发现0~10 mmol/L的低浓度Cl-对降解没有影响,10~20 mmol/L的高浓度Cl-对降解有轻微的抑制作用;Li ZHANG等〔25〕观测到0~10 mmol/L范围内Cl-的浓度变化对DCF降解效果的影响可忽略不计;而Fengya ZHOU等〔22〕在ACFs/PAA体系降解有机污染物的过程中发现,Cl-对降解有双重效果,0~100 mmol/L的低浓度Cl-会与活性自由基生成低活性的Cl2·-,对降解有抑制作用;100~300 mmol/L的高浓度Cl-可与PAA生成高活性的HOCl,对降解有促进作用。
2.3.2 CO32-
CO32-是·OH猝灭剂,对降解具有较强的负面作用〔8,42〕。Siao CHEN等〔42〕在UV/PAA体系降解NAP的实验中发现,将CO32-投加量从0增加到20 mmol/L, ·OH在降解反应中发挥的作用越来越小,k·OH,NAP由0.054 min-1降低到0.036 min-1。此外,Zongping WANG等〔4〕发现CO32-抑制降解的原因还可能是HCO3-的存在严重阻碍了PAA的分解。史鸿乐等〔38〕认为CO32-的引入提高了体系的pH,这也是不利于目标污染物降解的原因之一。J. KIM等〔8〕认为,CO32-有与Co2+络合的倾向,也不利于目标污染物的降解。与CO32-相关的主要反应如
2.3.3 NO3-
据文献〔9,12,33〕报道,NO3-对降解的影响不大,少部分的实验中有轻微促进作用或抑制作用。Zhenran WANG等〔9〕报道称,NO3-对Fe(Ⅱ)/PAA体系降解DCF的影响不大;F. GHANBARI等〔33〕在UVC-LED/Fe(Ⅱ)/PAA体系降解ACT的实验中发现0~10 mmol/L的低浓度NO3-对降解表现出轻微的抑制作用,其原因是生成的亚硝酸盐可以猝灭自由基,10~20 mmol/L的高浓度NO3-表现出中性作用;张李等〔12〕在Cu2+/UV/PAA体系和UV/PAA体系降解DCF的过程中发现NO3-的存在提高了对DCF的降解效率,并且NO3-浓度越高,促进效果越明显。
2.4 NOM
表4 共存组分对PAA-AOPs的影响
Table 4
3 总结与展望
首先综述了PAA-AOPs的反应机理、研究现状和特有性质。PAA-AOPs能原位产生·OH、R—C·、 ·O2-和1O2等高活性物质通过脱氢、羟基化、氧化、脱氯、脱羧等反应途径高效降解有机污染物,且更倾向于降解含有偶氮键或萘环结构的污染物。然后对pH、PAA浓度、无机阴离子(Cl-、CO32-、NO3-)和NOM等因素对PAA-AOPs的影响进行了概述。pH对光照活化〔25〕和碳质材料活化〔22〕的影响较小,对过渡金属活化〔4,6,16〕的影响较大;PAA浓度的不断升高会使目标污染物的降解率先快速升高后缓慢升高,甚至会出现降低的现象〔22,25〕;在无机阴离子方面,Cl-对降解的影响由多方面因素决定〔22〕,CO32-往往对降解有消极影响〔9〕,NO3-对降解的影响不大〔9〕;NOM成分复杂,对目标污染物的降解有很强的抑制作用〔42〕。
相比于传统AOPs,PAA-AOPs具有操作简单、成本低、反应条件要求宽松和毒副产物少等优势,潜力巨大。但是,PAA-AOPs仍然有很多问题有待解决,如PAA稳定性差以及内部机理研究不清等。基于目前的研究情况,笔者提出以下几点研究展望:
(1)开发增强PAA稳定性的方法。PAA稳定性差,自然条件下会缓慢分解〔45〕,这对于PAA-AOPs的实际应用是一个巨大的阻碍,有必要开发增强PAA稳定性的方法。
(2)加强碳质材料/PAA体系的研究。碳质材料/PAA体系相比于光照/PAA体系反应条件更容易实现,相比于过渡金属/PAA体系不会引入金属污染物,有很强的优越性。目前关于碳质材料活化PAA的研究并不多,加强碳质材料活化PAA的研究对于推动PAA-AOPs的发展意义重大。
(3)强化R—C·对目标污染物降解的动力学研究。R—C·在PAA-AOPs中发挥着重要的作用,目前关于R—C·对目标污染物降解的动力学研究十分有限〔30〕。深化此方面的研究有利于对PAA-AOPs作用机理的进一步了解。
参考文献
Zinc/iron mixed-metal MOF-74 derived magnetic carbon nanorods for the enhanced removal of organic pollutants from water
[J].
Peracids in water treatment:A critical review
[J].
Effect of low doses of biocides on the antimicrobial resistance and the biofilms of Cronobacter sakazakii and Yersinia enterocolitica
[J].
Application of cobalt/peracetic acid to degrade sulfamethoxazole at neutral condition:Efficiency and mechanisms
[J].
Peracetic acid enhanced electrochemical advanced oxidation for organic pollutant elimination
[J].
Advanced oxidation process with peracetic acid and Fe(Ⅱ) for contaminant degradation
[J].
Degradation of pharmaceutical mixtures in aqueous solutions using UV/peracetic acid process:Kinetics,degradation pathways and comparison with UV/H2O2
[J].
Cobalt/peracetic acid:Advanced oxidation of aromatic organic compounds by acetylperoxyl radicals
[J].
Degradation of diclofenac by Fe(Ⅱ)-activated peracetic acid
[J].
Peracetic acid-based advanced oxidation processes for decontamination and disinfection of water:A review
[J].
UV/peracetic acid for degradation of pharmaceuticals and reactive species evaluation
[J].
Cu2+强化UV活化过氧乙酸降解水中的双氯芬酸
[J].
Degradation of diclofenac in water by Cu2+ enhanced UV activation of peracetic acid
[J].
Antibiotic contaminated water treated by photo driven advanced oxidation processes:Ultraviolet/H2O2 vs ultraviolet/peracetic acid
[J].
Degradation of steroid estrogens by UV/peracetic acid:Influencing factors,free radical contribution and toxicity analysis
[J].
Effective degradation of sulfamethoxazole with Fe2+-zeolite/peracetic acid
[J].
Mechanistic studies on the oxidative degradation of Orange Ⅱ by peracetic acid catalyzed by simple manganese(Ⅱ) salts. Tuning the lifetime of the catalyst
[J].
橘皮废弃物生物炭制备及其活化过硫酸盐的机理研究
[D].
Preparation of biochar derived from tangerine wastes and its application for peroxymonosulfate activation
[D].
Novel nonradical oxidation of sulfonamide antibiotics with Co(Ⅱ)-doped g-C3N4-activated peracetic acid:Role of high-valent cobalt-oxo species
[J].
Degradation of organic compounds by peracetic acid activated with Co3O4:A novel advanced oxidation process and organic radical contribution
[J].
Ultrasound-assisted MnO2 catalyzed homolysis of peracetic acid for phenol degradation:The assessment of process chemistry and kinetics
[J].
Carbon-based metal-free catalysts for energy storage and environmental remediation
[J].
Activated carbon fibers as an effective metal-free catalyst for peracetic acid activation:Implications for the removal of organic pollutants
[J].
UV/peroxyacetic acid mediated chlorophenol congener degradation
[J].
Degradation kinetics and mechanism of diclofenac by UV/peracetic acid
[J].
Modeling the kinetics of UV/peracetic acid advanced oxidation process
[J].
Co(Ⅱ)活化过氧乙酸降解有机染料研究
[J].
Degradation of organic dyes with peracetic acid activated by Co(Ⅱ)
[J].
Applying a novel advanced oxidation process of activated peracetic acid by CoFe2O4 to efficiently degrade sulfamethoxazole
[J].
基于过氧化物的高级氧化体系降解水体中抗生素的研究
[D].
Degradation of antibiotics in water by advanced oxidation technologies based on the application of peroxide
[D].
Activation of peracetic acid with cobalt anchored on 2D sandwich-like MXenes(Co@MXenes) for organic contaminant degradation:High efficiency and contribution of acetylperoxyl radicals
[J].
Activation of peracetic acid with lanthanum cobaltite perovskite for sulfamethoxazole degradation under a neutral pH:The contribution of organic radicals
[J].
Acetaminophen degradation by hydroxyl and organic radicals in the peracetic acid-based advanced oxidation processes:Theoretical calculation and toxicity assessment
[J].
Acetaminophen degradation by a synergistic peracetic acid/UVC-LED/Fe(Ⅱ) advanced oxidation process:Kinetic assessment,process feasibility and mechanistic considerations
[J].
Degradation difference of ofloxacin and levofloxacin by UV/H2O2 and UV/PS(persulfate):Efficiency,factors and mechanism
[J].
Kinetic and mechanistic study of photochemical degradation of 4-chlorophenol using peroxy acetic acid(PAA)
[J].
Kinetic and mechanistic investigation into odorant haloanisoles degradation process by peracetic acid combined with UV irradiation
[J].
Tertiary treatment of urban wastewater by solar and UV-C driven advanced oxidation with peracetic acid:Effect on contaminants of emerging concern and antibiotic resistance
[J].
亚铁改性沸石活化过氧乙酸降解水中双氯芬酸的研究
[J].
Enhanced degradation of diclofenac by catalytic peracetic acid using Fe2+ modified zeolite
[J].
Probing the interphase “HO zone” originated by carbon nanotube during catalytic ozonation
[J].
Photochemical degradation of chlorophenol industry wastewater using peroxy acetic acid(PAA)
[J].
Peracetic acid oxidation of saline waters in the absence and presence of H2O2:Secondary oxidant and disinfection byproduct formation
[J].
Effects of water matrices on the degradation of naproxen by reactive radicals in the UV/peracetic acid process
[J].
Phototransformation of selected organophosphorus pesticides:Roles of hydroxyl and carbonate radicals
[J].
The role of reactive oxygen species and carbonate radical in oxcarbazepine degradation via UV,UV/H2O2:Kinetics,mechanisms and toxicity evaluation
[J].
Preparation of peracetic acid from hydrogen peroxide
[J].



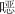 唑(SMX)、FLU和CBZ等药物,降解遵循准一级动力学模型,增强UV的强度会使准一级反应速率常数线性增加。UV的波长对活性物质的产率有显著影响,常用的波长为254 nm,可由紫外灯产生〔
唑(SMX)、FLU和CBZ等药物,降解遵循准一级动力学模型,增强UV的强度会使准一级反应速率常数线性增加。UV的波长对活性物质的产率有显著影响,常用的波长为254 nm,可由紫外灯产生〔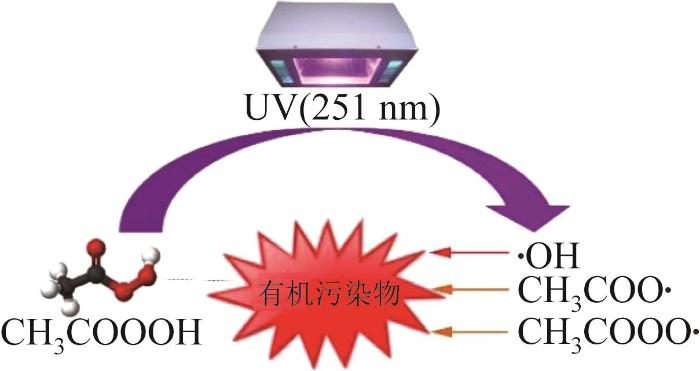


 津公网安备 12010602120337号
津公网安备 12010602120337号