天然沸石作为一种优良的吸附剂,已广泛用于污水净化领域,目前主要用来去除水体中有毒有害有机物〔1-2〕、重金属离子〔3-4〕以及含N(主要是NH4+和NO3-)和含P(主要是PO3-)等富营养化物质〔5-6〕。大量研究采用天然沸石、改性沸石或合成沸石对NH4+进行吸附去除,然而这类吸附剂主要针对的是市政污水〔7-8〕、自来水厂〔9〕和地下水中微量的NH4+〔10〕,以天然沸石作为吸附剂、高NH4+含量水源作为研究对象进行的吸附研究则相对较少。煤化工废水中NH4+质量浓度很高,高者可达10 000 mg /L以上,工业上主要采用吹脱法去除NH4+,然而,吹脱法通常需要多次升高温度和增加碱度来提高气态NH3比例以使NH4+达到排放标准,同时排放之前还需不断加酸以降低碱度,不仅运行成本增加,而且经相态转变形成的气态NH3直接排入空气中将造成严重污染,对人身健康存在极大危害〔11〕。天然沸石吸附剂取材广泛、成本低廉,对NH4+吸附效率高且选择性好,易于通过再生方法进行NH4+回收,可用性和安全性高〔12-13〕,这些极具竞争力的优势可使天然沸石作为煤化工废水中高浓度NH4+去除工艺中的一个预处理操作单元,是一种值得尝试的代替方法,具有一定理论和实用价值。
大量研究报道,沸石吸附低浓度NH4+时,离子交换过程和吸附过程是其主要吸附路径〔14-16〕。离子交换过程被定义为外表面络合,包括替代沸石结构阳离子;吸附过程被定义为内表面络合,被吸附的阳离子与沸石活性官能团间成键或被静电引力吸引〔14〕。高浓度NH4+的吸附在一些文献中也有涉及,但通常都是将其作为低浓度NH4+吸附性能研究的对照组,并未将其作为重点展开专门研究,吸附机理研究更是少之又少。Lin LIN等〔17〕开展了不同质量浓度范围(10~4 000 mg/L)NH4+吸附机理的研究,发现NH4+去除主要通过离子交换机理进行,但是不同质量浓度的NH4+对沸石结构中金属离子的选择性不同,低质量浓度NH4+对Na+的选择性较强,而高质量浓度(>1 000 mg/L)时NH4+与Ca2+的交换作用占主导地位;由此可见,沸石对不同浓度NH4+的吸附行为是不同的,然而该研究并未对高浓度NH4+的吸附行为及机理进行深入探究。M. J. MANTO等〔18〕利用ZSM-5吸附1 000 mg/L的NH4+溶液,发现ZSM-5对NH4+的吸附量高于其理论交换容量(IEC),主要原因是除了静电引力之外,NH4+与ZSM-5骨架间还形成了氢键,为沸石吸附高浓度NH4+时有多种作用形式协同促进的吸附机制奠定基础。Lin YE等〔19〕通过探测沸石中吸附态NH3分子的原子位置,证实了NH3上H原子与沸石骨架O原子间会形成氢键。基于以上文献研究,很有必要对天然沸石吸附高质量浓度NH4+(>1 000 mg/L)时的吸附行为及机理展开深入探究。
本研究以天然沸石吸附去除高质量浓度NH4+-N(1 000~4 000 mg/L)为研究对象,并聚焦于其吸附机理的探索。采用实验和理论计算相结合的研究方法,借助吸附动力学、等温线和热力学研究,并结合分子动力学模拟,探究天然沸石对高浓度NH4+的吸附机理,以期为丰富沸石吸附水体中高浓度NH4+的机理研究提供理论指导。
1 材料和方法
1.1 材料与仪器
材料:天然沸石,采自河南郑州,粒径0.5~1.0 mm;聚偏氟乙烯(PVDF)微孔滤膜,平均孔径为0.22 μm,天津市科亿隆实验设备有限公司;氯化铵(NH4Cl),分析纯,天津化学试剂有限公司;实验用水为双重去离子水,电阻率为16 MΩ·cm。
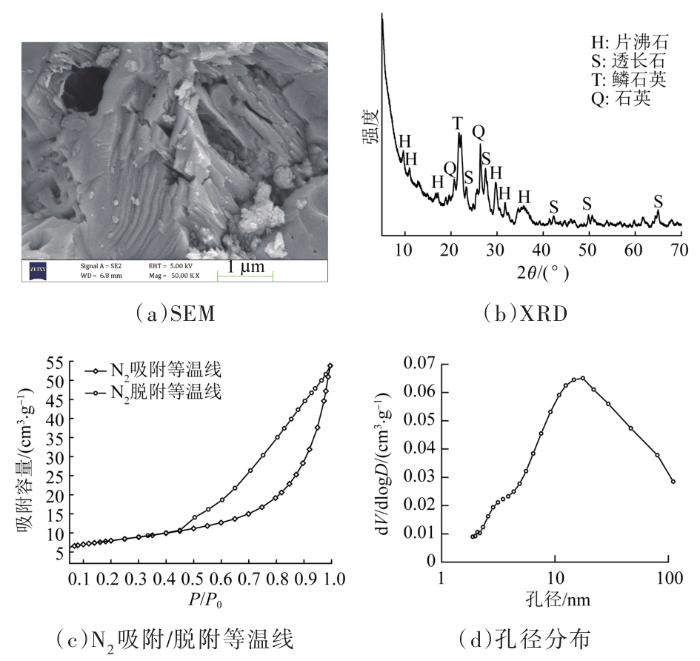
仪器:分别采用扫描电镜(ZEISS MERLIN,德国)、X射线能谱仪(Bruker,德国)和X射线粉末衍射仪(Rigaku Ultimate Ⅳ,日本)对天然沸石进行SEM、EDS和XRD表征,确定其形貌、化学成分和矿物种属;使用全自动比表面积及孔隙度分析仪(ASAP 2460)在77.35 K下测定N2吸附/脱附曲线,测定天然沸石孔容和孔径分布,进而确定其BET比表面积。
1.2 吸附实验
天然沸石用去离子水清洗、105 ℃干燥过夜。称取一定质量的沸石投加于100 mL 1 000~4 000 mg/L(以N计)的NH4Cl溶液中(未调pH),在不同温度下振荡数小时后,取上清液经0.22 μm滤膜过滤后,采用纳氏试剂分光光度法测定溶液中剩余NH4+-N浓度。每组数据由3次平行实验取平均值所得。
1.3 理论计算
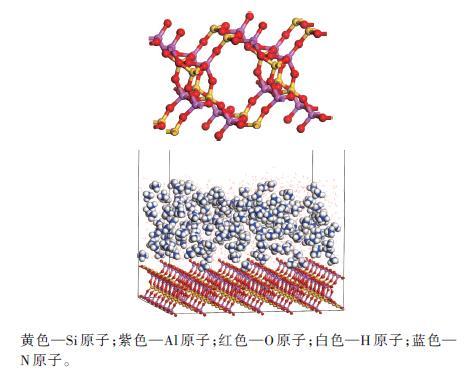
在Materials Studio 2018软件Amorphous Cell模块中建立的天然沸石优化结构及其在高浓度NH4+溶液中吸附后的优化结构如图1所示。模拟体系的初始立方晶胞参数为x=3.917 nm、y=3.996 nm、 z=24.0 nm,溶液上方留有2 nm厚的真空层以减弱沸石基质的影响。本研究主要进行高浓度NH4+吸附于天然沸石表面的吸附能和吸附态NH4+中H原子与沸石骨架中O原子间键长的相关计算。
图1
图1
天然沸石(a)及其吸附NH4+后的优化结构(b)
黄色—Si原子;紫色—Al原子;红色—O原子;白色—H原子;蓝色—N原子。
Fig. 1
Optimized structures of natural zeolite (a) and NH4+ adsorbed by natural zeolite (b)
2 结果与讨论
2.1 天然沸石的性质表征
图2
表1 天然沸石EDS分析结果
Table 1
| 化学元素 | 质量分数/% | 化学元素 | 质量分数/% |
|---|---|---|---|
| O | 47.12 | Fe | 1.40 |
| Si | 26.87 | Na | 0.82 |
| Al | 5.72 | Ca | 0.77 |
| K | 2.76 | Mg | 0.34 |
| 其他 | 14.2 |
天然沸石与其他沸石的物理性质对比见表2,本研究选用的天然沸石具有较大的比表面积和较高的孔容。
表2 本研究天然沸石与其他沸石的物理性质对比
Table 2
2.2 影响天然沸石吸附高浓度NH4+的因素
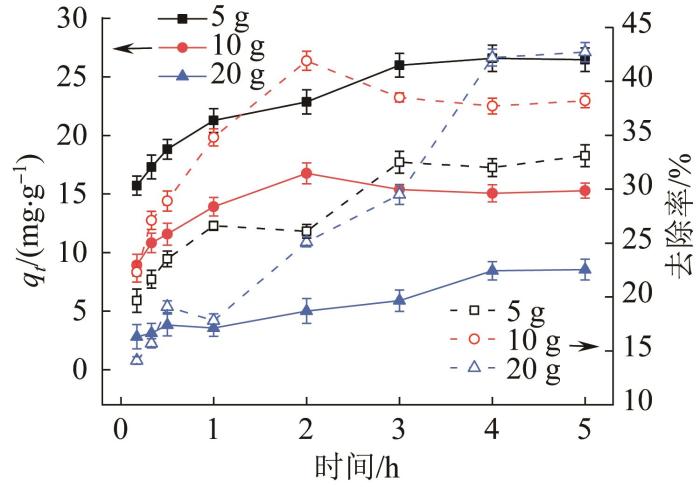
2.2.1 沸石投加量
在吸附温度为35 ℃、溶液体积为100 mL、初始NH4+-N质量浓度为4 000 mg/L的条件下,考察了不同沸石投加量(5~20 g)对其吸附高浓度NH4+行为的影响,结果见图3。
图3
图3
不同沸石投加量对天然沸石吸附高浓度NH4+行为的影响
Fig. 3
Effect of different zeolite dosage on adsorption behavior of high-concentration NH4+ by natural zeolite
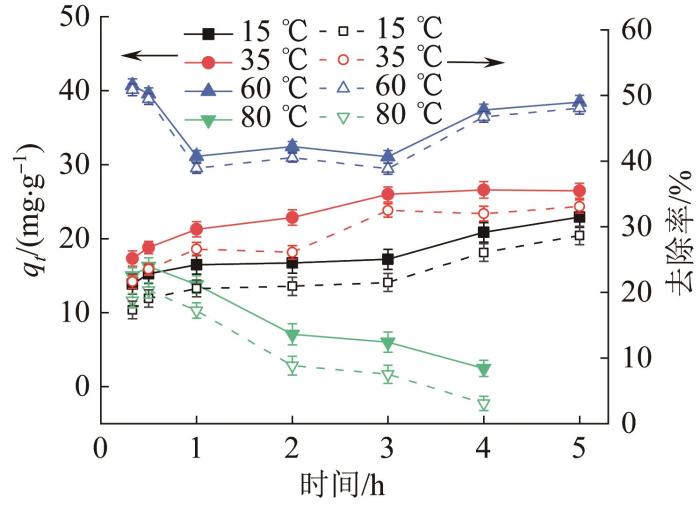
2.2.2 吸附温度
在初始NH4+-N质量浓度为4 000 mg/L、天然沸石投加量为50 g/L条件下,考察了吸附温度(15~80 ℃)对沸石吸附高浓度NH4+行为的影响,结果见图4。
图4
图4
不同温度对天然沸石吸附高浓度NH4+行为的影响
Fig. 4
Effect of different temperature on adsorption behavior of high-concentration NH4+ by natural zeolite
2.2.3 NH4+-N初始浓度
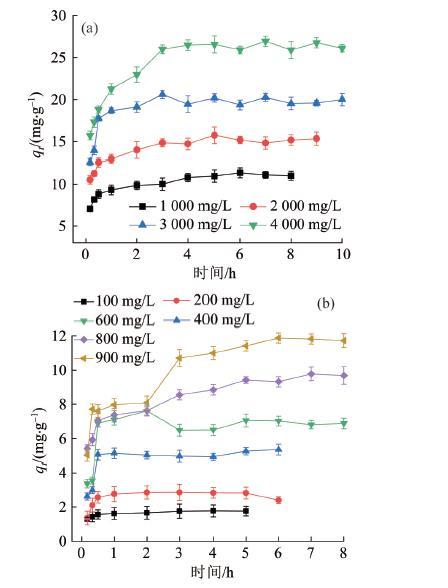
为探索高浓度NH4+对天然沸石吸附行为的影响,选用不同初始质量浓度的NH4+-N溶液开展实验,其中沸石投加量为50 g/L,吸附温度为35 ℃,结果见图5。
图5
图5
不同NH4+-N浓度对天然沸石吸附NH4+行为的影响
Fig. 5
Effect of different NH4+-N concentration on adsorption behavior by natural zeolite
由图5可见,天然沸石对高质量浓度(1 000~4 000 mg/L)与中低质量浓度(<1 000 mg/L) NH4+的吸附行为有显著差异。当NH4+-N质量浓度超过1 000 mg/L时,天然沸石对NH4+的吸附几乎很难稳定维持在一个固定容量上,预示了NH4+吸附和脱附过程的不平衡,在某些时刻脱附速率较大,并且NH4+-N初始质量浓度越大,脱附现象越显著;当NH4+-N初始质量浓度增至4 000 mg/L时,天然沸石对NH4+的吸附速率非常快,前10 min内沸石对NH4+的吸附容量即可高达15.72 mg/g,与此同时脱附现象也更加明显;尽管如此,沸石对NH4+的净吸附量还在迅速增加,3 h时吸附容量基本达到最大值,高达26.94 mg/g。因此,本研究后续的吸附时间均确定为3 h。根据Shaobin WANG等〔26〕的研究结果,天然沸石对NH4+的吸附容量在2.7~30.6 mg/g。另外,通过与其他沸石的吸附容量进行比较(表3),本研究选用的天然沸石具有很好的吸附潜能。天然沸石对不同浓度NH4+的差异性吸附行为也说明天然沸石吸附低浓度和高浓度NH4+时的作用方式不同。造成吸附容量不稳定和脱附现象显著的可能原因是NH4+与沸石表面间除了存在通常认为的离子交换过程和静电引力作用之外,还存在其他相互作用使其在沸石表面不能稳定存在。
表3 天然沸石与其他报道沸石材料对NH4+吸附性能的对比
Table 3
2.3 吸附动力学、等温线和热力学研究
2.3.1 吸附动力学
当NH4+-N初始质量浓度为4 000 mg/L时,最佳吸附实验条件为35 ℃、沸石投加量为50 g/L、吸附时间为3 h。在最佳实验条件下,在不同时间间隔内测定沸石的吸附容量,并采用常用的准一级、准二级和Elovich动力学模型评估天然沸石吸附高浓度NH4+体系的动力学特性,结果见表4。
表4 吸附动力学拟合参数
Table 4
| 准一级动力学模型 | 准二级动力学模型 | Elovich模型 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| qe/(mg∙g-1) | k1/min-1 | R2 | qe/(mg∙g-1) | k2/(g·mg-1·min-1) | R2 | α/(mg·g-1·min-1) | β/(g·mg-1) | R2 | ||
| 24.89 | 0.11 | 0.354 | 25.17 | 0.016 | 0.85 | 7.414×106 | 0.86 | 0.323 | ||
由表4可见,天然沸石在吸附高浓度NH4+时,其动力学拟合偏差R2较大,这是由于高浓度污染物的吸附行为复杂,存在多种吸附作用共同影响,使得在利用现有理论模型拟合时出现了较大偏差。总体而言,天然沸石对初始质量浓度为4 000 mg/L的NH4+的吸附过程更适合用准二级动力学模型描述,说明天然沸石对高浓度NH4+的吸附过程更符合化学吸附机理。
2.3.2 吸附等温线
在初始NH4+-N质量浓度为100~4 000 mg/L、吸附温度为35 ℃、沸石投加量为50 g/L、吸附时间为3 h条件下,测定不同NH4+-N初始浓度对沸石吸附NH4+性能的影响。采用常用的Langmuir模型和Freundlich模型评估天然沸石吸附高浓度NH4+的吸附等温线特性,拟合参数见表5。
表5 吸附等温线拟合参数
Table 5
| Langmuir | Freundlich | |||||
|---|---|---|---|---|---|---|
| qm/(mg∙g-1) | KL/(L∙mg-1) | R2 | KF/(mg1-1/n ∙L1/n ∙g-1) | n | R2 | |
| 27.06 | 0.001 5 | 0.935 | 0.872 | 2.410 | 0.969 | |
由表5可见,相比Langmuir模型,Freundlich模型更适合描述天然沸石对高浓度NH4+的吸附行为,表明天然沸石吸附高浓度NH4+的过程与Freundlich模型描述的表面不均匀、吸附位点不完全相同的化学吸附过程类似。Freundlich方程中的1/n能够衡量吸附强度或表面不均匀性,若0<1/n<1,则吸附过程可行且良好。本实验1/n为0.415,说明该天然沸石是优良的NH4+吸附剂。
2.3.3 吸附热力学
吸附热力学研究对于预测吸附机理是必不可少的,与吸附过程有关的热力学参数,如ΔGΘ、ΔHΘ与ΔSΘ,可用于确定吸附过程是否符合物理吸附或化学吸附。本研究采用50 g/L的天然沸石来吸附处理初始质量浓度为4 000 mg/L的NH4+-N溶液3 h,考察了温度对其吸附行为的影响,计算得到的热力学参数见表6。
表6 天然沸石对高浓度NH4+的吸附热力学参数
Table 6
| 温度/K | Kc | ΔGΘ/(kJ·mol-1) | ΔHΘ/(kJ·mol-1) | ΔSΘ/(J·mol-1·K-1) |
|---|---|---|---|---|
| 288 | 5.80×10-4 | -15.52 | 21.36 | 128.05 |
| 298 | 9.50×10-4 | -16.80 | ||
| 308 | 1.23×10-3 | -18.21 | ||
| 323 | 1.62×10-3 | -19.85 | ||
| 338 | 2.42×10-3 | -21.89 |
2.4 理论计算
本研究的理论计算选择天然沸石骨架中的O、Si和Al原子作为吸附位点,分别计算了吸附了NH4+后各吸附位点的结合能,结果见表7。
表7 NH4+吸附于天然沸石的不同吸附位点处的吸附能
Table 7
| 吸附位点 | O吸附位点 | Si吸附位点 | Al吸附位点 |
|---|---|---|---|
| Eads/(kJ·mol-1) | -86.77 | -40.90 | -61.32 |
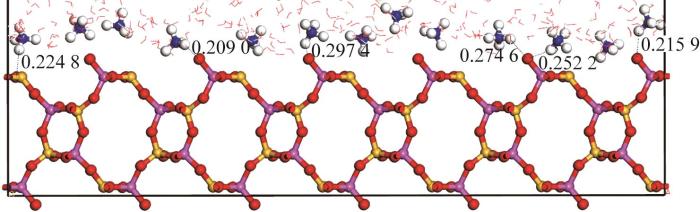
本研究计算了沸石骨架O原子与吸附态NH4+上H原子间的键长,结果见图6。
图6
图6
天然沸石骨架O原子与吸附态NH4+上H原子间键长
黄色—Si原子;紫色—Al原子;红色—O原子;白色—H原子;蓝色—N原子。
Fig. 6
Bond length between O atom of natural zeolite skeleton and H atom of adsorbed NH4+
由图6可知,本研究计算的沸石骨架O原子与吸附态NH4+上H原子间键长为0.274 6~0.297 4 nm,表明NH4+与沸石骨架中O原子间存在氢键。G. GILLI等〔20〕认为所有分子间N—H···O/O—H···N键中最短氢键键长均在0.253 2~0.266 0 nm之间。而本研究计算的沸石骨架O原子与吸附态NH4+上H原子间还存在0.209 0~0.252 2 nm的短键长,暗示吸附态NH4+与沸石骨架O原子间还同时存在强于氢键的吸附作用,很可能是化学吸附作用。结合2.3章节的化学吸附结论,氢键键长理论计算不仅在理论上证实了NH4+与天然沸石表面之间存在氢键作用,而且也辅助证明了强烈的化学吸附作用也存在于该吸附体系中。
2.5 天然沸石吸附高浓度NH4+后的结构变化
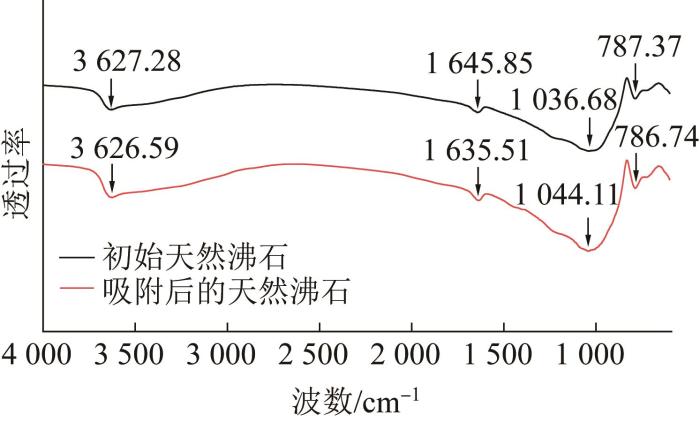
为验证吸附高浓度NH4+后对天然沸石结构的影响,本研究对吸附NH4+前后的天然沸石进行了FT-IR表征,结果见图7。
图7
图7
天然沸石吸附高浓度NH4+前后的FT-IR表征
Fig. 7
FT-IR characterization of natural zeolite before and after adsorption of high concentration NH4+
如图7所示,3 000~4 000 cm-1和1 600 cm-1附近处的吸收峰分别为吸附在沸石表面—OH的伸缩和变形振动。900~1 100 cm-1处的吸收峰归属为沸石内部结构中O—Si—O或O—Al—O键的振动,750~790 cm-1为Si—О或Al—O键的对称伸缩振动。吸附NH4+后的曲线上未检测到N—H键的伸缩振动(3 300~3 500 cm-1),表明少量的NH4+很难被检测到。然而,对比吸附NH4+前后的沸石在900~1 100 cm-1处的吸收峰,吸附后O—Si—O或O—Al—O键的吸收峰有明显的“蓝移”现象,表明沸石在吸附NH4+后基团变得更加稳定〔34〕。同时,对比吸附NH4+前后沸石表面—OH的变形振动,吸附后1 600 cm-1附近处的吸收峰发生了一定的“红移”现象,说明吸附的NH4+与—OH间会通过氢键作用使—OH键能减弱,向低频区移动。以上吸收峰位置的移动均表明确实有化学键形成,证实了前面实验和理论计算结果中关于存在化学键的推论。
2.6 天然沸石吸附高浓度NH4+的吸附机理
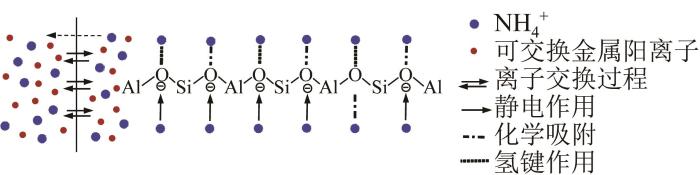
通过结合吸附动力学、等温线、热力学分析与理论计算结果,确定天然沸石对高浓度NH4+的吸附机理。天然沸石吸附高浓度NH4+的机制不像吸附低浓度NH4+时受单一离子交换过程或静电引力作用,其受多种作用形式共同影响,天然沸石对高浓度NH4+的吸附主要由离子交换过程、静电引力和化学吸附作用协同促进,同时氢键作用也起重要辅助作用。具体来讲,该沸石吸附体系中的NH4+通过与沸石结构中的可交换金属阳离子(如Na+、K+、Ca2+等)进行离子交换进入沸石内孔隙,一方面由于沸石结构内存在较强负电场,产生较强静电引力〔35〕;另一方面,部分吸附态NH4+受沸石骨架O吸附位点的强化学吸附作用而牢固键合,不易脱附〔31〕。另外,也有相当部分的NH4+吸附会受到较弱的氢键作用,这部分吸附NH4+易受外界环境影响而断键,表现出显著的脱附现象。化学吸附和氢键作用使得天然沸石对NH4+的吸附容量高于自身的IEC而表现出良好的吸附能力。天然沸石对高浓度NH4+的吸附机理如图8所示。
图8
3 结论
(1)天然沸石在吸附高质量浓度NH4+-N(1 000~4 000 mg/L)与中低质量浓度NH4+-N(<1 000 mg/L)时有显著差异。当初始NH4+-N质量浓度为4 000 mg/L时,天然沸石对NH4+的最大吸附量可达26.94 mg/g。
(2)吸附动力学和等温线分析发现,天然沸石对高浓度NH4+的吸附过程符合准二级动力学模型和Freundlich模型,表明高浓度NH4+在天然沸石表面以多层、化学吸附形式进行,理论计算结果佐证了氢键和化学吸附作用的存在。
(3)离子交换过程、静电引力和化学吸附作用协同促进是天然沸石吸附高浓度NH4+的主要作用机制,氢键起辅助作用。
参考文献
Removal of chlorinated volatile organic compounds onto natural and Cu-modified zeolite:The role of chemical surface characteristics in the adsorption mechanism
[J].
Control of released volatile organic compounds from industrial facilities using natural and acid-treated mordenites:The role of acidic surface sites on the adsorption mechanism
[J].
Effect of alkali-treatment on the characteristics of natural zeolites with different compositions
[J].
Investigation of zinc binding properties onto natural and synthetic zeolites:Implications for soil remediation
[J].
Purification mechanism of sewage from constructed wetlands with zeolite substrates:A review
[J].
Ammonium assists orthophosphate removal from high-strength wastewaters by natural zeolite
[J].
Adsorption characteristics and mechanisms of high-levels of ammonium from swine wastewater using natural and MgO modified zeolites
[J].
人造沸石去除高速公路服务区污水氨氮的实验研究
[J].
Experimental study on the removal of ammonia nitrogen from sewage in service area of the highway by artificial zeolite
[J].
Ammonia removal from aqueous solution using natural Chinese clinoptilolite
[J].
An investigation into the adsorption removal of ammonium by salt activated Chinese(Hulaodu) natural zeolite:Kinetics,isotherms,and thermodynamics
[J].
Ammonia recovery from air stripping process applied to landfill leachate treatment
[J].
Optimization for zeolite regeneration and nitrogen removal performance of a hypochlorite-chloride regenerant
[J].
饱和吸附氨氮沸石的化学再生方法研究
[J].
Study on chemical regeneration method of saturated zeolite adsorbed ammonia nitrogen
[J].
Effective decontamination of phosphate and ammonium utilizing novel muscovite/phillipsite composite;equilibrium investigation and realistic application
[J].
Effective removal of ammonium nitrogen using titanate adsorbent:Capacity evaluation focusing on cation exchange
[J].
Adsorption of ammonia nitrogen in low temperature domestic wastewater by modification bentonite
[J].
Adsorption mechanisms of high-levels of ammonium onto natural and NaCl-modified zeolites
[J].
Recovery of ammonium from aqueous solutions using ZSM-5
[J].
Probing atomic positions of adsorbed ammonia molecules in zeolite
[J].
Towards an unified hydrogen-bond theory
[J].
The COMPASS force field:Parameterization and validation for phosphazenes
[J].
COMPASS:An ab initio force-field optimized for condensed-phase applications—Overview with details on alkane and benzene compounds
[J].
化学改性对沸石去除水中碳、氮污染物的影响
[J].
Effects of chemical modification on removal of pollutants with carbon and nitrogen from aqueous solution by zeolite
[J].
Adsorption of ammonium by different natural clay minerals:Characterization,kinetics and adsorption isotherms
[J].
Preparation of highly ordered cubic NaA zeolite from halloysite mineral for adsorption of ammonium ions
[J].
Natural zeolites as effective adsorbents in water and wastewater treatment
[J].
Ion-exchange process for ammonium removal and release using natural Iranian zeolite
[J].
Ammonium removal from aqueous solutions by using natural Chinese(Chende) zeolite as adsorbent
[J].
The investigation into the ammonium removal performance of Yemeni natural zeolite:Modification,ion exchange mechanism,and thermodynamics
[J].
A critical review of the estimation of the thermodynamic parameters on adsorption equilibria. Wrong use of equilibrium constant in the Van’t Hoof equation for calculation of thermodynamic parameters of adsorption
[J].
Novel bentonite/zeolite-NaP composite efficiently removes methylene blue and Congo red dyes
[J].
Adsorption characteristics of copper(Ⅱ),zinc(Ⅱ) and mercury(Ⅱ) by four kinds of immobilized fungi residues
[J].
Adsorption of Cu(Ⅱ),Ni(Ⅱ) and Zn(Ⅱ) ions by nano kaolinite:Thermodynamics and kinetics studies
[J].
Physicochemical evaluation of the effect of natural zeolite modification with didodecyldimethylammonium bromide on the adsorption of bisphenol-A and propranolol hydrochloride
[J].
Adsorption of metal ions onto Moroccan stevensite:Kinetic and isotherm studies
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号