除锰微生物主要通过2种方式去除锰:(1)具有锰氧化能力的微生物将可溶性的Mn2+催化氧化为不可溶的高价锰氧化物〔3〕;(2)部分细菌虽不能氧化Mn2+生成高价锰氧化物,但可以将Mn2+富集到菌体表面,在周围环境的作用下生成不溶的MnCO3〔4〕,从而达到去除水中金属锰的效果。固定化是将细菌用于实际废水处理的手段之一,包埋法是固定化方法中较常用的一种〔5〕,包埋法能使集中在其内部的微生物保持较高的活性,包埋形成的小球机械强度大且能抵御一定的水力冲击〔6〕,在地下水处理和自来水净化中应用较多。然而,包埋法固定除锰细菌处理的大多是低浓度锰离子废水,本研究拟在对除锰细菌进行筛选鉴定和除锰特性研究基础上,利用正交实验探讨固定化细菌的最佳除锰条件和最适Mn2+浓度,以期为微生物除锰新型菌种的开发和固定化技术理论研究提供参考。
1 材料与方法
1.1 菌种来源及培养基的制备
1.1.1 菌种来源
菌种筛选自桂林市大新锰矿区周边的土壤。含Mn2+的工业废水取自柳州市桂柳化工厂,废水COD为50 mg/L,实际含Mn2+质量浓度为29 mg/L,实验中通过添加硫酸锰改变Mn2+质量浓度。
1.1.2 培养基的制备
无Mn2+液体培养基配方:蛋白胨10 g/L,牛肉浸膏3 g/L,氯化钠5 g/L,pH=6.5。
含Mn2+液体培养基配方:蛋白胨10 g/L,牛肉浸膏3 g/L,氯化钠5 g/L,MnSO4·H2O适量,pH=6.5。
无Mn2+固体培养基的配方为在无Mn2+液体培养基基础上添加20%琼脂,含Mn2+固体培养基的配方为在含Mn2+液体培养基基础上添加20%琼脂。
以上无Mn2+培养基均需用高压灭菌锅于121 ℃下灭菌30 min;此外,在超净台下用已灭过菌的0.22 μL过滤器对MnSO4·H2O进行过滤除菌,加入无Mn2+培养基制备含Mn2+培养基。
1.2 锰氧化菌株的分离纯化
取含锰泥土10 g加入到90 mL灭菌生理盐水中充分振荡10 min〔7〕,静置5 min后取上清液5 mL接种到100 mL含Mn2+的液体培养基中,在30 ℃、转速120 r/min条件下培养48 h,梯度稀释后涂布在含Mn2+平板上于30 ℃培养48 h,挑取单菌落多次划线分离得到耐锰纯菌种。
用亮柏蓝(Leucoberbelin blue,LBB)试剂进行高价锰离子的检测,以检验纯化得到的菌株是否具有锰氧化活性〔8〕。配制Mn2+质量浓度为260 mg/L的培养基,将菌株按1%的接种量接种到培养基并培养5 d;取1 mL菌液离心,倒掉上清液,在沉淀中加入1 mL 45 mmoL/L乙酸和0.5 mL质量分数为0.04%的LBB,摇匀后静置一段时间,观察液体颜色的变化。
1.3 除锰细菌的鉴定
1.3.1 形态观察
对筛选出的菌株进行划线分离,采用革兰氏染色法观察单菌落的形态特征,包括菌落的颜色、大小、形状等〔9〕。
1.3.2 16S rRNA基因序列分析
1.4 菌株生长及Mn2+去除特性研究
考察菌株的生长情况并对其Mn2+去除特性进行研究。将菌株以1%的接种量接种到Mn2+质量浓度分别为0、130、260、488、814 mg/L的200 mL液体培养基中,在120 r/min、30 ℃条件下培养6 d,间隔一定时间取样测菌液pH。另取1 mL菌液离心,取上清液在450 nm处测定其吸光度,计算培养基中剩余的Mn2+得到Mn2+去除率。
1.5 菌株表面锰化合物的表征分析
将菌株接种到含Mn2+的液体培养基中培养5 d,在6 000 r/min转速下离心5 min,倒掉上清液,用无菌水清洗菌体数次,倒掉上清液,放入冰箱冷冻,完全结冰后,用真空冷冻干燥机干燥直至成粉末,压片处理后,在管电流40 mA、管电压40 kV、扫描速度5(°)/min、2θ扫描范围10o~80o条件下进行XRD衍射测定。
将菌株接种到含Mn2+的液体培养基中培养5 d,在6 000 r/min转速下离心5 min,倒掉上清液,用磷酸缓冲盐溶液(PBS)清洗菌体3次,加入2.5%的戊二醛混匀后放入冰箱固定24 h。之后用不同浓度的酒精对其进行梯度脱水,每次脱水10 min,离心后弃去上清液,脱水完毕真空干燥直至菌体成粉末,喷金处理后用扫描电子显微镜进行SEM观察和EDS能谱分析。
1.6 胶囊固定菌的制备
参照文献〔13〕中海藻酸钠-壳聚糖-粉末活性炭微胶囊的制备方法制备胶囊固定菌。以m(活性炭)∶m(海藻酸钠溶液)=0.75∶100的比例向质量分数为2%的海藻酸钠溶液加入粉末活性炭形成粉末活性炭-海藻酸钠溶液。将湿菌体与粉末活性炭-海藻酸钠溶液以1 g∶50 mL的比例充分混匀,滴入质量分数为4%的氯化钙溶液中,固定化1.5 h,得到凝胶颗粒。用纯水洗去颗粒表面吸附的钙离子,浸入质量分数为1.8%的壳聚糖溶液中成膜,再用0.055 mol/L柠檬酸钠溶液液化内核,最后浸入质量分数为0.15%的海藻酸钠溶液中覆膜,得到胶囊固定菌。将胶囊固定菌用纯水清洗3次后浸在纯水中,置于4 ℃下保存备用。
参照上述方法不添加实验菌种获得空白胶囊。
1.7 Mn2+去除率对比实验
在温度30 ℃、转速120 r/min条件下振荡培养菌种,经3次离心并洗涤后得到湿菌体;将1 g湿菌体用50 mL无菌生理盐水重悬制得游离菌,使用前摇匀。
调整废水中Mn2+质量浓度为150 mg/L,pH=6.8。将菌悬液、胶囊固定菌及空白胶囊均按1 mL∶10 g的比例接种到100 mL废水中,于温度30 ℃、转速120 r/min条件下振荡培养3 d后进行Mn2+去除率的测定。
1.8 正交实验
采用L9(34)正交表进行实验设计,选取培养时间(A)、pH(B)、m(活性炭)∶m(海藻酸钠溶液)(C)、Mn2+质量浓度(D)这4个因素,每个因素下选取如表1所示的3个水平,通过对正交实验结果进行极差分析得出优化方案,并对优化方案进行验证。
表1 正交因素水平
Table 1
| 水平 | 因素 | |||
|---|---|---|---|---|
| A/d | B | C | D/(mg·L-1) | |
| 1 | 2 | 6.0 | 0.25∶100 | 50 |
| 2 | 4 | 7.0 | 0.75∶100 | 250 |
| 3 | 6 | 8.0 | 1.0∶100 | 500 |
1.9 重复利用实验
在优化条件下检测胶囊固定菌的除锰率。一轮降解实验结束后将胶囊固定菌过滤回收,用无菌纯水清洗3次,再次按优化条件接种至废水中培养,考察Mn2+去除率,重复3次。
2 结果与分析
2.1 菌株的分离和鉴定
实验经分离纯化得到了2株细菌S1、S2。观察其菌落特征,并对其进行革兰氏染色、LBB实验,结果见图1。
图1
图1
S1、S2的菌落特征及其革兰氏染色、LBB实验结果
Fig.1
Colony characteristics of S1 and S2 and their Gram staining and LBB test results
由图1可知,细菌S1、S2的菌落颜色分别为棕色和米白色,均为不透明的圆形,表面凸起,为革兰氏阳性菌,长杆状,无鞭毛;菌株S1和S2均具有锰氧化活性,LBB显色结果显示菌株S1的显色较S2的深,说明菌株S1的锰氧化性高于菌株S2。
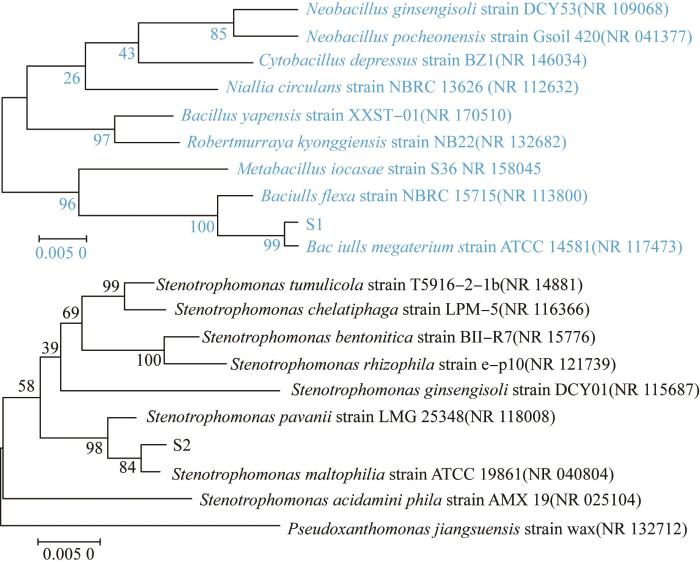
图2为基于S1、S2菌株16s rRNA序列的系统发育树。
图2
图2
基于S1、S2菌株16S rRNA序列的系统发育树
Fig.2
Phylogenetic trees based on 16S rRNA sequences of S1 and S2 strains
图2所示的菌株的16S rRNA基因序列分析结果表明,菌株S1、S2分别与巨大芽孢杆菌(Baciulls megaterium)、嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)亲缘关系最为接近,推测二者可能分别为Bacillus megaterium和Stenotrophomonas maltophilia。
2.2 菌株生长情况及Mn2+去除特性
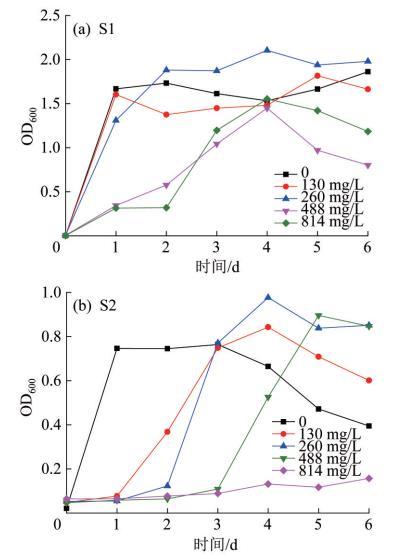
图3为菌株在不同Mn2+浓度下的生长曲线。
图3
图3
菌株在不同Mn2+质量浓度下的生长曲线
Fig.3
Growth curves of strains at different mass concentrations of Mn2+
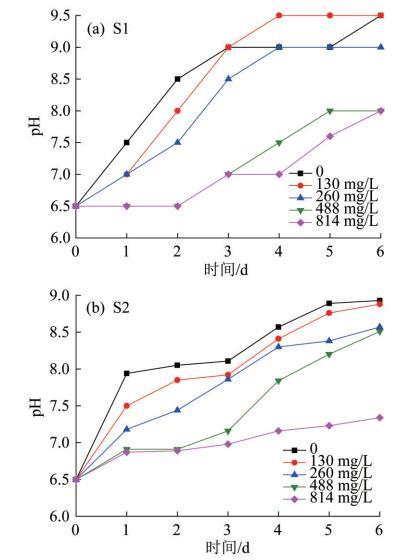
图4所示为在不同Mn2+浓度下进行细菌培养的培养基pH的变化曲线。
图4
图4
不同Mn2+质量浓度下培养基pH的变化曲线
Fig.4
Change curves of medium pH at different mass concentrations of Mn2+
由图4可知,菌株S1、S2在6 d的培养过程中,菌液pH都呈逐步升高的状态,由最初的6.5上升到9.0以上。
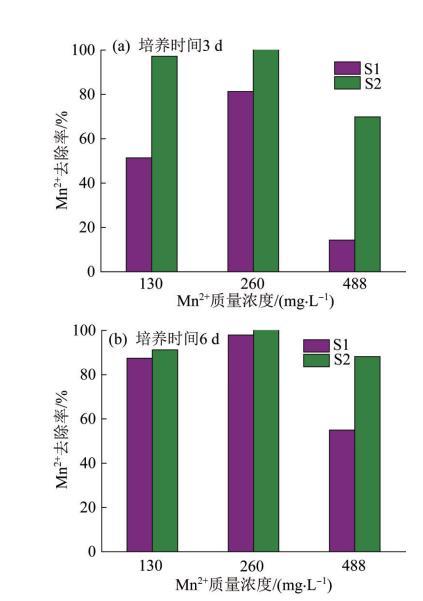
图5所示为菌株在不同Mn2+浓度下对Mn2+的去除率。
图5
图5
在不同Mn2+浓度下菌株的Mn2+去除率
Fig.5
Mn2+ removal rates of strains at different concentrations of Mn2+
如图5所示,在培养时间为6 d时,S1、S2在最适生长的Mn2+质量浓度(260 mg/L)下有较为理想的除锰率,分别为97.94%、100%。S1在Mn2+质量浓度为130、260 mg/L时的除锰率明显高于在Mn2+质量浓度为488 mg/L时。此外,培养时间越长,菌株对Mn2+的去除率越高;S2在Mn2+质量浓度为488 mg/L下的除锰率随培养时间的增加而增大,在Mn2+质量浓度为130、260 mg/L时培养3 d的S2的除锰率就已接近或达到培养时间为6 d时的除锰率。
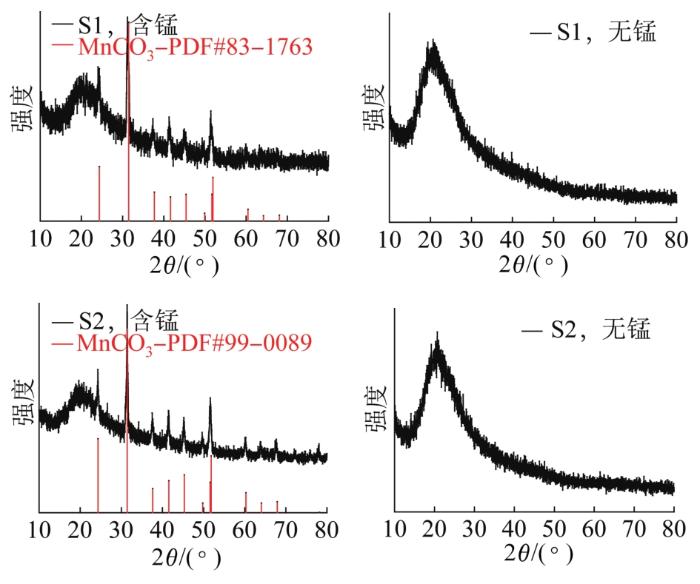
2.3 XRD与能谱分析
图6
图6
含Mn2+和无Mn2+条件下培养的S1、S2的XRD
Fig.6
XRD patterns of S1 and S2 cultured with and without Mn2+
表2 S1、S2的SEM-EDS分析结果
Table 2
元素 种类 | S1 | S2 | |||
|---|---|---|---|---|---|
| 质量分数/% | 原子分数/% | 质量分数/% | 原子分数/% | ||
| C | 25.22 | 43.61 | 20.98 | 35.14 | |
| N | 2.76 | 4.09 | 3.53 | 5.07 | |
| O | 26.75 | 34.72 | 35.86 | 45.08 | |
| Al | 0.14 | 0.10 | 0.14 | 0.10 | |
| Si | 0.12 | 0.09 | — | — | |
| P | 0.87 | 0.59 | 0.24 | 0.16 | |
| S | 0.29 | 0.19 | 0.21 | 0.13 | |
| Ca | 0.28 | 0.14 | 0.10 | 0.05 | |
| Mn | 41.87 | 15.83 | 38.94 | 14.26 | |
| Fe | 1.71 | 0.64 | — | — | |
2.4 胶囊固定菌成品
图7为胶囊固定菌外观。制备好的胶囊固定菌呈小圆球状,直径约5 mm,大小较为均匀。
图7
2.5 Mn2+去除率分析
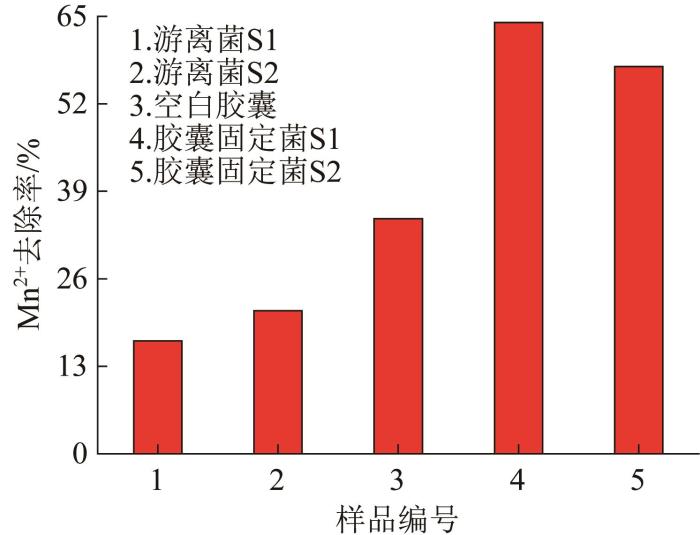
图8为游离菌、空白胶囊、胶囊固定菌对Mn2+去除率的对比结果。
图8
图8
游离菌、空白胶囊、胶囊固定菌对Mn2+去除效果
Fig. 8
Removal of Mn2+by free bacteria, blank capsule and immobilized bacteria in capsules
如图8所示,经过3 d的降解,游离菌S1、S2,空白胶囊及胶囊固定菌S1、S2的平均Mn2+去除率分别是16.79%、21.23%、34.94%、64.07%、57.53%,空白胶囊因活性炭的吸附作用使其也具有一定的除Mn2+能力,胶囊固定菌的除锰率明显高于游离菌的除锰率。
2.6 正交实验分析
表3 胶囊固定菌S1去除Mn2+的正交实验结果
Table 3
| 实验序号 | A/d | B | C | D/(mg·L-1) | Mn2+去除率/% |
|---|---|---|---|---|---|
| 因素主次 | D>C>B>A | ||||
| 1 | 2 | 6.0 | 0.25∶100 | 50 | 75.54 |
| 2 | 2 | 7.0 | 0.75∶100 | 250 | 31.48 |
| 3 | 2 | 8.0 | 1.0∶100 | 500 | 42.72 |
| 4 | 4 | 6.0 | 0.75∶100 | 500 | 50.87 |
| 5 | 4 | 7.0 | 1.0∶100 | 50 | 79.79 |
| 6 | 4 | 8.0 | 0.25∶100 | 250 | 30.97 |
| 7 | 6 | 6.0 | 1.0∶100 | 250 | 25.27 |
| 8 | 6 | 7.0 | 0.25∶100 | 500 | 39.18 |
| 9 | 6 | 8.0 | 0.75∶100 | 50 | 93.11 |
| k1 | 49.91 | 50.56 | 48.56 | 82.81 | |
| k2 | 53.88 | 50.15 | 58.49 | 29.24 | |
| k3 | 52.52 | 55.60 | 49.26 | 44.26 | |
| r | 3.96 | 5.45 | 9.92 | 53.57 | |
表4 胶囊固定菌S2去除Mn2+的正交实验结果
Table 4
| 实验序号 | A /d | B | C | D /(mg·L-1) | Mn2+去除率/% |
|---|---|---|---|---|---|
| 因素主次 | A>B>D>C | ||||
| 1 | 2 | 6.0 | 0.25∶100 | 50 | 81.00 |
| 2 | 2 | 7.0 | 0.75∶100 | 250 | 96.37 |
| 3 | 2 | 8.0 | 1.0∶100 | 500 | 85.90 |
| 4 | 4 | 6.0 | 0.75∶100 | 500 | 46.61 |
| 5 | 4 | 7.0 | 1.0∶100 | 50 | 68.29 |
| 6 | 4 | 8.0 | 0.25∶100 | 250 | 43.82 |
| 7 | 6 | 6.0 | 1.0∶100 | 250 | 35.68 |
| 8 | 6 | 7.0 | 0.25∶100 | 500 | 67.07 |
| 9 | 6 | 8.0 | 0.75∶100 | 50 | 91.79 |
| k1 | 87.76 | 54.43 | 63.96 | 80.36 | |
| k2 | 52.91 | 77.24 | 78.26 | 58.62 | |
| k3 | 64.85 | 73.84 | 63.29 | 66.53 | |
| r | 34.85 | 22.81 | 14.97 | 21.74 | |
表3中,胶囊固定菌S1在3个时间水平下的除锰率相差不大,考虑成本及Mn2+去除率,S1的除锰时间定为2 d。根据pH、m(活性炭)∶m(海藻酸钠溶液)、Mn2+质量浓度3个因素下的最大的除锰率,其余条件定为pH=8.0、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100、Mn2+质量浓度为50 mg/L。表4中,胶囊固定菌S2在4个因素的不同水平下均有各自最高的除锰率,所以胶囊固定菌S2的除锰条件定为时间2 d、pH=7.0、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100、Mn2+质量浓度为50 mg/L。通过正交实验结果分析所得出的2个优化方案并不包含在正交表已经做过的9个实验方案中,体现了正交实验的优越性。
按2种胶囊固定菌各自的最优方案进行实验,得到胶囊固定菌S1的除锰率为96.33%(>93.11%),说明除Mn2+最佳条件组合为A1B3C2D1,即时间2 d、pH=8.0、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100、Mn2+质量浓度50 mg/L。胶囊固定菌S2的除锰率为94.88%(<96.37%),说明除锰最佳条件组合为A1B2C2D2,即时间2 d、pH=7.0、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100、Mn2+质量浓度250 mg/L。
在胶囊固定菌S1的最优方案A1B3C2D1及胶囊固定菌S2的最优方案A1B2C2D2下进行后续实验。
2.7 重复利用实验
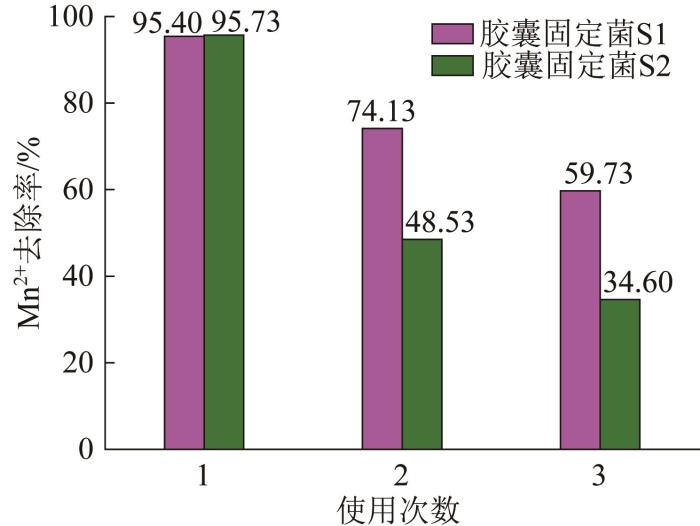
胶囊固定菌S1和S2的重复利用结果见图9。
图9
如图9所示,在最佳除锰条件下,胶囊固定菌S1、S2第1次使用时的除锰率分别为95.40%、95.73%,经3轮重复实验后胶囊固定菌的除锰率仍分别有59.73%、34.60%,说明胶囊固定菌具有一定重复利用性,且胶囊固定菌S1的重复利用性能强于S2。
胶囊固定菌S1、S2经3轮重复利用实验后,整体外观基本正常,有个别颗粒观察到轻微破损现象(<5%),原因可能是制备及转移培养过程中导致的机械损伤或培养过程中胶囊吸水溶胀,致使球体破裂。可见,胶囊固定菌具备一定的重复利用性能,有较好的经济效益和环境效益。
3 讨论
目前,研究者已从环境中筛选出多株具有耐锰特点的芽孢杆菌。Bacillus megaterium MB2〔14〕的最高耐Mn2+质量浓度为550 mg/L,但其在含Mn2+条件下的生长均不如无Mn2+条件下的生长,Mn2+质量浓度为660 mg/L时菌体几乎不能生长,且其在Mn2+质量浓度为55 mg/L的培养基中培养7 d后对Mn2+的去除率仅有(61.7±1.17)%;Bacillus megaterium 79〔15〕在Mn2+质量浓度为55 mg/L时对数期延迟,菌体生长受到明显抑制,在高质量浓度(550 mg/L)的Mn2+下基本丧失了锰氧化能力。而本研究中菌株S1在0~814 mg/L的Mn2+质量浓度范围内生长过程基本正常,在260 mg/L Mn2+质量浓度下生长情况最好且有最高除锰率97.94%。
Stenotrophomonas maltophilia很少作为除锰细菌出现,但有关于Stenotrophomonas maltophilia去除重金属离子U4+〔16〕和Cu2+〔17〕的报道。在本研究中菌株S2作为锰氧化细菌用于重金属Mn2+的去除,在130~488 mg/L Mn2+下的最终生物量均优于无Mn2+条件下,Mn2+质量浓度为260 mg/L时S2对Mn2+的去除率达到了100%。
不同于大多数锰氧化细菌那样将Mn2+氧化为Mn4+,S1、S2这2株细菌是将Mn2+转化为不溶的MnCO3。培养过程中培养基pH呈上升趋势,最高达到了9.0以上,可能是菌体在代谢过程中生成了OH-使培养基pH增大,促进了化学反应Mn2++HCO3-+OH-
将筛选出的2株除锰细菌通过包埋法制成胶囊固定菌,2种胶囊固定菌的除锰率显著高于其对应的游离菌,体现了微生物固定化技术的高效性〔23〕。胶囊固定菌的除锰率显著大于空白胶囊和游离菌相应的值,主要原因可能有:(1)活性炭与锰氧化菌具有协同作用,活性炭的吸附作用加上锰氧化菌的生物氧化作用使胶囊固定菌的除锰率大大提高;(2)活性炭具有保护作用,活性炭表面存在许多微孔,表面积巨大,可达1 000m2/g以上〔24〕,活性炭发达的孔隙使微生物可以大量附着,并为微生物生长提供了相对稳定的环境;(3)胶囊固定菌有更好的底物耐受性,由于传质扩散作用,胶囊表面到内部、细胞外到细胞内形成由高到低的Mn2+浓度梯度,因此胶囊固定菌比游离菌耐受更高的Mn2+浓度,除锰率也更高。
废水COD可能是影响细菌除锰率的一个因素,高COD有利于水体中细菌的生长〔25〕,但对比实验和正交实验中废水的COD仅为50 mg/L,有机物含量少不利于细菌的生长,而含Mn2+培养基中加入了足量的有机物,所以游离菌S1、S2在废水中的除锰率明显小于在含Mn2+培养基中除锰率。正交实验结果显示,废水中的Mn2+浓度是胶囊固定菌S1除锰过程中非常重要的影响因子,固定菌S1在Mn2+质量浓度为50 mg/L时的除锰率是在其余2个浓度下的2倍以上,说明胶囊固定菌S1适用于处理低Mn2+浓度的废水;Mn2+浓度对胶囊固定菌S2的影响较小,固定菌S2在Mn2+质量浓度为250 mg/L时有最大除锰率96.37%,但其在Mn2+质量浓度为50、500 mg/L时的除锰率也能达到91.79%和85.93%,胶囊固定菌S2在高浓度和低浓度Mn2+废水处理中均适用。胶囊固定菌S1、S2在特定条件下均具备高效除锰能力,胶囊固定菌S2的应用范围较S1更广,后续可进一步验证废水COD对胶囊固定菌除锰率的影响,探讨其应用潜力。
4 结论
(1)从桂林市大新锰矿区周边的土壤中筛选出的2株锰氧化细菌可能为S1巨大芽孢杆菌(Bacillus megaterium)和S2嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),2株细菌产生的锰转化物都为MnCO3。
(2)Mn2+去除率对比实验表明胶囊固定菌的除锰率显著高于对应游离菌的除锰率。通过正交实验得出胶囊固定菌S1的最佳除锰条件为时间2 d、pH=8.0、Mn2+质量浓度50 mg/L、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100,固定菌S2最佳除锰条件为时间2 d、pH=7.0、Mn2+质量浓度250 mg/L、m(活性炭)∶m(海藻酸钠溶液)=0.75∶100。
(3)在最佳除锰条件下,胶囊固定菌S1、S2第1次使用时的除锰率分别为95.40%、95.73%,经3轮重复实验后胶囊固定菌的除锰率仍有59.73%、34.60%,说明胶囊固定菌具有一定重复利用性。
参考文献
地下水中锰污染现状及治理技术进展
[J].
Current status of Mn pollution in groundwater and progress in treatment technology
[J].
生物法去除地下水铁锰的影响因素研究
[J].
Study on factors affecting biological removal of iron and manganese in groundwater
[J].
锰氧化细菌分类及作用机制研究进展
[J].
Research progress on the type and mechanism of manganese-oxidizing bacteria
[J].
五株产MnCO3细菌的除锰特性
[J].
Manganese removal mechanisms of five bacterial strains with the abilities to produce MnCO3
[J].
锰细菌的选育及其固定化除锰
[J].
Breeding of manganese-oxidizing bacteria and application of manganese removal by immobilization technology
[J].
微生物固定化技术在废水处理中的应用
[J].
Application of microbial immobilization technology in wastewater treatment
[J].
抗锰细菌的分离鉴定及其对生猪养殖粪水中锰的去除效果
[J].
Isolation,identification of a manganous salt resistant bacterium and manganese removal from pig-breeding fecal wastewater
[J].
自养型锰氧化菌的选育及除锰效果研究
[J].
A research on screening and identifying autotrophic manganese-oxidizing bacteria and manganese removal effect
[J].
一株锰氧化细菌的分离、鉴定及其锰氧化特性
[J].
Isolation and characterization of a manganese-oxidizing bacterium from soils
[J].
Cooperative Mn(Ⅱ) oxidation between two bacterial strains in an aquatic environment
[J].
锰氧化菌Bacillus sp
MK3-1的Mn(Ⅱ)氧化特性和除锰能力研究[J].
Mn(Ⅱ) oxidation and removal by a manganese-oxidizing bacterium Bacillus sp. MK3-1
[J].
锰氧化菌Aminobacter sp. H1的分离鉴定及其锰氧化机制研究
[J].
Isolation and identification of Mn oxidizing bacterium Aminobacter sp. H1 and its oxidation mechanism
[J].
海藻酸钠-壳聚糖-粉末活性炭生物微胶囊的制备
[J].
SA-CA-PAC bio-microcapsule prepared by sodium alginate-chitosan-active carbon powder
[J].
锰氧化细菌的分离鉴定及其锰氧化能力的研究
[D].
Isolation,identification of manganese-oxidizing bacterium and its manganes oxidition characteristics
[D].
土壤中锰氧化菌的筛选及氧化Mn2+的特性研究
[D].
The isolation of manganese-oxidizing bacteria in soil and the characteristics of Mn2+ oxidation
[D].
嗜麦芽糖寡养单胞菌H002对铀的生物吸附
[J].
Biosorption of uranium by Stenotrophomonas maltophilia H002
[J].
Upper bound analysis of slope stability with nonlinear failure criterion based on strength reduction technique
[J].
重金属危害机制及益生菌清除重金属机制研究进展
[J].
Research progress on the mechanism of heavy metal contamination and probiotics sequestration
[J].
微生物重金属耐受性及其机制的研究进展
[J].
Research progress on microbial tolerance to heavy metals and its mechanisms
[J].
锰氧化菌的激活及生物氧化锰去除有机药物效果的研究
[D].
Research on activation of manganese oxide bacteria and removal efficiency of pharmaceuticals by biogenic manganese oxides
[D].
A high Mn(Ⅱ)-tolerance strain,Bacillus thuringiensis HM7,isolated from manganese ore and its biosorption characteristics
[J].
Influence of Zn(Ⅱ) stress-induction on component variation and sorption performance of extracellular polymeric substances(EPS) from Bacillus vallismortis
[J].
微生物固定化技术及其在污水处理领域的研究进展
[J].
Development of researches on immobilized microorganism technique and its application to wastewater treatment
[J].
活性炭在饮用水处理中的应用探讨
[J].
Application of activated carbon in drinking water treatment
[J].
污水回用时pH、COD对细菌生长及杀菌性能的影响
[J].
Effects of pH and COD on bacteria growth and bactericidal performance while wastewater is being reused
[J].







 津公网安备 12010602120337号
津公网安备 12010602120337号