偶氮染料占合成染料总产量的60%以上〔1 〕 ,广泛用于工业中。橙黄Ⅱ是偶氮染料的典型代表,常用于纺织业、皮革业及印刷等领域,相关废水排放引发的环境问题不容忽视。常规的物理、生物法难以实现对橙黄Ⅱ印染废水的有效降解,高级氧化法是降解此类废水中有机物的有效手段。相较于传统的Fenton法,基于过硫酸盐的高级氧化法(SR-AOP)具有更高的氧化还原电位、更短的半衰期及更强的pH适应性,被广泛研究〔2 〕 。过一硫酸盐(PMS)的不对称结构更易被激活,可被紫外线、热、超声波、过渡金属及氧化物、碳基材料等活化,产生SO4 ·- 、·OH、O2 ·- 和1 O2 等活性物质。
钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 。但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题。研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 。PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用。B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%。然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少。
笔者采用简便的水热法制备Bi2 WO6 材料,通过XRD、SEM和 FT-IR对材料晶面结构和表面形貌进行表征,研究Bi2 WO6 联合PMS光催化体系对橙黄Ⅱ溶液的降解效果,探究不同反应体系、Bi2 WO6 投加量、PMS浓度、初始pH、共存阴离子和腐殖酸(HA)对降解效果的影响,通过自由基猝灭实验探究体系的活性物质,并评价材料的重复利用性能,以期为印染废水的降解提供一定参考。
1 材料与方法
1.1 试剂与仪器
Bi(NO3 )3 ·5H2 O、Na2 WO4 ·2H2 O、NaOH、H2 SO4 、KI、KHSO5 ·0.5KHSO4 ·0.5K2 SO4 、橙黄Ⅱ、NaHCO3 、KCl、KNO3 、KH2 PO4 、K2 SO4 、腐殖酸(HA)、甲醇(MeOH)、叔丁醇(TBA)、Na2 C2 O4 、对苯醌(BQ)、L-组氨酸(LH),均为分析纯。实验用水为去离子水。
X射线衍射仪,德国Bruker公司;Sigma 300扫描电镜,德国Zeiss;Nicolet 6700傅里叶红外光谱仪,美国Thermo Scientific;BL-GHX-V型光反应仪,上海比朗仪器制造有限公司;pH计,仪电科学仪器股份有限公司;Zeta电位分析仪,美国Brookhaven;UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;TOC-VSH总有机碳测定仪,日本岛津;CHI660E电化学工作站,美国CH Instruments公司。
1.2 Bi2 WO6 催化剂的制备
取6 mmol Bi(NO3 )3 ·5H2 O加入20 mL去离子水中,磁力搅拌30 min使其溶解;取3 mmol Na2 WO4 ·2H2 O加入20 mL去离子水中,磁力搅拌30 min溶解;将两种溶液转移到100 mL聚四氟乙烯内衬的不锈钢高压反应釜中,180 °C下恒温保持24 h进行水热反应。反应结束后待反应釜冷却至室温,离心收集固体,用去离子水和乙醇交替洗涤数次,所得产物在60 °C空气中干燥12 h,得到乳白色固体。
1.3 实验方法
降解反应在50 mL石英试管中进行。将石英试管置于光反应仪中,氙灯距离石英试管8 cm,灯周围有双层石英冷阱。取一定量Bi2 WO6 加入盛有50 mL橙黄Ⅱ溶液(10 mg/L)的石英试管中,除非特殊说明,溶液pH均未调整,在黑暗条件下搅拌30 min达到吸附-脱附平衡。取一定量的PMS加入石英试管中,开启500 W氙灯开始反应,间隔10 min抽取4 mL溶液,用0.45 μm水系滤膜过滤,用紫外-可见分光光度计在484 nm处测定溶液吸光度,计算橙黄Ⅱ降解率。PMS浓度测定采用改进碘量法〔8 〕 。
1.4 分析方法
采用X射线衍射仪(Cu-Kα 辐射,40 kV,40 mA)分析晶体结构,采用扫描电子显微镜分析表面形貌,采用傅里叶红外光谱仪分析结构变化,采用Zeta电位分析仪分析催化剂表面电荷,采用电化学工作站(1 000 kHz~0.01 Hz)分析不同体系的电化学性能。
2 结果与讨论
2.1 表征结果
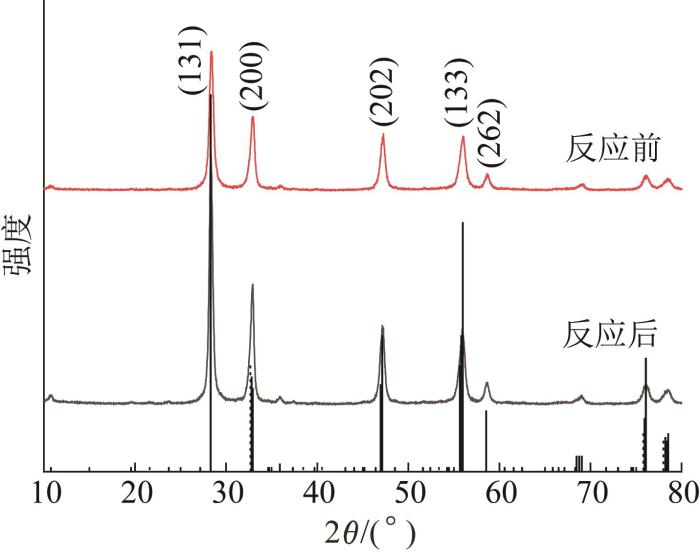
图1
图1
催化剂反应前后的XRD图谱
Fig. 1
XRD patterns of catalysts before and after reaction
由图1 可见,制备的样品在28.30°、32.79°、47.14°、55.99°、58.54°处有5个特征峰,可归因于(131)、(200)、(202)、(133)、(262)平面结晶Bi2 WO6 (No. 39-0526)〔9 〕 ,说明成功制备出高纯度和结晶度的Bi2 WO6 。反应前后样品的衍射峰高度一致,表明催化剂反应后能保持良好的结构稳定性。
图2
图2
催化剂反应前后的SEM照片
Fig. 2
SEM images of catalysts before and after the reaction
由图2 可见,催化剂材料由不规则纳米片状结构堆积而成,表面粗糙,厚度在30~40 nm。反应前后材料的表面和结构无明显变化,表明该材料能保持良好的稳定性。
由FT-IR表征结果可知,样品在580、730、1 380 cm-1 处的吸收峰可归因于Bi—O—Bi、W—O和W—O—W的伸缩振动〔7 〕 ,3 400、1 647 cm-1 的峰是水分子的羟基振动所致。红外表征结果进一步证明Bi2 WO6 光催化材料的成功合成,且反应前后峰未出现明显变化,表明降解催化剂的活性位点完好,结构稳定。
2.2 不同体系中橙黄Ⅱ的降解效果
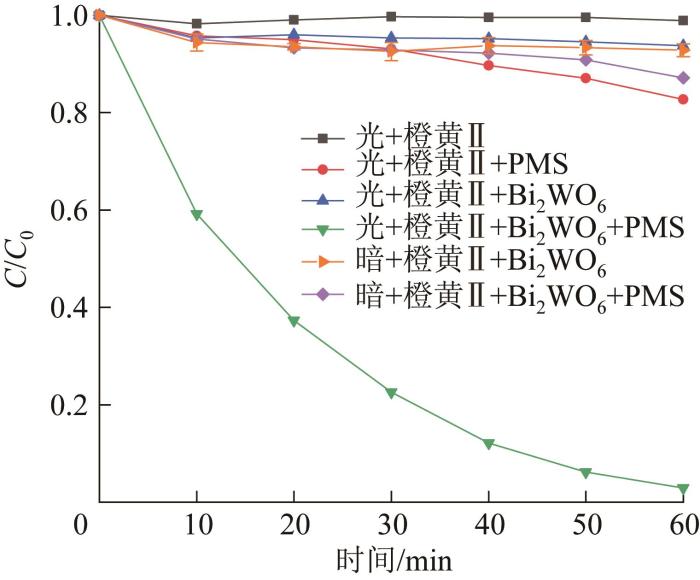
在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,考察60 min内不同体系对橙黄Ⅱ的降解效果,见图3 。
图3
图3
不同体系中橙黄Ⅱ的降解效果
Fig. 3
Degradation effect of orange Ⅱ in different systems
由图3 可知,光/Bi2 WO6 /PMS体系在60 min内对橙黄Ⅱ表现出优异的降解效果(>97%),而光照下仅有少量PMS被激活,光/PMS体系降解率为17.29%。Bi2 WO6 材料单独的光催化效果并不显著,且电子空穴复合率高,光/Bi2 WO6 体系的降解率为6.28%,远低于光催化Bi2 WO6 联合PMS体系。氙灯照射下橙黄Ⅱ表现出较强的稳定性,降解率为1.09%。无光条件下,Bi2 WO6 /PMS体系的降解率为12.89%,表明Bi2 WO6 无法通过电子转移激活PMS〔10 〕 。实验结果表明,在光/Bi2 WO6 /PMS体系中,光催化效率大幅提高并能有效激活PMS,二者协同作用产生大量活性物种,实现对橙黄Ⅱ的有效去除。
2.3 Bi2 WO6 投加量的影响
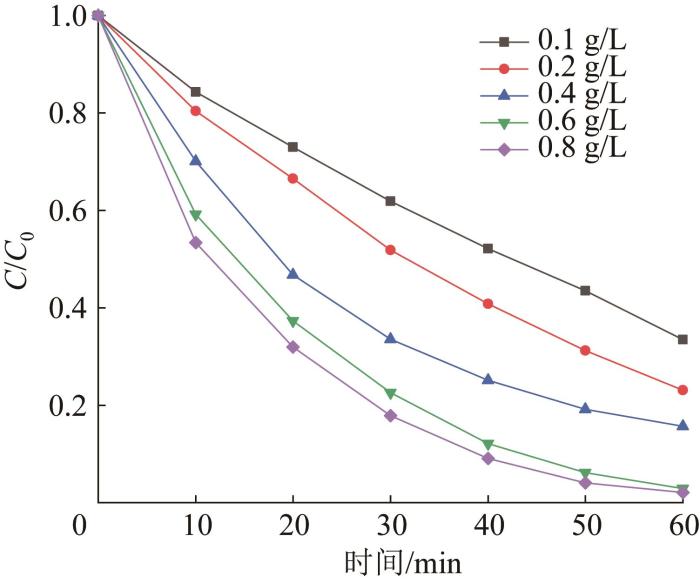
在光照、PMS投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,考察Bi2 WO6 投加量对降解效果的影响,结果如图4 所示。
图4
图4
Bi2 WO6 投加量对橙黄Ⅱ降解的影响
Fig. 4
Effects of Bi2 WO6 dosage on orange Ⅱ degradation
由图4 可知,随着Bi2 WO6 投加量从0.1 g/L增至0.6 g/L,橙黄Ⅱ降解率显著上升,这是由于催化剂提供的反应位点增加,体系生成的光生电子-空穴对和自由基增加,使得降解率升高〔11 〕 。当Bi2 WO6 投加量由0.6 g/L增至0.8 g/L时,橙黄Ⅱ降解率提升不明显,过量的催化剂会发生团聚和遮光现象,使反应速率提升有限,故选取Bi2 WO6 用量为0.6 g/L进一步研究。
2.4 PMS投加质量浓度的影响
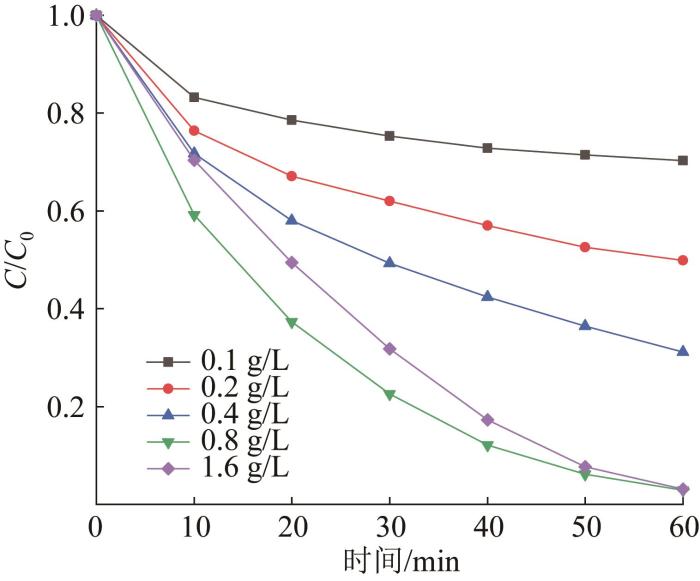
在光照、Bi2 WO6 投加量为0.6 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,探究PMS投加质量浓度对降解效果的影响,结果如图5 所示。
图5
图5
PMS投加质量浓度对橙黄Ⅱ降解的影响
Fig. 5
Effects of PMS mass concentration on orange Ⅱ degradation
由图5 可见,随着PMS由0.1 g/L增至0.8 g/L,橙黄Ⅱ降解率由29.68%逐渐升至97.11%,原因在于PMS增加后,体系中被激活产生的活性物质增多。当PMS增至1.6 g/L时,橙黄Ⅱ降解速率有所下降,反应60 min后降解率为 96.91%,是由于过量PMS会与活性物质发生猝灭反应,导致降解速率下降〔12 〕 。故后续实验选择PMS投加质量浓度为0.8 g/L。
2.5 溶液初始pH的影响
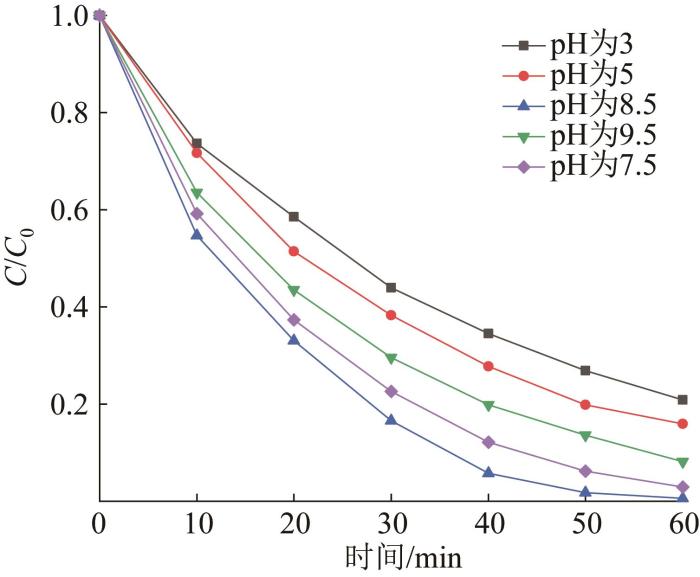
PMS在强碱性条件下(pH≥10)极易发生碱活化与橙黄Ⅱ反应〔13 〕 ,相同条件下,碱活化均相体系的降解速率要大于非均相体系。为排除碱活化PMS对降解效果的影响,设置最高pH为9.5。在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ质量浓度为10 mg/L的条件下,对比在不同初始pH下橙黄Ⅱ的降解效果,结果如图6 所示。
图6
图6
溶液初始pH对橙黄Ⅱ降解的影响
Fig. 6
Effects of initial pH on orange Ⅱ degradation
由图6 可知,光/Bi2 WO6 /PMS体系受溶液初始pH的影响:酸性条件下降解受到抑制,初始pH为3、5时60 min内降解率分别为79.16%、84.10%;碱性条件下橙黄Ⅱ降解率先上升后下降,初始pH为8.5、9.5时60 min内降解率分别为99.44%、91.90%。
PMS的pK a2 为9.4(pK a1 <0),在溶液中以阴离子形式存在。橙黄Ⅱ分子的pK a 为1,因存在磺酸基而在溶液中带负电〔14 〕 。酸性环境中,在静电作用下,表面带负电的Bi2 WO6 会与橙黄Ⅱ和HSO5 - 产生排斥,而中性和弱碱性环境中,带正电的Bi2 WO6 则会吸附橙黄Ⅱ和PMS,促进降解反应的进行。此外,Bi2 WO6 在酸性条件下会分解为H2 WO4 和Bi2 O3 〔15 〕 ,导致体系的光催化效率下降,而弱碱性条件有利于·OH的生成〔见式(1)〕〔16 〕 。鉴于体系在中性和弱碱性下都能有效降解橙黄Ⅱ,考虑到工程实际应用,选择不调节溶液初始pH进一步研究。
SO4 ·- +OH- → 4 2- +·OH(1)
2.6 不同体系中PMS消耗量
活化效率是反应经济性的重要参考,为进一步探究体系中PMS的活化效率,对比了不同体系中PMS的消耗量,结果见表1 。
由表1 可见,相较于其他体系,光/Bi2 WO6 /PMS体系中的PMS消耗量较高,60 min可达23.66%,光生电子激活PMS使其浓度明显下降。无光条件下,Bi2 WO6 /PMS体系中PMS消耗量约为9%,光/PMS体系中PMS消耗量约为5%。表明光催化Bi2 WO6 产生的电子-空穴对可以协同PMS活化分解,提升体系的氧化能力,从而实现对橙黄Ⅱ的有效去除。
2.7 共存离子和腐殖酸对橙黄Ⅱ降解的影响
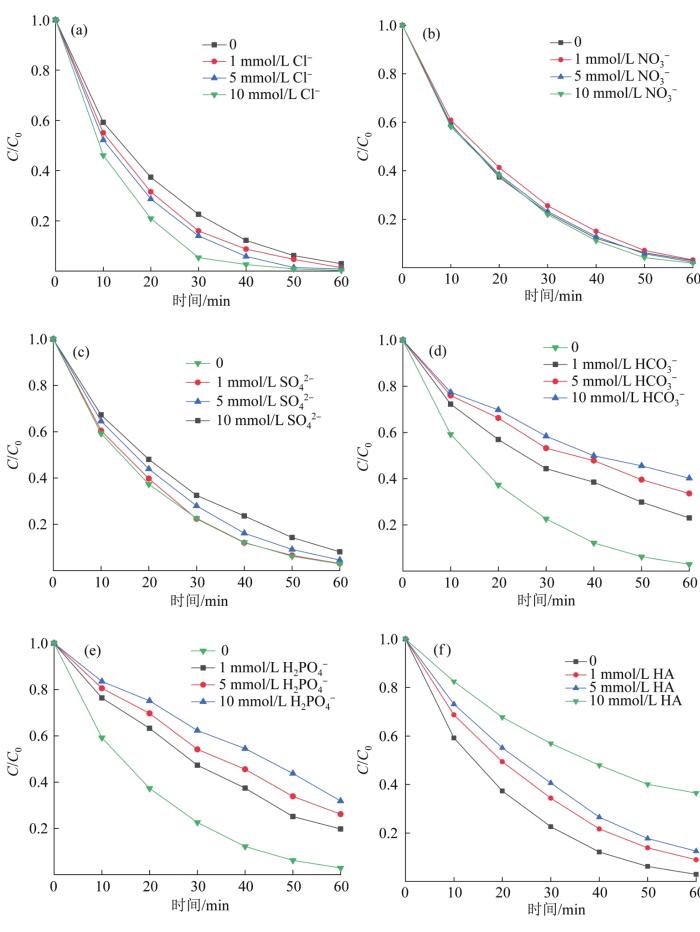
实际水体中往往含有无机阴离子Cl- 、NO3 - 、SO4 2- 、HCO3 - 、H2 PO4 - 和腐殖酸(HA)等天然成分,对橙黄Ⅱ降解存在影响。在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ质量浓度为10 mg/L的条件下,探究Cl- 、NO3 - 、SO4 2- 、HCO3 - 、H2 PO4 - 、HA对降解效果的影响,结果如图7 所示。
图7
图7
共存离子和腐殖酸对橙黄Ⅱ降解的影响
Fig.7
Effects of coexisting ions and humic acid on orange Ⅱ degradation
由图7 (a)可知,随着溶液中的Cl- 由0增至10 mmol/L,反应体系的降解速率逐渐加快,原因是Cl- 会与空穴反应生成Cl2 〔见式(2)〕,减少电子空穴对的复合,产生更多自由基。此外,Cl- 与PMS反应可生成对偶氮染料有很强脱色作用的HClO,加速橙黄Ⅱ的分解〔见式(3)〕〔17 〕 。但也有研究表明,过高浓度的Cl- 可与SO4 ·- 和·OH反应生成氧化还原电位更低的Cl2 ·- (2.1 eV)〔见式(4)~式(6)〕〔18 〕 。
2Cl- +2h+ → 2 (2)
Cl- +HSO5 - → 4 2- +HClO(3)
Cl- + SO4 ·- → 4 2- +·Cl,k =2.47×108 L·mol-1 ·s-1 (4)
Cl- +·OH→ - +·Cl,k =(6.1±0.8)×109 L·mol-1 ·s-1 (5)
·Cl+Cl- → 2 ·- (6)
由图7 (b)可知,当溶液中NO3 - 由0增至10 mmol/L时,降解率变化很小,变化范围在1.31%以内。高浓度NO3 - 能与SO4 ·- 和·OH反应生成氧化能力更弱的NO3 · 〔见式(7)、式(8)〕,但通常反应速率较低,所以对降解效果影响不大〔10 〕 。
·OH+ NO3 - → 3 ·+OH- ,k <5.5×105 L/(mol·s)(7)
SO4 ·- +NO3 - → 3 ·+SO4 2- ,k =5.5×105 L/(mol·s)(8)
由图7 (c)可见,当溶液中SO4 2- 由0增至10 mmol/L时,降解率可维持在较高水平,高浓度的SO4 2- 对橙黄Ⅱ降解有较轻的抑制作用,可归因于SO4 2- 与SO4 ·- 和·OH发生反应〔见式(9)〕〔11 〕 。
SO4 ·- +·OH+SO4 2- → 2 O8 2- +OH- (9)
由图7 (d)可见,当HCO3 - 由0增至10 mmol/L时,降解率由97.11%降至59.83%,表明HCO3 - 可显著地抑制橙黄Ⅱ的降解。这可以解释为HCO3 - 对SO4 ·- 和·OH的猝灭反应〔见式(10)、式(11)〕〔19 〕 。
HCO3 - +SO4 ·- → 3 ·+SO4 2- ,k =2.8×106 L/(mol·s)(10)
HCO3 - +·OH→ 3 ·- +H2 O,k =8.5×106 L/(mol·s)(11)
由图7 (e)可见,当溶液中的H2 PO4 - 由0增至10 mmol/L时,降解率由97.11%降至68.13%,阻碍橙黄Ⅱ的降解。原因在于H2 PO4 - 对金属具有螯合作用,可占据催化剂表面的反应位点〔20 〕 。此外,H2 PO4 - 也会与自由基发生反应〔见式(12)、式(13)〕〔19 〕 。
SO4 ·- +H2 PO4 - → 2 PO4 ·+SO4 2- (12)
·OH+H2 PO4 - → 2 PO4 ·+OH- (13)
由图7 (f)可见,溶液中的HA由0增至10 mmol/L时,体系降解率由97.11%逐渐降至63.54%,这是由于HA含有多种富电子基团,可与橙黄Ⅱ分子竞争自由基,导致反应速率下降。此外,HA浓度增加会对光辐射造成阻碍,也会限制光催化效率,减弱PMS的活化效果,使体系氧化能力下降〔21 〕 。
2.8 猝灭实验结果
为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验。选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 。TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 。
由表2 可见,分别添加BQ和LH猝灭O2 ·- 和1 O2 后,橙黄Ⅱ的降解率分别降至5.04%、13.66%,表明O2 ·- 和1 O2 在降解中起到主要作用。溶液中的O2 ·- 和1 O2 可能存在相互转化,协同实现对橙黄Ⅱ的降解〔21 〕 。加入Na2 C2 O4 后橙黄Ⅱ降解率降至26.49%,说明h+ 对橙黄Ⅱ的降解也起到重要作用。添加TBA后,橙黄Ⅱ降解率为68.68%,表明·OH在降解过程中发挥一定作用。添加MeOH后橙黄Ⅱ降解率为56.90%,相较于加入TBA的降解率,下降不明显,表明SO4 ·- 不是体系中的主要活性自由基。综上可知,体系中活性物种的贡献作用由大到小依次为O2 ·- >1 O2 >h+ >·OH>SO4 ·- 。
2.9 矿化度及电化学性能分析
总有机碳(TOC)是一项重要水质指标。为探究体系对橙黄Ⅱ的矿化程度,测定了最佳条件下反应60 min后体系中的TOC。结果显示,TOC由初始的3.62 mg/L降至2.93 mg/L,矿化率为19.06%,表明大部分橙黄Ⅱ被分解为小分子有机物,无法完全矿化为CO2 和H2 O。
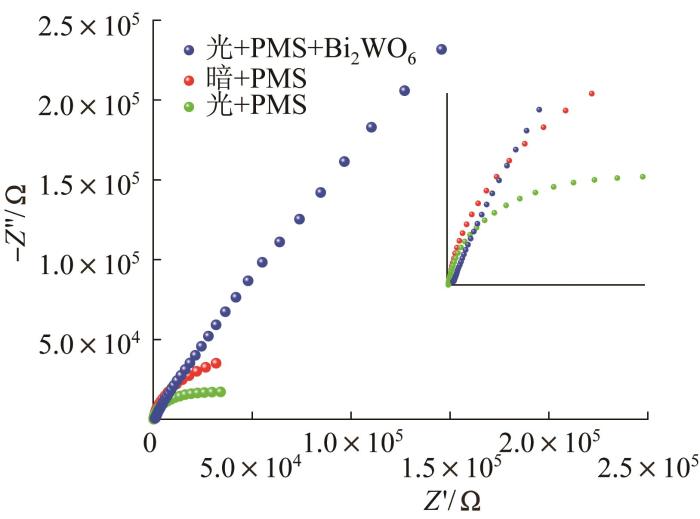
通过电化学工作站测定不同体系中的电子转移效率,得到3个体系的电化学阻抗谱,如图8 所示。
图8
图8
不同体系的电化学阻抗图谱
Fig. 8
Electrochemical impedance spectroscopy in different systems
由图8 可见,相比PMS均相体系,光/Bi2 WO6 /PMS非均相体系具有更长的圆弧半径,表明非均相体系的阻抗更强,电子传递效率相对较低〔19 〕 。而光照能有效加速PMS均相体系的电子转移,这是光/PMS体系能获得较好降解效果的原因。
2.10 材料重复利用性
催化剂稳定性对于实际应用至关重要,因此进一步探究了Bi2 WO6 催化剂的重复利用性。在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L,橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,以反应时间60 min为一个周期,反应结束后进行离心、洗涤、烘干,再次用于活化PMS降解橙黄Ⅱ的实验,结果如表3 所示。
由表3 可见,催化剂循环使用5次后,表现出良好的重复利用性和稳定性,对橙黄Ⅱ的降解率为90.97%。其催化活性有所下降可能是因为,材料的活性位点被中间产物占据以及分离洗涤过程中损失。
3 结论
(1)通过简单的水热法成功制备了Bi2 WO6 光催化材料,在光照条件下活化PMS降解橙黄Ⅱ溶液,在最佳实验条件下(Bi2 WO6 投加量0.6 g/L,PMS投加量0.8 g/L),对10 mg/L橙黄Ⅱ溶液的去除率可达97.11%,矿化率达19.06%。
(2)初始pH在7.5~9.5时,Bi2 WO6 联合PMS光催化体系表现出优异的去除率,弱碱性条件下(pH为8.5)效果最佳。溶液中的Cl- 可促进橙黄Ⅱ降解,NO3 - 对降解过程无影响,SO4 2- 、HCO3 - 、H2 PO4 - 和HA会抑制降解过程。
(3)猝灭实验结果表明,反应体系中起到主要作用的是O2 ·- 、1 O2 和h+ 。Bi2 WO6 在经过5次循环降解反应后,仍表现出较好的催化性能。
参考文献
View Option
[1]
SONWANI R K PANDEY S YADAV S K et al Construction of integrated system for the treatment of Acid orange 7 dye from wastewater:Optimization and growth kinetic study
[J]. Bioresour Technol ,2021 ,337 :125478 . doi:10.1016/j.biortech.2021.125478
[本文引用: 1]
[2]
LIU L CHEN Z ZHANG J et al Treatment of industrial dye wastewater and pharmaceutical residue wastewater by advanced oxidation processes and its combination with nanocatalysts:A review
[J]. Journal of Water Process Engineering ,2021 ,42 :102122 . doi:10.1016/j.jwpe.2021.102122
[本文引用: 1]
[3]
LIU Y YANG B HE H et al Bismuth-based complex oxides for photocatalytic applications in environmental remediation and water splitting:A review
[J]. Science of the Total Environment ,2022 ,804 :150215 . doi:10.1016/j.scitotenv.2021.150215
[本文引用: 1]
[4]
LAI M T L LAI C W LEE K M et al Facile one-pot solvothermal method to synthesize solar active Bi2 WO6 for photocatalytic degradation of organic dye
[J]. Journal of Alloys and Compounds ,2019 ,801 :502 -510 . doi:10.1016/j.jallcom.2019.06.116
[本文引用: 1]
[5]
GUO T JIANG L HUANG H et al Enhanced degradation of tetracycline in water over Cu-doped hematite nanoplates by peroxymonosulfate activation under visible light irradiation
[J]. Journal of Hazardous Materials ,2021 ,416 :125838 . doi:10.1016/j.jhazmat.2021.125838
[本文引用: 1]
[6]
ZHANG B ZHANG M ZHANG L et al BiOBr/MoS2 catalyst as heterogenous peroxymonosulfate activator toward organic pollutant removal:Energy band alignment and mechanism insight
[J]. Journal of Colloid and Interface Science ,2021 ,594 :635 -649 . doi:10.1016/j.jcis.2021.03.066
[本文引用: 1]
[7]
SHAO B LIU Z TANG L et al Construction of Bi2 WO6 /CoAl-LDHs S-scheme heterojunction with efficient photo-Fenton-like catalytic performance:Experimental and theoretical studies
[J]. Chemosphere ,2022 ,291 (3 ):133001 . doi:10.1016/j.chemosphere.2021.133001
[本文引用: 2]
[9]
HE Y WANG D LI X et al Photocatalytic degradation of tetracycline by metal-organic frameworks modified with Bi2 WO6 nanosheet under direct sunlight
[J]. Chemosphere ,2021 ,284 :131386 . doi:10.1016/j.chemosphere.2021.131386
[本文引用: 2]
[10]
SHEN Z ZHOU H PAN Z et al Degradation of atrazine by Bi2 MoO6 activated peroxymonosulfate under visible light irradiation
[J]. Journal of Hazardous Materials ,2020 ,400 :123187 . doi:10.1016/j.jhazmat.2020.123187
[本文引用: 2]
[11]
LIU Y GUO H ZHANG Y et al Fe@C carbonized resin for peroxymonosulfate activation and bisphenol S degradation
[J]. Environmental Pollution ,2019 ,252 :1042 -1050 . doi:10.1016/j.envpol.2019.05.157
[本文引用: 2]
[12]
LI D ZHAO Q LI H et al Synergetic effect of photocatalysis and peroxymonosulfate activated by ZnM2 O4 /SBA-15 (M=Fe and Mn) for enhanced degradation efficiency of doxycycline hydrochloride under visible light irradiation
[J]. Materials Today Communications ,2022 ,31 :103315 . doi:10.1016/j.mtcomm.2022.103315
[本文引用: 1]
[14]
LONG Y LI S YANG P et al Synthesis of ZIF-67 derived honeycomb porous Co/NC catalyst for AO7 degradation via activation of peroxymonosulfate
[J]. Separation and Purification Technology ,2022 ,286 :120470 . doi:10.1016/j.seppur.2022.120470
[本文引用: 1]
[16]
HU P LONG M Cobalt-catalyzed sulfate radical-based advanced oxidation:A review on heterogeneous catalysts and applications
[J]. Applied Catalysis B:Environmental ,2016 ,181 :103 -117 . doi:10.1016/j.apcatb.2015.07.024
[本文引用: 1]
[17]
WANG Z YUAN R GUO Y et al Effects of chloride ions on bleaching of azo dyes by Co2+ /oxone reagent:kinetic analysis
[J]. Journal of Hazardous Materials ,2011 ,190 (1/2/3 ):1083 -1087 . doi:10.1016/j.jhazmat.2011.04.016
[本文引用: 1]
[18]
SHEN Z ZHOU H ZHOU P et al Degradation of atrazine in water by Bi2 MoO6 and visible light activated Fe3+ /peroxymonosulfate coupling system
[J]. Journal of Hazardous Materials ,2022 ,425 :127781 . doi:10.1016/j.jhazmat.2021.127781
[本文引用: 1]
[19]
LÜ Y LIU Y WEI J et al Bisphenol S degradation by visible light assisted peroxymonosulfate process based on BiOI/B4 C photocatalysts with Z-scheme heterojunction
[J]. Chemical Engineering Journal ,2021 ,417 :129188 . doi:10.1016/j.cej.2021.129188
[本文引用: 3]
[20]
HU L ZHANG G LIU M et al Enhanced degradation of bisphenol A (BPA) by peroxymonosulfate with Co3 O4 -Bi2 O3 catalyst activation:Effects of pH,inorganic anions,and water matrix
[J]. Chemical Engineering Journal ,2018 ,338 :300 -310 . doi:10.1016/j.cej.2018.01.016
[本文引用: 1]
[21]
YAO J CHEN Z ZHANG H et al New insight into the regulation mechanism of visible light in naproxen degradation via activation of peroxymonosulfate by MOF derived BiFeO3
[J]. Journal of Hazardous Materials ,2022 ,431 :128513 . doi:10.1016/j.jhazmat.2022.128513
[本文引用: 2]
[22]
CHEN L YANG S ZUO X et al Biochar modification significantly promotes the activity of Co3 O4 towards heterogeneous activation of peroxymonosulfate
[J]. Chemical Engineering Journal ,2018 ,354 :856 -865 . doi:10.1016/j.cej.2018.08.098
[本文引用: 1]
[23]
JAWAD A LU X CHEN Z et al Degradation of chlorophenols by supported Co-Mg-Al layered double hydrotalcite with bicarbonate activated hydrogen peroxide
[J]. Journal of Physical Chemistry A ,2014 ,118 (43 ):10028 -35 . doi:10.1021/jp5085313
[本文引用: 1]
[24]
LI N LI R DUAN X et al Correlation of active sites to generated reactive species and degradation routes of organics in peroxymonosulfate activation by co-loaded carbon
[J]. Environmental Science & Technology ,2021 ,55 (23 ):16163 -16174 . doi:10.1021/acs.est.1c06244
[本文引用: 1]
[25]
LIU G YOU S TAN Y et al In situ photochemical activation of sulfate for enhanced degradation of organic pollutants in water
[J]. Environmental Science & Technology ,2017 ,51 (4 ):2339 -2346 . doi:10.1021/acs.est.6b05090
[本文引用: 1]
Construction of integrated system for the treatment of Acid orange 7 dye from wastewater:Optimization and growth kinetic study
1
2021
... 偶氮染料占合成染料总产量的60%以上〔1 〕 ,广泛用于工业中.橙黄Ⅱ是偶氮染料的典型代表,常用于纺织业、皮革业及印刷等领域,相关废水排放引发的环境问题不容忽视.常规的物理、生物法难以实现对橙黄Ⅱ印染废水的有效降解,高级氧化法是降解此类废水中有机物的有效手段.相较于传统的Fenton法,基于过硫酸盐的高级氧化法(SR-AOP)具有更高的氧化还原电位、更短的半衰期及更强的pH适应性,被广泛研究〔2 〕 .过一硫酸盐(PMS)的不对称结构更易被激活,可被紫外线、热、超声波、过渡金属及氧化物、碳基材料等活化,产生SO4 ·- 、·OH、O2 ·- 和1 O2 等活性物质. ...
Treatment of industrial dye wastewater and pharmaceutical residue wastewater by advanced oxidation processes and its combination with nanocatalysts:A review
1
2021
... 偶氮染料占合成染料总产量的60%以上〔1 〕 ,广泛用于工业中.橙黄Ⅱ是偶氮染料的典型代表,常用于纺织业、皮革业及印刷等领域,相关废水排放引发的环境问题不容忽视.常规的物理、生物法难以实现对橙黄Ⅱ印染废水的有效降解,高级氧化法是降解此类废水中有机物的有效手段.相较于传统的Fenton法,基于过硫酸盐的高级氧化法(SR-AOP)具有更高的氧化还原电位、更短的半衰期及更强的pH适应性,被广泛研究〔2 〕 .过一硫酸盐(PMS)的不对称结构更易被激活,可被紫外线、热、超声波、过渡金属及氧化物、碳基材料等活化,产生SO4 ·- 、·OH、O2 ·- 和1 O2 等活性物质. ...
Bismuth-based complex oxides for photocatalytic applications in environmental remediation and water splitting:A review
1
2022
... 钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 .但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题.研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 .PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用.B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%.然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少. ...
Facile one-pot solvothermal method to synthesize solar active Bi2 WO6 for photocatalytic degradation of organic dye
1
2019
... 钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 .但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题.研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 .PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用.B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%.然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少. ...
Enhanced degradation of tetracycline in water over Cu-doped hematite nanoplates by peroxymonosulfate activation under visible light irradiation
1
2021
... 钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 .但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题.研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 .PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用.B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%.然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少. ...
BiOBr/MoS2 catalyst as heterogenous peroxymonosulfate activator toward organic pollutant removal:Energy band alignment and mechanism insight
1
2021
... 钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 .但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题.研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 .PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用.B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%.然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少. ...
Construction of Bi2 WO6 /CoAl-LDHs S-scheme heterojunction with efficient photo-Fenton-like catalytic performance:Experimental and theoretical studies
2
2022
... 钨酸铋(Bi2 WO6 )由钙钛矿状的[WO4 ]2- 层和[Bi2 O2 ]2+ 堆叠组成〔3 〕 ,窄带隙、结晶度高、光响应敏感,是理想的光催化剂,能在可见光下氧化降解污染物〔4 〕 .但目前仅采用Bi2 WO6 光催化降解有机物仍存在光生电子-空穴复合率高、氧化能力难以满足要求等问题.研究表明,光催化产生的光生电子能够激活过硫酸盐和H2 O2 ,产生SO4 ·- 、O2 ·- 和·OH等物质〔5 〕 .PMS作为电子受体参与光催化反应时〔6 〕 ,可消耗光生电子,又能阻碍光生电子的复合,提高光催化效率,二者在体系中可起到良好的协同作用.B. SHAO等〔7 〕 制备了Bi2 WO6 /CoAl-LDHs异质结材料并建立光Fenton体系,对土霉素的降解率达到98.48%.然而, Bi2 WO6 联合PMS光催化降解印染废水的研究还较少. ...
... 由FT-IR表征结果可知,样品在580、730、1 380 cm-1 处的吸收峰可归因于Bi—O—Bi、W—O和W—O—W的伸缩振动〔7 〕 ,3 400、1 647 cm-1 的峰是水分子的羟基振动所致.红外表征结果进一步证明Bi2 WO6 光催化材料的成功合成,且反应前后峰未出现明显变化,表明降解催化剂的活性位点完好,结构稳定. ...
A rapid spectrophotometric determination of persulfate anion in ISCO
1
2008
... 降解反应在50 mL石英试管中进行.将石英试管置于光反应仪中,氙灯距离石英试管8 cm,灯周围有双层石英冷阱.取一定量Bi2 WO6 加入盛有50 mL橙黄Ⅱ溶液(10 mg/L)的石英试管中,除非特殊说明,溶液pH均未调整,在黑暗条件下搅拌30 min达到吸附-脱附平衡.取一定量的PMS加入石英试管中,开启500 W氙灯开始反应,间隔10 min抽取4 mL溶液,用0.45 μm水系滤膜过滤,用紫外-可见分光光度计在484 nm处测定溶液吸光度,计算橙黄Ⅱ降解率.PMS浓度测定采用改进碘量法〔8 〕 . ...
Photocatalytic degradation of tetracycline by metal-organic frameworks modified with Bi2 WO6 nanosheet under direct sunlight
2
2021
... 由图1 可见,制备的样品在28.30°、32.79°、47.14°、55.99°、58.54°处有5个特征峰,可归因于(131)、(200)、(202)、(133)、(262)平面结晶Bi2 WO6 (No. 39-0526)〔9 〕 ,说明成功制备出高纯度和结晶度的Bi2 WO6 .反应前后样品的衍射峰高度一致,表明催化剂反应后能保持良好的结构稳定性. ...
... 为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验.选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 .TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 . ...
Degradation of atrazine by Bi2 MoO6 activated peroxymonosulfate under visible light irradiation
2
2020
... 由图3 可知,光/Bi2 WO6 /PMS体系在60 min内对橙黄Ⅱ表现出优异的降解效果(>97%),而光照下仅有少量PMS被激活,光/PMS体系降解率为17.29%.Bi2 WO6 材料单独的光催化效果并不显著,且电子空穴复合率高,光/Bi2 WO6 体系的降解率为6.28%,远低于光催化Bi2 WO6 联合PMS体系.氙灯照射下橙黄Ⅱ表现出较强的稳定性,降解率为1.09%.无光条件下,Bi2 WO6 /PMS体系的降解率为12.89%,表明Bi2 WO6 无法通过电子转移激活PMS〔10 〕 .实验结果表明,在光/Bi2 WO6 /PMS体系中,光催化效率大幅提高并能有效激活PMS,二者协同作用产生大量活性物种,实现对橙黄Ⅱ的有效去除. ...
... 由图7 (b)可知,当溶液中NO3 - 由0增至10 mmol/L时,降解率变化很小,变化范围在1.31%以内.高浓度NO3 - 能与SO4 ·- 和·OH反应生成氧化能力更弱的NO3 · 〔见式(7) 、式(8) 〕,但通常反应速率较低,所以对降解效果影响不大〔10 〕 . ...
Fe@C carbonized resin for peroxymonosulfate activation and bisphenol S degradation
2
2019
... 由图4 可知,随着Bi2 WO6 投加量从0.1 g/L增至0.6 g/L,橙黄Ⅱ降解率显著上升,这是由于催化剂提供的反应位点增加,体系生成的光生电子-空穴对和自由基增加,使得降解率升高〔11 〕 .当Bi2 WO6 投加量由0.6 g/L增至0.8 g/L时,橙黄Ⅱ降解率提升不明显,过量的催化剂会发生团聚和遮光现象,使反应速率提升有限,故选取Bi2 WO6 用量为0.6 g/L进一步研究. ...
... 由图7 (c)可见,当溶液中SO4 2- 由0增至10 mmol/L时,降解率可维持在较高水平,高浓度的SO4 2- 对橙黄Ⅱ降解有较轻的抑制作用,可归因于SO4 2- 与SO4 ·- 和·OH发生反应〔见式(9) 〕〔11 〕 . ...
Synergetic effect of photocatalysis and peroxymonosulfate activated by ZnM2 O4 /SBA-15 (M=Fe and Mn) for enhanced degradation efficiency of doxycycline hydrochloride under visible light irradiation
1
2022
... 由图5 可见,随着PMS由0.1 g/L增至0.8 g/L,橙黄Ⅱ降解率由29.68%逐渐升至97.11%,原因在于PMS增加后,体系中被激活产生的活性物质增多.当PMS增至1.6 g/L时,橙黄Ⅱ降解速率有所下降,反应60 min后降解率为 96.91%,是由于过量PMS会与活性物质发生猝灭反应,导致降解速率下降〔12 〕 .故后续实验选择PMS投加质量浓度为0.8 g/L. ...
过一硫酸盐碱催化处理染料废水
1
2020
... PMS在强碱性条件下(pH≥10)极易发生碱活化与橙黄Ⅱ反应〔13 〕 ,相同条件下,碱活化均相体系的降解速率要大于非均相体系.为排除碱活化PMS对降解效果的影响,设置最高pH为9.5.在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ质量浓度为10 mg/L的条件下,对比在不同初始pH下橙黄Ⅱ的降解效果,结果如图6 所示. ...
Treatment of dye wastewater by base catalysis of peroxymonosulfate (PMS)
1
2020
... PMS在强碱性条件下(pH≥10)极易发生碱活化与橙黄Ⅱ反应〔13 〕 ,相同条件下,碱活化均相体系的降解速率要大于非均相体系.为排除碱活化PMS对降解效果的影响,设置最高pH为9.5.在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ质量浓度为10 mg/L的条件下,对比在不同初始pH下橙黄Ⅱ的降解效果,结果如图6 所示. ...
Synthesis of ZIF-67 derived honeycomb porous Co/NC catalyst for AO7 degradation via activation of peroxymonosulfate
1
2022
... PMS的pK a2 为9.4(pK a1 <0),在溶液中以阴离子形式存在.橙黄Ⅱ分子的pK a 为1,因存在磺酸基而在溶液中带负电〔14 〕 .酸性环境中,在静电作用下,表面带负电的Bi2 WO6 会与橙黄Ⅱ和HSO5 - 产生排斥,而中性和弱碱性环境中,带正电的Bi2 WO6 则会吸附橙黄Ⅱ和PMS,促进降解反应的进行.此外,Bi2 WO6 在酸性条件下会分解为H2 WO4 和Bi2 O3 〔15 〕 ,导致体系的光催化效率下降,而弱碱性条件有利于·OH的生成〔见式(1) 〕〔16 〕 .鉴于体系在中性和弱碱性下都能有效降解橙黄Ⅱ,考虑到工程实际应用,选择不调节溶液初始pH进一步研究. ...
普伐他汀的光催化降解性能及机理研究
1
2018
... PMS的pK a2 为9.4(pK a1 <0),在溶液中以阴离子形式存在.橙黄Ⅱ分子的pK a 为1,因存在磺酸基而在溶液中带负电〔14 〕 .酸性环境中,在静电作用下,表面带负电的Bi2 WO6 会与橙黄Ⅱ和HSO5 - 产生排斥,而中性和弱碱性环境中,带正电的Bi2 WO6 则会吸附橙黄Ⅱ和PMS,促进降解反应的进行.此外,Bi2 WO6 在酸性条件下会分解为H2 WO4 和Bi2 O3 〔15 〕 ,导致体系的光催化效率下降,而弱碱性条件有利于·OH的生成〔见式(1) 〕〔16 〕 .鉴于体系在中性和弱碱性下都能有效降解橙黄Ⅱ,考虑到工程实际应用,选择不调节溶液初始pH进一步研究. ...
Performance and mechanism of photocatalytic degradation of Pravastatin
1
2018
... PMS的pK a2 为9.4(pK a1 <0),在溶液中以阴离子形式存在.橙黄Ⅱ分子的pK a 为1,因存在磺酸基而在溶液中带负电〔14 〕 .酸性环境中,在静电作用下,表面带负电的Bi2 WO6 会与橙黄Ⅱ和HSO5 - 产生排斥,而中性和弱碱性环境中,带正电的Bi2 WO6 则会吸附橙黄Ⅱ和PMS,促进降解反应的进行.此外,Bi2 WO6 在酸性条件下会分解为H2 WO4 和Bi2 O3 〔15 〕 ,导致体系的光催化效率下降,而弱碱性条件有利于·OH的生成〔见式(1) 〕〔16 〕 .鉴于体系在中性和弱碱性下都能有效降解橙黄Ⅱ,考虑到工程实际应用,选择不调节溶液初始pH进一步研究. ...
Cobalt-catalyzed sulfate radical-based advanced oxidation:A review on heterogeneous catalysts and applications
1
2016
... PMS的pK a2 为9.4(pK a1 <0),在溶液中以阴离子形式存在.橙黄Ⅱ分子的pK a 为1,因存在磺酸基而在溶液中带负电〔14 〕 .酸性环境中,在静电作用下,表面带负电的Bi2 WO6 会与橙黄Ⅱ和HSO5 - 产生排斥,而中性和弱碱性环境中,带正电的Bi2 WO6 则会吸附橙黄Ⅱ和PMS,促进降解反应的进行.此外,Bi2 WO6 在酸性条件下会分解为H2 WO4 和Bi2 O3 〔15 〕 ,导致体系的光催化效率下降,而弱碱性条件有利于·OH的生成〔见式(1) 〕〔16 〕 .鉴于体系在中性和弱碱性下都能有效降解橙黄Ⅱ,考虑到工程实际应用,选择不调节溶液初始pH进一步研究. ...
Effects of chloride ions on bleaching of azo dyes by Co2+ /oxone reagent:kinetic analysis
1
2011
... 由图7 (a)可知,随着溶液中的Cl- 由0增至10 mmol/L,反应体系的降解速率逐渐加快,原因是Cl- 会与空穴反应生成Cl2 〔见式(2) 〕,减少电子空穴对的复合,产生更多自由基.此外,Cl- 与PMS反应可生成对偶氮染料有很强脱色作用的HClO,加速橙黄Ⅱ的分解〔见式(3) 〕〔17 〕 .但也有研究表明,过高浓度的Cl- 可与SO4 ·- 和·OH反应生成氧化还原电位更低的Cl2 ·- (2.1 eV)〔见式(4)~式(6) 〕〔18 〕 . ...
Degradation of atrazine in water by Bi2 MoO6 and visible light activated Fe3+ /peroxymonosulfate coupling system
1
2022
... 由图7 (a)可知,随着溶液中的Cl- 由0增至10 mmol/L,反应体系的降解速率逐渐加快,原因是Cl- 会与空穴反应生成Cl2 〔见式(2) 〕,减少电子空穴对的复合,产生更多自由基.此外,Cl- 与PMS反应可生成对偶氮染料有很强脱色作用的HClO,加速橙黄Ⅱ的分解〔见式(3) 〕〔17 〕 .但也有研究表明,过高浓度的Cl- 可与SO4 ·- 和·OH反应生成氧化还原电位更低的Cl2 ·- (2.1 eV)〔见式(4)~式(6) 〕〔18 〕 . ...
Bisphenol S degradation by visible light assisted peroxymonosulfate process based on BiOI/B4 C photocatalysts with Z-scheme heterojunction
3
2021
... 由图7 (d)可见,当HCO3 - 由0增至10 mmol/L时,降解率由97.11%降至59.83%,表明HCO3 - 可显著地抑制橙黄Ⅱ的降解.这可以解释为HCO3 - 对SO4 ·- 和·OH的猝灭反应〔见式(10) 、式(11) 〕〔19 〕 . ...
... 由图7 (e)可见,当溶液中的H2 PO4 - 由0增至10 mmol/L时,降解率由97.11%降至68.13%,阻碍橙黄Ⅱ的降解.原因在于H2 PO4 - 对金属具有螯合作用,可占据催化剂表面的反应位点〔20 〕 .此外,H2 PO4 - 也会与自由基发生反应〔见式(12) 、式(13) 〕〔19 〕 . ...
... 由图8 可见,相比PMS均相体系,光/Bi2 WO6 /PMS非均相体系具有更长的圆弧半径,表明非均相体系的阻抗更强,电子传递效率相对较低〔19 〕 .而光照能有效加速PMS均相体系的电子转移,这是光/PMS体系能获得较好降解效果的原因. ...
Enhanced degradation of bisphenol A (BPA) by peroxymonosulfate with Co3 O4 -Bi2 O3 catalyst activation:Effects of pH,inorganic anions,and water matrix
1
2018
... 由图7 (e)可见,当溶液中的H2 PO4 - 由0增至10 mmol/L时,降解率由97.11%降至68.13%,阻碍橙黄Ⅱ的降解.原因在于H2 PO4 - 对金属具有螯合作用,可占据催化剂表面的反应位点〔20 〕 .此外,H2 PO4 - 也会与自由基发生反应〔见式(12) 、式(13) 〕〔19 〕 . ...
New insight into the regulation mechanism of visible light in naproxen degradation via activation of peroxymonosulfate by MOF derived BiFeO3
2
2022
... 由图7 (f)可见,溶液中的HA由0增至10 mmol/L时,体系降解率由97.11%逐渐降至63.54%,这是由于HA含有多种富电子基团,可与橙黄Ⅱ分子竞争自由基,导致反应速率下降.此外,HA浓度增加会对光辐射造成阻碍,也会限制光催化效率,减弱PMS的活化效果,使体系氧化能力下降〔21 〕 . ...
... 由表2 可见,分别添加BQ和LH猝灭O2 ·- 和1 O2 后,橙黄Ⅱ的降解率分别降至5.04%、13.66%,表明O2 ·- 和1 O2 在降解中起到主要作用.溶液中的O2 ·- 和1 O2 可能存在相互转化,协同实现对橙黄Ⅱ的降解〔21 〕 .加入Na2 C2 O4 后橙黄Ⅱ降解率降至26.49%,说明h+ 对橙黄Ⅱ的降解也起到重要作用.添加TBA后,橙黄Ⅱ降解率为68.68%,表明·OH在降解过程中发挥一定作用.添加MeOH后橙黄Ⅱ降解率为56.90%,相较于加入TBA的降解率,下降不明显,表明SO4 ·- 不是体系中的主要活性自由基.综上可知,体系中活性物种的贡献作用由大到小依次为O2 ·- >1 O2 >h+ >·OH>SO4 ·- . ...
Biochar modification significantly promotes the activity of Co3 O4 towards heterogeneous activation of peroxymonosulfate
1
2018
... 为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验.选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 .TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 . ...
Degradation of chlorophenols by supported Co-Mg-Al layered double hydrotalcite with bicarbonate activated hydrogen peroxide
1
2014
... 为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验.选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 .TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 . ...
Correlation of active sites to generated reactive species and degradation routes of organics in peroxymonosulfate activation by co-loaded carbon
1
2021
... 为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验.选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 .TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 . ...
In situ photochemical activation of sulfate for enhanced degradation of organic pollutants in water
1
2017
... 为研究反应体系中产生的活性物质,在光照、催化剂投加量为0.6 g/L、氧化剂投加量为0.8 g/L、橙黄Ⅱ溶液质量浓度为10 mg/L的条件下,添加不同自由基清除剂进行猝灭实验.选取MeOH作为SO4 ·- (k =2.5×107 L/(mol·s))、·OH(k = 9.7×108 L/(mol·s))的猝灭剂〔22 〕 ,选取BQ作为O2 ·- 的猝灭剂(k =9.6×108 L/(mol·s))〔23 〕 ,选取LH作为1 O2 的猝灭剂(k =3.2×107 L/(mol·s))〔24 〕 ,选取Na2 C2 O4 作为h+ 的猝灭剂〔9 〕 .TBA与·OH的反应速率〔k =(3.8~7.6)×108 L/(mol·s)〕远高于SO4 ·- 〔k =(4.0~9.1)×105 L/(mol·s)),可作为·OH的猝灭剂〔25 〕 . ...






 津公网安备 12010602120337号
津公网安备 12010602120337号