目前,普遍认为污水除磷的生物途径主要是强化生物除磷(EBPR)过程,即依靠聚磷菌(PAOs)在好氧条件下吸收过量的磷酸盐贮存在细胞内,通过排放剩余污泥达到除磷的目的。
但当前针对GAOs反硝化作用机理的研究还不够深入,针对GAOs分支的分子生物学手段还需进一步开发,并且关于富集培养GAOs影响因素的研究尚不统一,因此加强对GAOs的深入研究对全面了解EBPR系统中的菌群分布和提高运行效果具有重要的意义。本研究结合近些年的相关文献,对GAOs及其分支进行简要概括,并对其反硝化作用机理以及富集培养的影响因素进行阐述,这有利于加深对EBPR系统中GAOs的了解,为提高EBPR系统的运行效果提供理论参考。
1 聚糖菌及其分支
在EBPR系统中发现GAOs的存在后,鉴定出大多数GAOs属于变形杆菌(Proteus),第一次明确分离鉴定出的GAOs微生物菌属是γ-变形菌(Gammaproteobacteria),将此类聚糖菌命名为CandidatusCompetibacterphosphatis〔3〕,简称Competibacter,在恶化的EBPR系统中此菌属约占总菌的35%,被证明是导致EBPR系统破坏的GAOs菌种之一。
此后,研究者发现了另一类GAOs微生物菌属,α-变形菌(Alphaproteobacteria),该菌属作为一种形成四分体的生物体(Tetrad-forming organisms,TFOs)与Defluvicoccusvanus密切相关。M. T. Wong等〔4〕在富含Alphaproteobacteria的小试反应器中发现,在此类Alphaproteobacteria总基因序列中,约有61%的16S rRNA基因序列与Defluvicoccusvanus菌属相关,并将此类Alphaproteobacteria命名为Cluster Ⅰ。R. L. Meyer等〔5〕同样利用小试反应器对GAOs进行高度富集,检测到另一种与Defluvicoccus菌属相关的16S rRNA基因序列,且此基因序列与Cluster Ⅰ序列仅有90%相同,此类Alphaproteobacteria被命名为Cluster Ⅱ。L. C. Burow等〔6〕根据在恶化的EBPR系统中检测到的单个16S rRNA序列,提出了Defluviicoccus菌属的第3个分支Cluster Ⅲ。M. T. Mcllroy等〔7〕通过从小试除磷反应器中获得的16S rRNA基因克隆文库数据,鉴定出了Defluviicoccus的第4个分支Cluster Ⅳ。Cluster Ⅰ、Cluster Ⅱ和Cluster Ⅳ都具有TFOs形态,而Cluster Ⅲ却是丝状菌形态并与活性污泥膨胀有关〔7〕。为研究GAOs的不同分支,相应的FISH探针被研究者设计出来,结果见表1。
表1 聚糖菌分支的常用探针
| 特异性 | 探针 | 序列(5’→3’) | FA/% | 参考文献 |
| Competibacter | GAOQ431 | TCCCCGCCTAAAGGGCTT | 35 | 〔3〕 |
| GAOQ989 | TTCCCCGGATGTCAAGGC | 35 | ||
| Cluster Ⅰ | TFO_DF218 | GAAGCCTTTGCCCCTCAG | 25~35 | 〔4〕 |
| TFO_DF618 | GCCTCACTTGTCTAACCG | 25~35 | ||
| Cluster Ⅱ | DF988 | GATACGACGCCCATGTCAAGGG | 35 | 〔5〕 |
| DF1020 | CCGGCCGAACCGACTCCC | 35 | ||
| Cluster Ⅲ | DF198 | ATCCCAGGGCAACATAGTCT | 35 | 〔8〕 |
| DF1013 | GAACTGAAGGCTCGAGTTTC | 35~50 | ||
| DF1004 | TAAGTTTCCTCAAGCCGC | 35 | ||
| Cluster Ⅳ | DF181A | CTTTCCCTCACAAGGCAC | 30 | 〔9〕 |
| DF181B | CTTTGCCCCTCAAGGCAC | 30 |
注:FA为甲酰胺质量分数。
当前关于GAOs及其分支的分子生物学研究大多采用FISH技术对基因序列进行相对定量分析,但设计专门针对聚合酶链式反应(PCR)和实时荧光定量核酸扩增检测系统(QPCR)的探针,利用PCR、QPCR等分子生物学手段对GAOs分支定量分析的研究还未见报道。此外,目前大多数研究针对的是Competibacter菌属及Defluviicoccus中的Cluster Ⅰ、Cluster Ⅱ分支,由于EBPR系统中Defluviicoccus中的Cluster Ⅲ和Cluster Ⅳ分支所占比例较小,故对这2个分支的研究尚不完善,具体基因功能还有待于进一步明确。
2 GAOs的反硝化代谢机理
反硝化作用是指在缺氧或厌氧条件下,具有反硝化功能的细菌利用硝酸盐或亚硝酸盐作为电子受体,通过不同反硝化还原酶的作用,将硝酸盐或亚硝酸盐逐步转化为NO、N2O并最终转变为N2的过程。
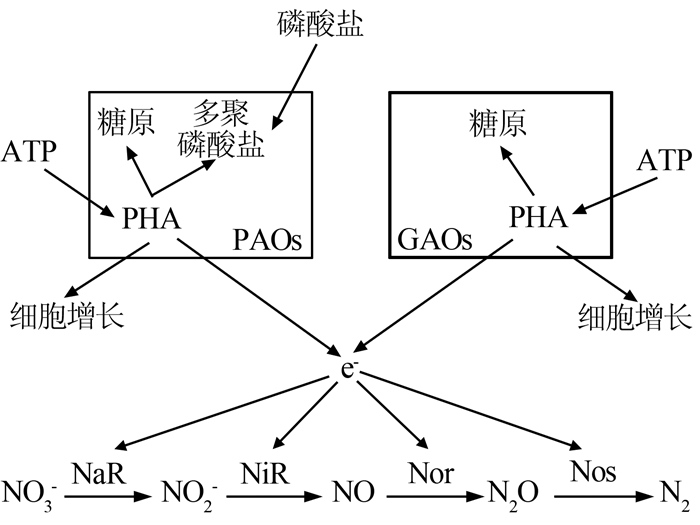
图1
DGAOs的脱氮过程与反硝化聚磷菌(DPAOs)的不同之处,除了脱氮系统中存在亚硝酸盐积累外,还在于在缺氧阶段反硝化的最终产物主要是N2O而不是N2。N2O的积累与氧化亚氮还原酶(NoS)的活性密切相关,亚硝酸盐和N2O的同时积累表明,亚硝酸盐可能对DGAOs的NoS具有抑制作用〔16〕,这也是在DPAOs中未观察到的。目前,造成N2O积累的原因尚不明确,需要做进一步的研究分析。
DGAOs和GAOs在糖原生成和细胞生长过程中对PHA的使用存在差异〔17〕。在富集DGAOs的反应器中,缺氧阶段消耗的PHA,63%用于生成糖原,仅有10%用于细胞生长;而在富集GAOs的反应器中,在好氧阶段消耗的PHA,70%用于生成糖原,22%用于细胞生长。相比GAOs,DGAOs多消耗19%的PHA用于生成能量,而DGAOs与GAOs保持相近的用于糖原生成的PHA使用水平,这导致DGAOs系统中较少的PHA用于细胞生长,使富集DGAOs的反应器中的生物量比富集GAOs的反应器低得多。
显然,并不是GAOs的所有分支都具有反硝化功能,Competibacter包含的7个进化分支(GB1~GB7)中,GB1、GB4、GB5具有以硝酸盐氮作为电子受体的反硝化功能,而GB6的反硝化功能以硝酸盐氮和亚硝酸盐氮作为电子受体,GB3、GB7则没有反硝化功能〔6, 12〕,GB2可能由于在EBPR系统中并不发挥作用,并且其数量极少甚至未被检测到,目前GB2的具体功能还未有研究报道。J. M. Kim等〔18〕在EBPR系统中发现了一种之前未知的GB新分支(GB8),但目前还未有关于GB8分支具体功能的相关报道。Defluviicoccus包含的Cluster Ⅰ~Cluster Ⅳ这4个进化分支中,Cluster Ⅰ的反硝化功能是以硝酸盐氮作为电子受体,Cluster Ⅱ不具备反硝化功能,而对于Cluster Ⅲ和Cluster Ⅳ的具体功能目前尚不明确〔13〕。
3 GAOs生长富集的影响因素
GAOs与PAOs不同,其生长的环境需要较高的碳磷比(C/P),正常需要维持进水C/P≥50。同时,碳源、pH、温度等也能够显著影响GAOs的富集培养。
3.1 碳源
上文提到,PAOs与GAOs的代谢途径非常类似,因此二者会对废水中碳源进行争夺。目前,探究PAOs和GAOs碳源竞争机制的研究多以乙酸、丙酸和葡萄糖这3种碳源为主。其中,乙酸在EBPR系统中最受欢迎,在高负荷的乙酸冲击下,EBPR系统中的PAOs会失去竞争优势,而GAOs则逐渐占据主导地位。但也有报道称,在以乙酸为碳源的EBPR系统中,PAOs通常占据主导地位,这是由于磷酸盐累积代谢(PAM)主导培养物的乙酸摄取率高于糖原累积代谢(GAM)主导培养物〔19〕。L. C. Burow等〔20〕也证明了富集培养的Defluviicoccus的乙酸摄取率低于富集培养的Accumulibacter。虽然乙酸是否有利于GAOs的富集还未达成共识,但是目前关于GAOs富集的研究仍多以乙酸作为碳源〔5, 17〕。
葡萄糖及其聚合物(如淀粉或蔗糖)也通常存在于生活污水中,并在与底物利用相关的生化机制中起主要作用。PAOs不能在厌氧条件下直接利用葡萄糖,因为葡萄糖需先转化为短链脂肪酸(SCFA)才能被PAOs吸收。当葡萄糖作为唯一碳源时,其可直接诱导GAOs的糖原代谢,在促进GAOs生长的同时抑制PAOs的生长,导致EBPR系统出水水质的恶化。但也有研究认为,葡萄糖作为主要有机底物时,可以保持稳定的EBPR运行性能,GAOs也没有明显的增长〔24〕。目前关于葡萄糖是否有利于GAOs富集的观点相互矛盾,尚需进一步的研究。
3.2 pH
pH是EBPR系统中影响磷酸盐去除效率的关键性因素。pH是通过影响PAOs和GAOs之间的微生物竞争进而影响EBPR系统的除磷效率,较高的pH有利于PAOs的无氧代谢,通过增加多磷酸盐的降解以提高VFAs的摄取率,以及通过降低GAOs的厌氧底物(例如乙酸盐)摄取率来抑制GAOs的生长,较高的pH(7.5~8.5)会对EBPR系统除磷产生积极的影响〔25-26〕。控制EBPR系统中GAOs的生长可以通过调节pH来实现。C. D. M. Filipe等〔27〕通过厌氧条件下GAOs对乙酸摄取的化学计量代谢模型发现,当模型pH在6.5~8.0范围时,GAOs的PHA积累能力和糖原的降解性能与pH呈正相关性。在较低的pH(6.5~7.0)条件下,糖原消耗较pH介于7.5~8.5时更低且能更快吸收乙酸,说明在厌氧段pH较低(至少≤7.0)时,更有利于GAOs的富集培养。
C. D. M. Filipe等〔28〕又进一步研究了好氧条件下较低pH对PAOs和GAOs的影响,结果表明:PAOs对好氧区pH的变化相当敏感,PAOs的吸磷速率、PHA的降解和生物量的生长均会受到好氧区pH的影响;而GAOs对好氧区的pH变化并不敏感,当pH在6.5~7.5时,GAOs的糖原生成率、PHA降解率和生物量生长率仅略有变化。因此保持好氧区的pH小于7.0,同样会提高GAOs的富集效率。
在较低的pH条件下,GAOs比PAOs具有更快的乙酸吸收速率和糖原消耗速率。EBPR系统中厌氧段和好氧段的pH均保持在7.0以下时,更有利于GAOs的富集生长。
3.3 温度
温度对GAOs代谢过程的影响原因相当复杂,不但因为涉及的大多数代谢反应发生在细胞内储存的聚合物(如PHA和糖原)上,而且还因为GAOs在厌氧和好氧条件下对温度的依赖性不同。C. M. Lopez-Vazquez等〔29-30〕发现在20~35 ℃时,处于厌氧阶段的GAOs较PAOs更具明显的代谢优势,随后其又探究了10~40 ℃条件下温度对Competibacter好氧代谢的影响,发现当温度处于10~30 ℃时,Competibacter的好氧代谢对温度变化不敏感,而当温度高于30 ℃时,Competibacter的好氧代谢有所降低,表明在好氧段Competibacter所需的环境温度不宜过高。
GAOs较PAOs更加嗜热,对于GAOs的富集培养应在较高温度条件下进行,最适温度在厌氧段应调控在20 ℃以上,但不宜超过35 ℃,在好氧段应不宜超过30 ℃。
3.4 其他影响因素
3.4.1 污泥龄(SRT)
3.4.2 DO
在较低的DO(0.5 mg/L)下,PAOs较GAOs具有更高的氧气亲和力,当DO从8 mg/L降至2 mg/L时,EBPR系统中Accumulibacter的数量明显增加,而Competibacter的数量则迅速降低〔32〕,可见较高的DO有利于GAOs的生长。但目前并没有研究给出GAOs富集培养所需的最佳DO浓度,需做进一步的研究。
3.4.3 水力停留时间(HRT)
HRT同样会影响GAOs的富集培养。延长EBPR系统好氧段HRT会促进GAOs的增殖,而抑制了PAOs的生长,从而导致系统除磷性能的恶化。系统好氧区HRT的延长,往往会伴随着系统好氧阶段磷的二次释放,导致PAOs细胞内磷酸盐含量降低,PAOs对VFAs的利用也相应地减少,更多的VFAs被GAOs利用促进细胞增殖,从而达到GAOs富集培养的目的。
4 展望
目前针对GAOs的研究大多数是探究其与PAOs之间的竞争机制和影响因素的差异。但是由于环境或人为因素等多方面的影响,EBPR系统的实际运行与这些研究结果并不一致,为了更好地描述GAOs在EBPR系统中的作用机理,今后需要在以下方面开展研究:(1)GAOs和PAOs代谢途径类似,PAOs分支早已被设计出QPCR技术的相关引物进行定量分析,却没有研究者利用QPCR分子生物学手段对GAOs分支进行定量分析,故能否设计出GAOs分支的QPCR引物成为当前要解决的关键问题;(2)某些影响GAOs富集生长的影响因素及其作用机理尚不明确,需要做进一步地研究明确其富集培养的最适条件;(3)当部分GAOs分支的反硝化功能被发现前,通常认为EBPR系统中的GAOs是PAOs的竞争者,会影响系统的除磷性能,故对GAOs在EBPR系统中发挥积极作用的研究不足,目前关于GAOs的反硝化代谢机理的研究尚处于模糊阶段,需要做进一步的研究分析;(4)对GAOs菌群分支的反硝化功能的研究同样不完善,对Competibacter菌属中的GB2、GB8分支和Defluviicoccus菌属中的Cluster Ⅲ和Cluster Ⅳ这2个分支的具体功能还需进一步研究。
参考文献
The selective role of nitrite in the PAO/GAO competition
[J].DOI:10.1016/j.chemosphere.2013.06.006 [本文引用: 2]
Competition between polyphosphateand glycogen-accumulating organisms in enhanced-biological-phosphorusremoval systems:effect of temperature and sludge age
[J].
Glycogen-accumulating organisms in laboratory-scale and full-scale wastewater treatment processes B
[J].DOI:10.1099/00221287-148-11-3353 [本文引用: 3]
Identification and occurrence of tetrad-forming Alphaproteobacteria in anaerobic-aerobic activated sludge processes
[J].DOI:10.1099/mic.0.27291-0 [本文引用: 2]
Putative glycogen-accumulating organisms belonging to the Alphaproteobacteria identified through rRNA-based stable isoto-pe probing
[J].DOI:10.1099/mic.0.28445-0 [本文引用: 3]
Abundance and ecophysiology of Defluviicoccus spp., glycogen-accumulating organisms in fullscale wastewater treatment processes
[J].DOI:10.1099/mic.0.2006/001032-0 [本文引用: 2]
Ecophysiology of Defluviicoccus-related tetrad-forming organisms in an anaerobic-aerobic activated sludge process
[J].DOI:10.1111/j.1462-2920.2007.01267.x [本文引用: 2]
Candidatus Monilibacter spp., common bulking filaments in activated sludge, are members of Cluster Ⅲ Defluviicoccus
[J].DOI:10.1016/j.syapm.2009.07.003 [本文引用: 1]
Elucidating further phylogenetic diversity among the Defluviicoccus-related glycogen-accumulating organisms in activated sludge
[J].DOI:10.1111/j.1758-2229.2009.00082.x [本文引用: 1]
A critical assessment of the microorganisms proposed to be important to enhanced biological phosphorus removal in full-scale wastewater treatment systems
[J].DOI:10.3389/fmicb.2017.00718 [本文引用: 1]
Genomic and in situ analyses reveal the Micropruina spp. as abundant fermentative glycogen accumulating organisms in enhanced biological phosphorus removal systems
[J].DOI:10.3389/fmicb.2018.01004 [本文引用: 1]
Ecophysiology of a group of uncultured Gammaproteobacterial glycogen-accumulating organisms in full-scale enhanced biological phosphorus removal wastewater treatment plants
[J].DOI:10.1111/j.1462-2920.2005.00914.x [本文引用: 2]
Post-endogenous denitrification and phosphorus removal in an alternating anaerobic/oxic/anoxic(AOA) system treating low carbon/nitrogen(C/N) domestic wastewater
[J].DOI:10.1016/j.cej.2018.01.096 [本文引用: 2]
Advanced nitrogen removal via nitrite using stored polymers in a modified sequencing batch reactor treating landfill leachate
[J].DOI:10.1016/j.biortech.2015.05.013 [本文引用: 1]
Reduction of N2O and NO generation in Anaerobic-Aerobic(low dissolved oxygen) biological wastewater treatment process by using sludge alkaline fermentation liquid
[J].
Distinctive denitrifying capabilities lead to differences in N2O production by denitrifying polyphosphate accumulating organisms and denitrifying glycogen accumulating organisms
[J].DOI:10.1016/j.biortech.2016.07.092 [本文引用: 2]
Identification of a novel subgroup of uncultured gammaproteobacterial glycogen-accumulating organisms in enhanced biological phosphorus removal sludge
[J].DOI:10.1099/mic.0.047779-0 [本文引用: 1]
Multi-cycle operation of enhanced biological phosphorus removal(EBPR) with different carbon sources under high temperature
[J].DOI:10.1016/j.watres.2017.02.051 [本文引用: 1]
Bioenergetic models for acetate and phosphate transport in bacteria important in enhanced biological phosphorus removal
[J].
Bacterial diversity and community structure of denitrifying phosphorus removal sludge in strict anaerobic/anoxic systems operated with different carbon sources
[J].
Comparison of acetate and propionate uptake by polyphosphate accumulating organisms and glycogen accumulating organisms
[J].DOI:10.1002/bit.20500 [本文引用: 1]
Denitrifying sulfur conversionassociated EBPR:Effects of temperature and carbon source on anaerobic metabolism and performance
[J].DOI:10.1016/j.watres.2018.04.028 [本文引用: 1]
Biochemical model of glucose induced enhanced biological phosphorus removal under anaerobic condition
[J].
Anaerobic phosphate release from activated sludge with enhanced biological phosphorus removal. A possible mechanism of intracellular pH control
[J].DOI:10.1002/(SICI)1097-0290(19990605)63:5<507::AID-BIT1>3.0.CO;2-A [本文引用: 1]
Denitrifying sulfur conversion-associated EBPR:The effect of pH on anaerobic metabolism and performance
[J].DOI:10.1016/j.watres.2017.07.020 [本文引用: 1]
A metabolic model for acetate uptake under anaerobic conditions by glycogen accumulating organisms:Stoichiometry, Kinetics, and the effect of pH
[J].DOI:10.1002/bit.1022 [本文引用: 1]
Effects of pH on the rates of aerobic metabolism of phosphate-accumulating and glycogen-accu mulating organisms
[J].DOI:10.2175/106143001X139191 [本文引用: 1]
Short-term temperature effects on the anaerobic metabolism of glycogen accumulating organisms
[J].DOI:10.1002/bit.21302 [本文引用: 2]
Temperature effects on the aerobic metabolism of glycogen-accumulating organisms
[J].DOI:10.1002/bit.21892 [本文引用: 2]
Toward better understanding of EBPR systems via linking raman-based phenotypic profiling with phylogenetic diversity
[J].





 津公网安备 12010602120337号
津公网安备 12010602120337号