活性染料分子结构复杂且极为稳定,具有抗光、抗酸、抗碱等特性,通常溶于水,在诸多行业中应用广泛,大部分为难降解有毒有机物,具有致畸、致癌、致突变等作用〔1-3〕。因此,对活性染料生产与使用中产生的废水进行处理就显得尤为重要,目前,活性染料废水的脱色和处理主要有物理、化学和生物方法,其中物理和化学的方法脱色效果较差,处理成本较高,而且应用范围狭窄,而生物法具有易操作、高效、低成本、无二次污染等特点,得到广泛应用〔4〕。获取高效的染料降解菌是生物处理法的重要基础,近年来,对染料降解菌的研究主要集中在白腐真菌、酵母菌、细菌上,而对霉菌的研究还不够深入[5-6〕,霉菌菌丝发达,生长迅速,形成菌丝球极易沉降,有较宽的pH耐受范围,有一定的机械强度,吸附能力强,无需载体,可直接应用于固定床或流化床等反应器通过吸附处理染料废水〔7-8〕,具有很多先天优势,但目前开发应用不足。因此本课题从印染废水中筛选脱色霉菌,并对多种活性染料进行脱色试验,以筛选出脱色范围较广与脱色能力较优的霉菌,并对优势脱色霉菌的脱色特性进行研究,为实际应用奠定一定的研究基础。
1 材料与方法
1.1 菌株及试剂
脱色霉菌:分离筛选于合肥某印染厂废水。
活性染料,工业级,甲醇,色谱级;虎红标准样品:质量分数≥98.0%;均采购于上海生物工程有限公司。
马丁氏培养基:葡萄糖 12.0 g,蛋白胨4.5 g,KH2PO4 1.2 g,MgSO4·7H2O 0.6 g,琼脂18~25 g,1/300孟加拉红1 mL,蒸馏水1 000 mL,pH自然,0.1 MPa灭菌30 min。
1.2 仪器与设备
Beckman Allegra 64R高速冷冻离心机,美国贝克曼库尔特有限公司;UV-2100双光束紫外可见光分光光度计,北京瑞利分析仪器有限公司;7890B-5977A色相质谱色谱联用仪,美国安捷伦科技有限公司。
2 试验方法
2.1 脱色霉菌的分离筛选及形态观察
采集印染厂废水稀释103倍,吸取稀释液0.1 mL涂布于马丁氏固体培养基表面,28 ℃培养72 h,对生长出的菌落进行多次纯化,观察纯化的霉菌菌落与孢子形态,并制作斜面,保藏备用。
2.2 筛选霉菌对活性染料的脱色效果
选取不同结构类型的活性染料26种,以每100 mL中加入50 mg制成马丁氏活性染料培养液。无菌水冲洗保藏菌株的斜面,制成1×106 mL-1浓度的孢子悬液,分别吸取1 mL孢子悬液接种到不同的马丁氏活性染料培养液中,每组做3个平行1个对照,在28 ℃、转速120 r/min的条件下振荡培养72 h,进行脱色试验,在活性染料对应的最大吸收波长下测量吸光度,计算脱色率。依据脱色率分析筛选霉菌的脱色效果与脱色范围,并进一步筛选优势脱色霉菌,以进行后续试验。
2.3 优势脱色菌株对活性染料脱色机理的研究
经过初步脱色试验,选取菌株脱色率在50%以上的活性染料作为研究对象,接种1 mL浓度为1×106 mL-1的优势菌株的孢子悬液于100 mL 0.05%活性染料培养液中,28 ℃、120 r/min连续振荡培养120 h,每隔24 h进行观察,宏观判断脱色过程。分别收集脱色前(未加菌)和脱色后的培养液,在10 000 r/min条件下离心10 min,取上清液,利用紫外可见分光光度计在200~800 nm范围内进行扫描,分析脱色前后波谱的变化状况;取脱色前后高速离心的上清液,真空冷冻干燥制成粉末,溶解在色谱甲醇中,10 000 r/min条件下离心10 min,用0.45 μm 微孔滤膜过滤后用于GC-MS分析。采用Trace GC Ultra和ISQ Ⅱ MS对脱色产物进行分析,GC-MS柱为TG-35 ms的石英毛细管柱,柱温设定从100 ℃程序升温至300 ℃(10 ℃/min),运行时间保持10 min;载气(氦气)流速为1 mL/min;注射器和检测器温度为300 ℃,脱色产物的质谱分析在EI模式、70 eV条件下进行满扫。
2.4 优势脱色菌株的分子鉴定
经脱色效果与机理的研究,选取脱色效果最优的菌株进行基因测序,明确其种属,为后续研究奠定基础。
(1)霉菌DNA的提取与聚合酶链反应(PCR)扩增采用真菌试剂盒提取菌株 DNA 基因组,真菌试剂盒购自上海生物工程公司。根据真菌 18S rDNA 保守区设计引物,上游引物PA:(5'-GTAGTC⁃ATATGCTTGTCTC- 3')和下游引物PB:(5'-TCCG⁃CAGGTTCACCTACGGA-3'),由上海生物工程公司合成,采用真菌常规的PCR反应程序进行。
(2)系统发育分析,将扩增产物送至上海生物工程公司进行序列测定,将所测序列与NCBI GenBank数据库进行同源性分析;选择相应参比菌株序列,采用 MEGA 7.0 软件构建系统发育树。
2.5 脱色率的计算
脱色率计算公式:
式中:D——脱色率,%;
m0——初始OD;
mn ——脱色后的OD;
n——处理批次(n=0 1 2…n)。
3 试验结果
3.1 脱色霉菌的筛选
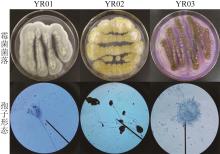
从印染厂的废水中分离筛选出3株霉菌,经过纯化传代培养,选取生长状态稳定的菌株作为研究对象,依次命名为YR01、YR02、YR03,霉菌菌落及孢子形态见图1(菌落与孢子形态上下对应)。
图1
由图1可知,3株菌菌落具有明显霉菌的特征,对菌丝进行染色显微观察,孢子形态符合青霉属、根霉属、曲霉属的特征。
3.2 筛选霉菌对活性染料的脱色效果
利用菌株YR01、YR02、YR03对26种活性染料进行单一降解试验,结果见表1。
表1 筛选霉菌对活性染料的脱色效果
Table 1
| 染料名称 | 结构类型 | 脱色率a/% | 脱色率b/% | 脱色率c/% | 染料名称 | 结构类型 | 脱色率a/% | 脱色率b/% | 脱色率c/% |
|---|---|---|---|---|---|---|---|---|---|
| 黄M-3RE | 一氯均三嗪乙烯砜 同侧单偶氮3钠盐 | 0.6±0.047 | 1.6±0.085 | 1.6±0.094 | 黑KN-B | 双乙烯砜型异侧 双偶氮染料4钠盐 | 5.5±2.005 | 10.1±3.112 | 12.6±1.96 |
| 深兰M-2GE | 一氯均三嗪乙烯砜 同侧双偶氮5钠盐 | 0.6±0.047 | 0.8±0.075 | 0.8±0.082 | 胭脂红 | 磺萘基单 偶氮3钠盐 | 1.1±0.216 | 42.6±6.069 | 51.4±7.847 |
| 藏青M-GD | 一氯均三嗪乙烯砜 异侧双偶氮3钠盐 | 0.8±0.058 | 15.2±1.575 | 52.8±2.16 | 甲酚红 | 苯偶氮奈酚 2钠盐 | 0.3±0.216 | 0.5±0 | 0.5±0.163 |
| 绿KE-4BD | 双一氯均三嗪型 异侧双偶氮6钠盐 | 55.8±1.575 | 53.2±1.987 | 75.2±0.589 | 甲基绿 | 氯化锌盐溴化物 三苯甲烷类 | 0.8±0.283 | 1.8±0.424 | 1.8±0.403 |
| 红KE-3G | 双一氯均三嗪型 同侧双偶氮3钠盐 | 1.2±0.294 | 1.1±0.245 | 1.2±0.34 | 丽春红2R | 苯基萘酚单 偶氮2钠盐 | 0.5±0.082 | 35.8±3.625 | 45.5±4.124 |
| 紫X-2R | 二氯均三嗪型 单偶氮2钠盐 | 1.5±0.216 | 1.5±0.374 | 1.8±0.163 | 日落黄 | 苯基萘酚单 偶氮2钠盐 | 0.3±0.216 | 14.3±1.283 | 15.3±0.92 |
| 红X-3B | 二氯均三嗪型 单偶氮2钠盐 | 0.5±0.116 | 0.8±0.316 | 0.5±0.134 | 孔雀绿 | 甲氨基三苯 甲烷类 | 0.05±0.022 | 0.02±0 | 0.05±0.008 |
| 橙X-GN | 二氯均三嗪型 单偶氮3钠盐 | 1.2±0.283 | 1.5±0 | 1.5±0.236 | 亚甲蓝 | 吩噻嗪-芳香 杂环类 | 1.2±0.432 | 1.5±0.163 | 1.5±0.082 |
| 嫩黄X-6G | 双二氯均三嗪异侧 单偶氮2钠盐 | 0.8±0.327 | 1.8±0.327 | 10.5±2.101 | 结晶紫 | 二甲氨基 三苯烷类 | 0.6±0.163 | 1.6±0.283 | 1.6±0.283 |
| 艳兰X-BR | 二氯均三嗪型醌 2钠盐 | 12.3±1.268 | 22.6±1.657 | 52.6±7.217 | 甲基橙 | 对二甲氨基单 偶氮苯磺酸钠 | 0.5±0.216 | 0.8±0.245 | 0.8±0.032 |
| 紫KN-4R | 乙烯砜型单 偶氮2钠盐 | 15.2±2.123 | 12.3±2.051 | 15.2±0.712 | 碱性 品红 | 苯氨基三苯烷类 | 1.5±0.294 | 1.2±0.094 | 1.2±0.287 |
| 艳兰K-NR | 乙烯砜型蒽醌类 2钠盐 | 0.5±0.245 | 0.6±0.17 | 0.8±0.082 | 曙红B | 二溴异苯并呋喃 氧蒽2钠盐 | 25±1.247 | 70.2±3.559 | 75±5.099 |
| 虎红 | 三苯烷氧蒽类 2钠盐 | 35.6±4.206 | 85.2±1.837 | 90.6±4.085 | 翠兰KN-G | 一氯均三嗪乙烯 砜铜酞菁2钠盐 | 32±7.784 | 62±3.3 | 65±4.19 |
由表1可知,除了在孔雀绿培养液中,3株霉菌均能在所选染料中生长,但形成菌球的能力有所差异,在染液中成球度强弱顺序为:YR03>YR02>YR01;3株霉菌对大部分所选活性染料脱色效果并不显著,尤其是对偶氮染料的处理,而对具有杂环氧蒽结构的染料降解效果较好。3株霉菌对虎红、藏青M-GD、曙红B、胭脂红、绿KE-4BD、翠兰KN-G、艳兰X-BR的脱色效果更为显著,菌株YR03对活性染料的脱色效率最高,因此对该菌株作进一步脱色研究。
3.3 菌株YR03脱色特性
图2
图2
菌株YR03对7种染料的脱色效果
Fig. 2
The decolorization effect of seven kinds of dye by strain YR03
图3
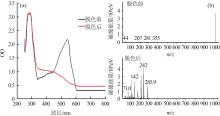
由于菌株YR03对虎红染料具有完全脱色的作用,因此对其脱色前后的染液进行处理,在200~800 nm紫外可见与GC-MS进行扫描,进一步了解脱色机理,结果见图4。
图4
图4
菌株YR03虎红脱色前后可见紫外吸收图谱(a)和GC-MS(b)
Fig. 4
UV-vis absorption(a) and GC-MS spectrum(b) of tiger red before and after decolorization by strain YR03
由图4(a)可知,300 nm前的脱色前后的图谱基本相似,250 nm前的苯环精细结构并没有变化,而脱色后在可见光区546 nm处的吸收峰完全消失,且没有形成其他明显的吸收峰,在350~450 nm处吸收峰有所升高,可能有新的物质生成,由此说明,虎红脱色后分子结构发生了变化,母体结构被破坏,引起虎红染料由红色变成无色,表明菌株YR03对虎红完全脱色是由生物降解引起的。
由图4(b)可知,虎红脱色前主要物质为虎红分子,相对分子质量为1 037,与虎红质谱图相仿,保留时间为9.116 min,而降解后主要检出相对分子质量为286,保留时间为6.205 min,其特征离子片段分别为36、71、107、142、177、214、242,脱色前后图谱发生明显变化,说明虎红分子被降解成相对分子更小的其他物质。
3.4 菌株YR03分子鉴定
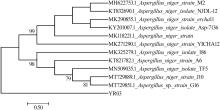
由于菌株YR03具有脱色范围广,脱色率高的优势,且对虎红染料能进行完全脱色,具有较高的研究价值。因此对其进行分子测序并构建系统发育树,以确定其种属,为后续研究提供一定的基础,结果见图5。
图5
4 讨论
霉菌因其获取容易、菌丝体生长快、可形成菌丝球、吸附脱色能力强等优点,在印染废水脱色、去除重金属污染、重金属回收等方面应用广泛〔9〕。霉菌中的青霉、曲霉、根霉较多地应用在染料废水的处理中,其中青霉菌球形成能力弱,根霉对低浓度染料脱色效果好,而曲霉的成球效果好,对高浓度染料具有较好的脱色效果〔10〕,本试验中也发现,黑曲霉对活性染料的脱色范围与脱色效果均要优于青霉与根霉属。目前利用细菌与白腐真菌对染料的脱色研究较深入,并且对于偶氮染料的降解研究较多,也已经发现是通过他们分泌的偶氮还原酶与木质素过氧化物酶对染料进行降解的,且染料上的基团对降解起着促进与抑制的作用〔11-12〕。本课题通过所筛选的霉菌对26种活性染料的脱色研究,发现对三苯烷类、偶氮类染料的脱色效果不佳,而对含有氧蒽类结构染料脱色较好,活性基团乙烯砜与侧链钠盐数量对脱色具有促进作用。染料一般经微生物吸附降解后,染料母体结构发生破坏,生成小分子物质,光谱吸收峰也发生明显改变〔13〕。所筛选的脱色霉菌对大部分活性染料的脱色均为吸附,仅有黑曲霉对虎红的脱色存在着吸附后的降解,利用可见紫外扫描黑曲霉对虎红脱色前后培养液,吸收光谱发生明显变化,546 nm下氧杂蒽结构的吸收峰消失,说明氧杂蒽结构被破坏;GC-MS分析脱色前后产物显示,染料的发色基团被破坏,生成更小的小分子物质,因此虎红被完全脱色,表明存在着酶降解过程,相关降解酶的参与以及降解过程中形成的小分子物质还需进一步研究。
参考文献
Use of Chlorrlla vulgaris for bioremediation of textile wastewater
[J].
微生物对三苯基甲烷类染料脱色的研究进展
[J].
Recent advice in microbiol decolorization of triphenylmethane dyes
[J].
Dyp⁃like peroxidases of the jelly fungus Auricularia auricular⁃judae oxidize nonphenolic lignin model compounds and high⁃redox potential dyes
[J].
Degradation and detoxification of the triphenylmethane dye malachite green catalyzed by crude manganese peroxidase from Irpexlacteus F17
[J].
Biodegradation of reactive dyes using soil fungal isolates and Ganoderma resinaceum
[J].
Packed bed column studies for the removal of synthetic dyes from textile wastewater using immobilized dead C. tropicalis
[J].
霉菌菌丝球WY 对酸性棕染料PR脱色研究
[J].
Decoloring effect of acid brown dye PR by mold pellet WY
[J].
高效染料降解真菌的分离及其在印染废水生物处理中的强化作用
[J].
Isolation and enhanced action of predominant fungi in biological treatment of dying wastewater
[J].
霉菌TM-3的成球条件及其对染料的吸附脱色研究
[J].
Study on pelletization conditions of mould TM-3 and the bio⁃absorption and decolourization for dyestuffs
[J].
虎红染料脱色霉菌的筛选及其脱色条件的优化
[J].
Screening of decolorization fungus to Rose-Bengal and optimization of decolorization conditions
[J].
一株新型苯胺蓝降解菌 MP-13 的代谢特征
[J].
Degradation characteristics of a novel aniline blue⁃discoloring bacterial strain MP-13
[J].
刺芹侧耳对孔雀石绿的脱色降解及其产物分析
[J].
Biodecolorization and biodegradation of malchite green by pleurolus eryngii and degradation products analysis
[J].
Investigation of reactive dye turquoise blue HFG removal with Lysinibacillus fusiformis B26 and detection of metabolites Fresenius
[J].







 津公网安备 12010602120337号
津公网安备 12010602120337号