羟基磷灰石〔Ca10(PO4)6(OH)2,HAP〕是一种磷酸盐矿物,作为生物材料具有无毒、低成本、易获得、环保、羟基含量丰富等优点,在水环境修复中显示出良好的应用前景。HAP对不同种类重金属的离子交换性能及对复杂有机材料的吸附能力出色,在含重金属废水的吸附法处理中具有巨大应用潜力〔3〕。我国是养殖业大国,每年在生产大量肉制品的同时产出大量动物骨骼,其中以猪骨的产量最大。
废弃猪骨是制备生物质羟基磷灰石的理想原料。使用废弃猪骨制备羟基磷灰石(HAP)作吸附剂,根据静态吸附实验,研究猪骨基羟基磷灰石(HAP)吸附铀的影响因素;用等温吸附模型、动力学方程拟合实验数据,并研究HAP对铀的吸附过程,通过扫描电镜、红外光谱和X射线衍射分析其吸附机理。
1 材料与方法
1.1 试剂与仪器
试剂:盐酸(0.1 mol/L)、NaOH(0.1 mol/L)、显色剂(酚酞、丙酮和Br-PADAP),均为市售分析纯。含铀废水由U3O8配制而成,具体配制方法见GBW04201。
仪器:pHS-3C型精密pH计,上海精密科学仪器有限公司雷磁仪器厂;CS101恒温鼓风干燥箱,重庆实验设备厂;UV-2450紫外分光光度计,SHIMADZU公司;JSM-7500F场发射扫描电镜(SEM),JEOL日本电子株式会社;ASAP2640型比表面与孔隙度分析仪,美国麦克仪器公司;傅里叶红外光谱仪(FT-IR),Nicolet公司;D8 X衍射仪(XRD),Bruker。
1.2 HAP制备
将猪骨用去离子水清洗,烘干后破碎成小块,放入球磨机研磨粉碎,过0.15 mm(100目)筛。将所得猪骨粉放入马弗炉空气氛中,500 ℃下灼烧4 h,冷却干燥后研磨成粉末,即得到猪骨基羟基磷灰石(HAP),用于吸附。
1.3 吸附试验
取50 mL一定浓度的铀标准溶液置于一系列150 mL锥形瓶内,用0.1 mol/L的NaOH和0.1 mol/L的HCl调节至所需pH。以测定不同条件下吸附剂对含铀废水的吸附效果,设定相应条件后将锥形瓶置于160 r/min恒温振荡器中,震荡相应时间后取出过滤,取5 mL上清液放入25 mL容量瓶内,用分光光度法测定铀的剩余浓度,每组实验重复2次取平均值。
2 结果与讨论
2.1 吸附时间对HAP吸附铀(Ⅵ)性能的影响
取100 mg/L铀标准溶液,调节pH至4.0,震荡速率为160 r/min,反应温度为25 ℃,吸附剂用量为0.01 g,考察吸附时间对HAP吸附铀(Ⅵ)性能的影响。实验结果表明,反应前10 min吸附量迅速增至402.85 mg/g;10~60 min吸附量增幅减小;反应至80 min时吸附量达到481.5 mg/g,与实验测得最大吸附量483.1 mg/g对比可知,吸附反应基本达到平衡状态。
2.2 pH对HAP吸附铀(Ⅵ)性能的影响
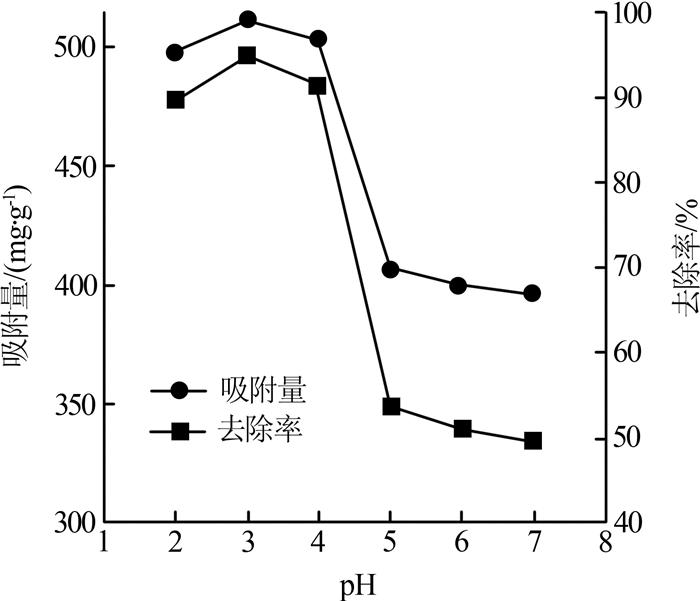
取100 mg/L铀标准溶液,吸附反应时间为90 min,震荡速率为160 r/min,HAP质量为10 mg,反应温度为25 ℃,考察pH对HAP的吸附性能的影响,如图 1所示。
图1
从图 1可以看出,体系pH对HAP的吸附性能影响较大,pH为2.0~7.0时,吸附量变化幅度大,pH为3.0时HAP的吸附容量达到最大值496.40 mg/g。
pH<4.0时,铀主要以UO22+形式存在;4.0 < pH < 6.0时,UO22+浓度迅速降低,铀主要以UO2OH+和UO22+形式存在;pH>7.0时,铀主要形态为(UO2)3(OH)5+。在pH < 2的酸性条件下,HAP部分溶解,≡P—O—和≡Ca—OH基团消耗H+,此时羟基磷灰石表面基团主要以≡P—OH、≡Ca—OH2+形式存在,吸附剂表面带正电,与H+产生竞争吸附,同时对UO22+产生静电排斥,不利于对UO22+的去除。溶液pH由2升至3时,正电荷间的竞争降低,其表面活性位点的负电性增强〔17〕,此时吸附剂以吸附UO22+为主。溶液初始pH为2~7时,反应平衡后溶液中的铀主要以(UO2)3(OH)5+和少量(UO2)4(OH)7+存在〔6〕,(UO2)3(OH)5+的形成对铀的去除起到一定作用。酸性条件下,HAP对UO22+的去除效果较好,吸附反应pH应在2~4。研究选择pH为4,此时铀的其他存在形态较少,且HAP对铀的去除能力足够高。
2.3 HAP投加量对吸附铀(Ⅵ)性能的影响
取100 mg/L铀标准溶液,在pH为4.0、震荡速率为160 r/min、吸附时间为120 min、反应温度为25 ℃,HAP用量分别为0.010、0.015、0.020、0.025、0.030 g条件下,考察HAP投加量对吸附效果的影响。
由实验结果可知,随着吸附剂投加量的增加,吸附量降低。这是因为吸附剂对溶液中的UO22+产生竞争吸附,导致HAP表面出现越来越多的不饱和活性位点,吸附容量下降。当溶液体积和初始吸附质浓度一定时,吸附剂投加量增加,吸附剂表面可用的活性位点增加,UO22+的去除率也随之增加〔7〕,但吸附质数量有限,导致吸附剂对吸附质的单位吸附量减少。当吸附剂投加量为0.002 g/mL时,对不同浓度UO22+的去除率均在80%以上;此后投加量增加,吸附量逐渐降低。为保证吸附剂对UO22+的去除效率和相对吸附容量最大,选择投加量为0.002 g/mL。
2.4 初始质量浓度对HAP吸附铀(Ⅵ)性能的影响
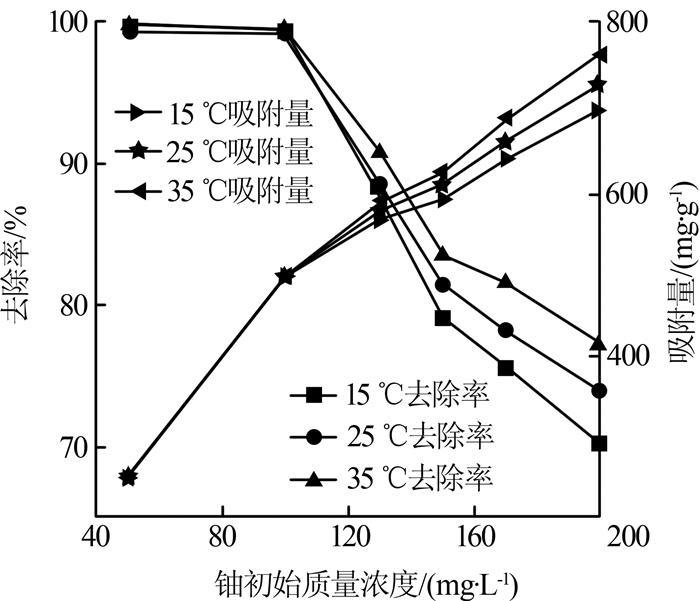
取质量浓度为50~200 mg/L的铀标准溶液,调节pH至4.0,震荡速率为160 r/min,吸附时间为90 min,吸附剂用量为0.01 g,考察铀质量浓度对吸附效果的影响,见图 2。
图2
由图 2可见,随着铀初始质量浓度的增加,HAP对UO22+的去除率逐渐降低。铀初始质量浓度在50~100 mg/L时,HAP对UO22+的去除率接近100%。初始质量浓度较低时,UO22+与HAP表面有效吸附位点或离子交换位点数量的比值较小,HAP表面能提供足够的吸附位点,因此低浓度下去除效果与初始质量浓度无关〔8〕。当初始质量浓度达到100 mg/L后,HAP对UO22+的去除率显著降低,此时,初始质量浓度是影响去除效果的主要因素。随着UO22+的增加,溶液传质驱动力及UO22+从本体溶液到颗粒表面的通过率增加,越来越多UO22+聚集在HAP表面活性位点附近,使吸附量增加。UO22+初始质量浓度较高时,单位质量HAP提供的吸附位点有限,吸附剂表面活性位点被充分占据,HAP吸附已接近饱和,去除率随之降低〔9〕。由图 2还可知,随着温度的升高,吸附量增加。可能是温度升高使吸附剂表面可利用的活性位点增多,吸附剂与吸附质之间的固液相界面传质速率提高,说明升温有利于吸附〔10〕。
2.5 等温吸附
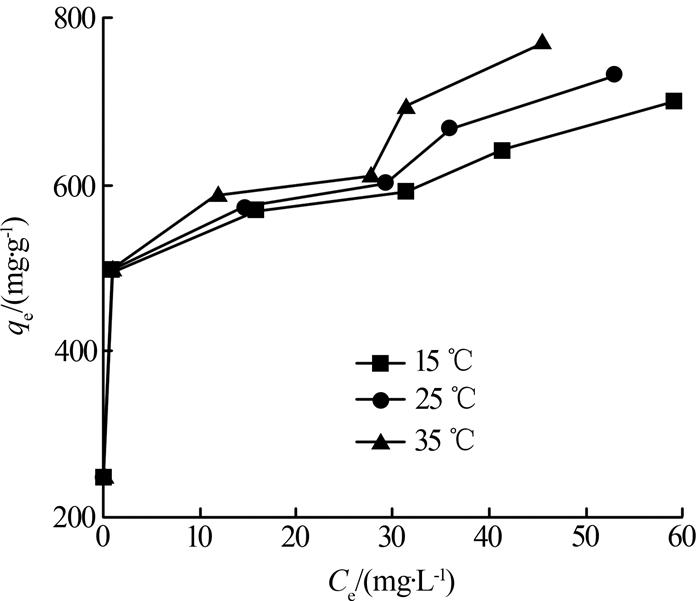
HAP对铀(Ⅵ)的等温吸附曲线如图 3所示。
图3
从图 3可知,吸附量qe随着溶液平衡质量浓度的升高而增加。HAP在15、25和35 ℃下的最大吸附量分别为689.65、724.64、746.27 mg/g,实际最大吸附量均大于理论最大吸附量。结合EDS能谱分析,可能是制备的HAP中混有由碳元素组成的生物炭,从而对吸附过程产生影响。单位质量的HAP与UO22+结合位点有限,随着溶液初始质量浓度的增加,吸附量增速逐渐放缓,去除率逐渐降低。HAP对UO22+的吸附量随温度的升高而增加,且增加效果显著。温度升高,体系中分子运动速率加快,传质速率和扩散系数增大,导致吸附量增加〔7〕。说明该材料对UO22+的吸附过程为吸热反应,升高温度可增强HAP对UO22+的去除能力。
采用Langmuir和Freundlich吸附等温模型对UO22+的等温吸附数据进行拟合。不同温度下的吸附方程参数如表 1所示。
表1 HAP吸附铀(Ⅵ)等温模型拟合参数
| T/℃ | Langmuir | Freundlich | |||||
| Ce/qe=Ce/qmax+1/KLqmax | lnqe=lnKF+lnCe/n | ||||||
| qmax/(mg·g-1) | KL/(L·mg-1) | R2 | KF/(mg·g-1) | 1/n | R2 | ||
| 15 | 689.65 | 0.571 | 0.990 | 318.71 | 0.132 | 0.789 | |
| 25 | 724.64 | 0.484 | 0.986 | 323.19 | 0.153 | 0.796 | |
| 35 | 746.27 | 0.561 | 0.979 | 333.49 | 0.159 | 0.849 | |
结果表明,随着温度的升高,HAP对UO22+的最大吸附量呈上升趋势。Langmuir吸附等温式的相关系数R2(> 0.979)高于Freundlich吸附等温方程,说明Langmuir吸附等温模型能更好地拟合HAP吸附UO22+过程,吸附属于单分子层吸附。
2.6 吸附动力学
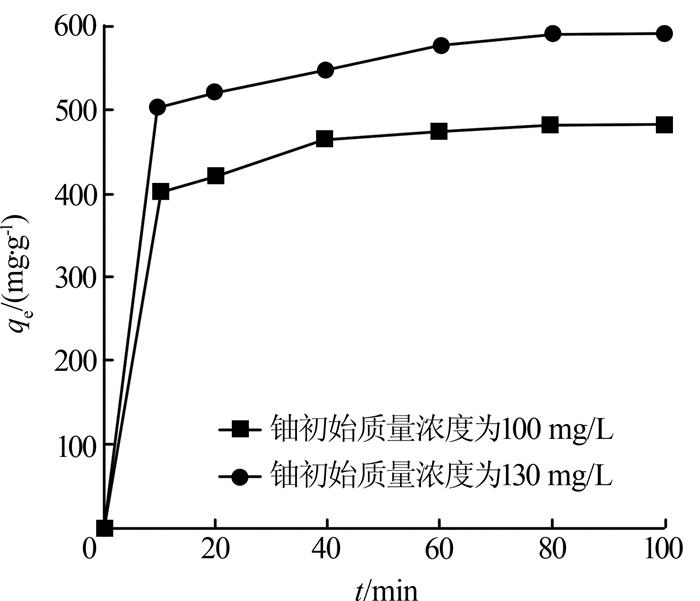
在温度25 ℃、pH为4、初始铀质量浓度分别为100、130 mg/L的条件下,考察HAP对铀(Ⅵ)吸附量随时间的变化情况,见图 4。
图4
由图 4可见,随着吸附时间的增加,UO22+吸附量迅速上升,随后增速放缓至基本保持不变,吸附反应达到平衡。初始反应阶段HAP为UO22+提供了大量可利用的吸附位点,UO22+能快速替换HPO42-中H+的位置生成表面络合物,且固/液界面浓度差较大,溶液传质驱动力较大,容易克服UO22+在固/液界面之间的传质阻力,使吸附速率较快〔11〕。随着吸附时间的延长,HAP表面的吸附位点逐渐达到饱和,此时主要是UO22+取代部分Ca2+的交换过程,固/液界面UO22+浓度差逐步降低,吸附速率降低。80 min时吸附基本达到平衡,此时最大吸附量分别为483.10、594.49 mg/g,说明该材料适于处理高浓度的含铀废水。
用伪一级动力学模型、伪二级动力学模型和颗粒内扩散模型拟合HAP对UO22+吸附动力学,拟合参数见表 2。
表2 HAP对铀(Ⅵ)的吸附动力学模型及拟合参数
| C0/(mg·L-1) | qe/(mg·g-1) | 伪一级动力学 | 伪二级动力学 | Morris颗粒内膜扩散模型 | ||||||||
| ln(qe-qt)=lnqe-k1t | t/qt=1/k2qe2+t/qe | qt=k3t1/2+b | ||||||||||
| k1 | qe | R2 | k2 | qe | R2 | b | k3 | R2 | ||||
| 100 | 483.10 | 0.076 | 308.58 | 0.917 | 0.319 7 | 497.51 | 0.999 | 370.78 | 12.41 | 0.904 | ||
| 130 | 594.49 | 0.069 | 286.20 | 0.915 | 0.000 5 | 613.49 | 0.999 | 456.97 | 14.59 | 0.978 | ||
从表 2可以看出,伪一级动力学模型拟合相关系数R2均较低,且理论平衡吸附量与实验结果相差较大。这是由于伪一级动力学模型有局限性,一般只适合初始吸附阶段的动力学描述,不能准确描述吸附全过程〔12〕。伪二级动力学模型的相关系数R2均为0.999,理论平衡吸附量分别为497.51、613.49 mg/g,与实验所得结果(493.10、594.49 mg/g)基本吻合,说明该材料吸附UO22+的动力学过程符合伪二级动力学模型。伪二级模型包含了吸附全部过程,如外部液膜扩散、表面吸附和颗粒内扩散等,可更加真实全面地反映UO22+在HAP的吸附机制〔13〕。化学键的形成是影响伪二级动力学的主要因素,推测该材料对UO22+的吸附主要受化学反应的影响〔14〕。
由Morris颗粒内膜扩散模型可知吸附过程分为3个阶段,t1/2<4.472时,吸附量上升速度很快,说明此吸附阶段以膜扩散为主;t1/2为4.472~8.944时,qt上升速度开始放缓,此阶段UO22+通过吸附剂表面的液膜进入颗粒空隙内部,UO22+与颗粒内表面发生接触;吸附进行到80 min以后,qt增量趋于平缓,UO22+被牢牢吸附在颗粒内表面,此时达到吸附平衡状态。
2.7 红外光谱分析
2.8 XRD分析
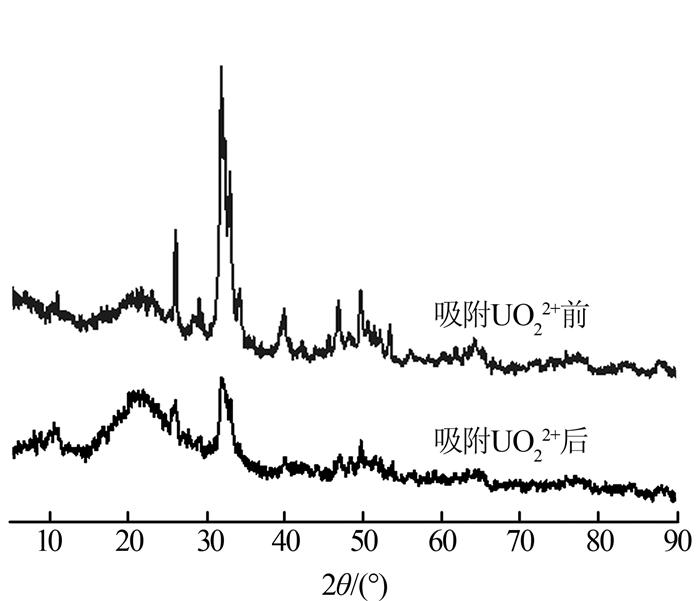
图 5为HAP吸附100 mg/L铀(Ⅵ)溶液前后的XRD谱图。
图5
HAP有5个主要特征峰(25.94°、31.80°、39.86°、46.75°、49.57°)。用XRD分析软件Jade 6.5物相检索,反应前的晶面位置为(100)、(211)、(410)、(432),与羟基磷灰石的标准卡片吻合,说明制备吸附剂为羟基磷灰石(HAP)。吸附UO22+后,HAP特征衍射峰偏移到较低的衍射角度(最大衍射峰32.03°偏移到31.92°),主峰强度有所降低,并出现新的特征衍射峰,说明HAP中的Ca2+与UO22+发生交换,导致其结构发生膨胀〔17〕。XRD分析得出,HAP吸附UO22+后形成了稳定的磷铀矿化合物钙铀云母〔Ca(UO2)2(PO4)2〕。
2.9 扫描电镜与能谱分析
图 6为HAP吸附前后的SEM图片。
图6
用EDS能谱仪对样品的元素及其质量分数进行计算,如表 3所示。
表3
HAP吸附前后元素质量分数
| 元素 | C | O | Na | Mg | P | Cl | K | Ca | Sr | U |
| 吸附前 | 27.14 | 36.71 | 3.19 | 0.34 | 10.66 | 2.76 | 0.26 | 17.57 | 1.37 | 0.00 |
| 吸附后 | 15.35 | 25.70 | 0.36 | 0.18 | 7.51 | 0.55 | 0.73 | 5.27 | 1.19 | 43.16 |
从表 3可以看出,HAP具有的元素在测试结果中均存在,同时有碳元素出现,表明在材料制备过程中有机物没有被完全去除。HAP中的Ca2+易于与许多其他金属离子进行离子交换〔8〕。碳元素的存在表明可能存在碳元素组成的活性炭,而活性炭有很大的比表面积和发达的微孔结构,可提供羧基、内酯基、酚羟基、羰基等含氧官能团,这些官能团可能与UO22+通过静电吸引与离子交换相互作用。HAP吸附UO22+后,可看到铀元素存在。同时,HAP表面的Ca元素质量分数从吸附前的17.57%降到5.27%;C元素质量分数从27.14%降到15.35%;O元素质量分数从36.71%降到25.70%;P元素质量分数从10.66%降到7.51%;而铀元素质量分数为43.16%。表明UO22+和HAP中的Ca2+及活性炭中的羧酸基团可能发生离子交换〔19〕,同时活性炭中的含氧官能团与UO22+可能存在静电吸附作用。
3 结论
(1)猪骨基羟基磷灰石(HAP)能有效去除水溶液中的铀。pH为4时去除效果较好,去除率随着溶液质量浓度的升高呈下降趋势,HAP最佳投加量为0.002 g/mL。
(2)15、25、35 ℃下Langmuir模型的相关系数均>0.979,不同铀质量浓度下伪二级动力学模型的相关系数R2均为0.999,表明该吸附过程主要是近似单分子层的化学吸附。升温有利于吸附反应进行。
(3)HAP对UO22+去除机制包括溶解-沉淀、离子交换和表面络合。吸附速率受膜扩散、颗粒内扩散和沉淀、离子交换等控制。离子交换与表面络合是HAP去除UO22+的主要机制。
参考文献
Polyacrylamide-hydroxyapatite composite:preparation, characterization and adsorptive features for uranium and thorium
[J].
Preparation of a porous hydroxyapatite-carbon composite with the bio-template of sugarcane top stems and its use for the Pb(Ⅱ) removal
[J].
氧化石墨烯/有机改性膨润土复合材料的制备及其对Cd(Ⅱ)的吸附
[J].
Removal of Cd2+ from aqueous solutions by hydroxyapatite
[J].
Equilibrium, kinetic and thermodynamic studies of adsorption of Cd(Ⅱ) from aqueous solution onto HACC-bentonite
[J].
An investigation into the adsorption removal of ammonium by salt activated Chinese(Hulaodu) natural zeolite:kinetics, isotherms, and thermodynamics
[J].
Removal of lead ions using hydroxyapatite nano-material prepared from phosphogypsum waste
[J].






 津公网安备 12010602120337号
津公网安备 12010602120337号