目前垃圾渗滤液膜浓缩液的处理处置方式主要有转移(回灌、外运等)、减量化(蒸发、高压反渗透等)以及无害化处理(焚烧、高级氧化等)三种类型。转移处置中回灌法应用范围较广,但膜浓缩液长期回灌对生物系统不利,会影响工艺的稳定性;浓缩减量化对设备及反应条件要求高、能耗大,且减量化处理过程中污染物只发生了转移并未实现真正的去除;无害化处理可有效去除膜浓缩液中难降解有机物,净化效果好。随着膜浓缩液产量的持续增加,以高级氧化为主的无害化处理成为垃圾渗滤液膜浓缩液处理的重要方法〔5〕,但单纯的高级氧化处理成本高且难以实现膜浓缩液中总氮的达标排放〔6〕。张亚通等〔7〕总结目前膜浓缩液处理方法的优势与不足后,提出以"高级氧化+生物处理法"为核心的组合工艺是膜浓缩液综合处置的重要发展方向。生物法可有效去除小分子有机物及含氮化合物等〔8-9〕,处理成本低,可弥补高级氧化的不足。然而,对于成分复杂、有害物质含量高的难降解废水,采用传统生物法联合高级氧化已难以满足废水的处理要求〔10〕。生物强化技术通过将具有特定功能的微生物引入生化系统,提高系统中功能微生物的浓度及特征污染物降解活性,可有效提高微生物系统的耐受性,在工业废水处理工程中应用广泛且效果显著〔11-12〕。
本研究针对垃圾渗滤液膜浓缩液的水质特点,筛选获得可高效脱除垃圾渗滤液膜浓缩液中总氮的脱氮菌株,对其性能和应用条件进行探究,并评估通过向膜浓缩液处理系统中投加高效脱氮菌剂的生物强化方法对于恢复脱氮性能的影响,为垃圾渗滤液膜浓缩液的生物高效脱氮提供技术支撑。
1 实验部分
1.1 实验材料
污泥取自南京市某垃圾焚烧厂渗滤液处理生化系统,垃圾渗滤液膜浓缩液取自该厂纳滤(NF)及碟管式反渗透(DTRO)膜浓液混合池的浓水,水质指标见表 1。
表1 垃圾渗滤液膜浓缩液水质指标
| COD/(mg·L-1) | NH3-N/(mg·L-1) | NO3-N/(mg·L-1) | TN/(mg·L-1) | TP/(mg·L-1) | 盐度/% | pH |
| 1 063 | 4.95 | 1 058 | 1 110 | 1.74 | 3.5 | 7.8 |
| SO42-/(mg·L-1) | Cl-/(mg·L-1) | Zn(Ⅱ)/(μg·L-1) | Cr(Ⅵ)/(μg·L-1) | Ni(Ⅱ)/(μg·L-1) | Cu(Ⅱ)/(μg·L-1) | Pb(Ⅱ)/(μg·L-1) |
| 6 010 | 54 684 | 213 | 206 | 1 040 | 14.3 | 12.3 |
微量元素溶液:(NH4)6Mo7O2·4H2O 1.1 g/L,CuSO4·5H2O 1.57 g/L,MnCl2·4H2O 5.06 g/L,CaCl2 5.5 g/L,FeSO4·7H2O 5.0 g/L,CoCl2·6H2O 1.61 g/L,ZnSO4 2.2 g/L,乙二胺四乙酸二钠50 g/L。
1% 溴百里酚蓝(BTB)酒精:称取0.1 g BTB粉末,先用10 mL 95%乙醇溶解后,加水定容到100 mL。
富集培养基:NaNO3 1~3 g/L,乙酸钠20 g/L,K2HPO4 1 g/L,KH2PO4 1 g/L,MgSO4·7H2O 0.15 g/L,微量元素2 mL/L,pH 7.0~7.5,121 ℃灭菌20 min。
筛选培养基〔13〕:NaNO3 1 g/L,乙酸钠20 g/L,K2HPO4 1 g/L,KH2PO4 1 g/L,MgSO4·7H2O 0.15 g/L,微量元素2 mL/L,pH 7.0~7.5,1%BTB酒精5 mL/L,琼脂20 g/L,pH 7.0~7.2,121 ℃灭菌20 min。
反硝化培养基:NaNO3 6.07 g/L,葡萄糖4.1 g/L,K2HPO4 4.6 g/L,KH2PO4 1.5 g/L,MgSO4·7H2O 1.0 g/L,微量元素2 mL/L,pH 7.0~7.5。
LB斜面培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,琼脂20 g/L,121 ℃灭菌20 min。LB活化培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,121 ℃灭菌20 min。
1.2 实验方法
1.2.1 高效脱氮菌株的富集与筛选
取垃圾渗滤液活性污泥5 g,接种至100 mL的富集培养基(NaNO3质量浓度为1 g/L)中,在温度35 ℃、转速150 r/min的摇床上好氧驯化1 d,得到第一菌液;按接种量5%(体积分数)将第一菌液接种至新的富集培养基(NaNO3质量浓度为2 g/L)中,在温度35 ℃、转速150 r/min的摇床上好氧驯化1 d,得到第二菌液;同上,将第二菌液接种至新的富集培养基(NaNO3质量浓度为3 g/L)中,相同条件下驯化1 d,得到第三菌液。吸取第三菌液,用无菌水梯度稀释后涂布于筛选培养基,35 ℃下好氧培养,挑取能使筛选平板变蓝且具有不同形态的菌落,连续于筛选培养基上划线纯化,分离生长速率较快的菌落,将纯化后的单菌落接种至LB斜面培养基,4 ℃保存。
将分离获得的菌株接种于LB培养基中活化24~32 h,至600 nm处吸光度(OD)值为1.2~1.5(有效活菌浓度为1.1~1.7×108 cfu/mL),得到扩大培养液。取扩大培养液20 mL离心,然后加入5 mL无菌生理盐水重悬洗涤,重复3次后重悬菌体,并接种于200 mL垃圾渗滤液膜浓缩液中,按C/N为4的比例投加碳源(葡萄糖),35 ℃于缺氧瓶中振荡培养。定时检测培养过程中总氮浓度,得到脱氮效率高、速率最快的目标菌株。
1.2.2 高效脱氮菌株16S rDNA的鉴定
1.2.3 不同因素(温度、C/N、菌液投加体积)对功能菌株脱氮效能的影响
取垃圾渗滤液膜浓缩液高效脱氮菌株扩大培养液20 mL于6 000 r/min下离心5 min,将离心后得到的菌体用5 mL垃圾渗滤液膜浓缩液重悬。之后接种于装有200 mL垃圾渗滤液膜浓缩液的缺氧瓶中,以葡萄糖为碳源,调整C/N为4,分别于不同温度(10、15、20、25、30、35、40、45、50 ℃)下,150 r/min振荡培养72 h。取反应前后的反应液并过0.45 μm滤膜,检测滤液中总氮浓度,计算脱氮率以考察温度对功能菌株脱氮效能的影响。
取垃圾渗滤液膜浓缩液高效脱氮菌株扩大培养液20 mL于6 000 r/min下离心5 min,将离心后得到的菌体用5 mL垃圾渗滤液膜浓缩液重悬。之后接种于装有200 mL垃圾渗滤液膜浓缩液的缺氧瓶中,以葡萄糖为碳源,分别调整C/N为2、3、4、5、6,于30 ℃下150 r/min振荡培养72 h,取反应前后的反应液并过0.45 μm滤膜,检测滤液中总氮浓度,计算脱氮率以考察C/N对功能菌株脱氮效能的影响。
分别取垃圾渗滤液膜浓缩液高效脱氮菌株扩大培养液6、12、20、40、60 mL(菌液体积与待处理垃圾渗滤液膜浓缩液体积的比值分别为3%、6%、10%、20%、30%)于6 000 r/min下离心5 min,将离心后得到的菌体用5 mL垃圾渗滤液膜浓缩液重悬。之后接种于装有200 mL垃圾渗滤液膜浓缩液的缺氧瓶中,以葡萄糖为碳源,调整C/N为4,于30 ℃下150 r/min振荡培养72 h,取反应前后反应液并过0.45 μm滤膜,检测滤液中总氮浓度,计算脱氮率以考察菌液投加体积对功能菌株脱氮效能的影响。
1.2.4 高效脱氮菌株对盐度的耐受性
取垃圾渗滤液膜浓缩液高效脱氮菌株扩大培养液20 mL于6 000 r/min下离心5 min,将离心后得到的菌体用5 mL生理盐水重悬。之后分别接种至含200 mL反硝化培养基的缺氧瓶中,并利用NaCl分别设置不同盐度(0%、3%、5%、7%、10%),于30 ℃下150 r/min振荡培养,定时取反应液并过0.45 μm滤膜后检测滤液中总氮浓度,直至总氮浓度稳定后计算脱氮率。
1.2.5 高效脱氮菌株对重金属的耐受性
分别加入不同量的K2Cr2O4、CuCl2、NiCl2以调节重金属离子Cr(Ⅵ)、Cu(Ⅱ)、Ni(Ⅱ)的浓度。取垃圾渗滤液膜浓缩液高效脱氮菌株扩大培养液20 mL于6 000 r/min下离心5 min,将离心后得到的菌体用5 mL生理盐水重悬。之后分别接种至200 mL含重金属的反硝化培养基的缺氧瓶中,于30 ℃下150 r/min振荡培养,定时取反应液并过0.45 μm滤膜,检测滤液中总氮浓度并计算脱氮率。
1.2.6 高效脱氮菌株强化反应器深度脱氮
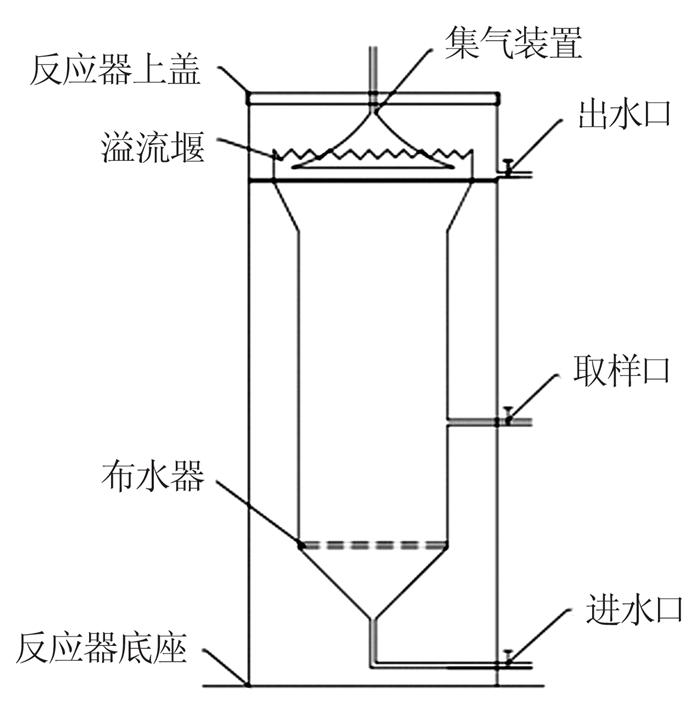
采用实验室稳定运行处理垃圾渗滤液膜浓缩液的上流式反应器进行深度脱氮实验,其有效容积为2 L,装置示意图如图 1所示。
图1
该反应器运行一段时间后,进水管道因结垢发生堵塞无法进水(垃圾渗滤液膜浓缩液),但外加碳源(葡萄糖)仍在不断投加,造成严重的碳氮比失衡进而导致系统出现故障,无法自行恢复。取高效反硝化菌株扩大培养液〔V(菌液)/ V(处理液)=10%〕,离心后菌体用膜浓缩液重悬,将重悬液加入上述反应器并混合均匀后,连续进水,观察脱氮率变化情况,各阶段运行参数详见表 2。
表2 生物强化处理垃圾渗滤液膜浓缩液总氮各阶段的工艺参数
| 运行阶段 | 运行时间/d | C/N | HRT/h | 污泥质量浓度/(mg·L-1) | 运行条件 |
| 稳定运行期(第Ⅰ阶段) | 1~25 | 4 | 12 | 60 000~80 000 | 稳定运行 |
| 系统崩溃期(第Ⅱ阶段) | 26~44 | 4 | 12 | 60 000~80 000 | 系统故障 |
| 系统恢复期(第Ⅲ阶段) | 45~62 | 4 | 12 | 60 000~80 000 | 生物强化(投加高效脱氮菌剂) |
2 结果与讨论
2.1 高效脱氮功能菌的筛选及鉴定
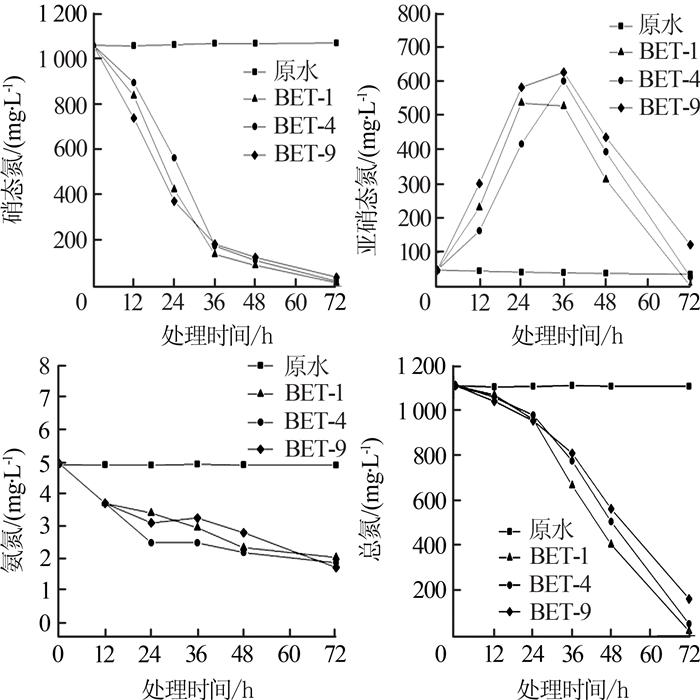
经富集培养和分离纯化,从垃圾渗滤液活性污泥中共获得9株反硝化菌株,分别命名为EBT-1~EBT-9。通过BTB平板初筛纯化得到3株变蓝且生长较快的菌株,分别为EBT-1、EBT-4、EBT-9。将初筛获得的3株反硝化菌株接种至盐度为3.5%的垃圾渗滤液膜浓缩液中进行复筛,结果见图 2。
图2
从垃圾渗滤液膜浓缩液成分来看,膜浓缩液中总氮为1 110 mg/L,其中硝态氮占比高达95.3%,另外含有部分亚硝态氮及少量氨氮。如图 2所示,EBT-1、EBT-4、EBT-9在36 h对硝态氮去除率达到82%以上,但在此期间体系中的亚硝态氮伴随着硝态氮的减少而发生积累,36 h积累质量浓度分别达到526.07、599.68、624.83 mg/L,导致整体总氮去除率不高(仅为27.21%~40.22%)。硝态氮被大部分消耗后,亚硝态氮积累至最大浓度,这主要是由硝酸盐还原速率与亚硝酸盐还原速率有所差异造成的。反硝化过程是在缺氧条件下,以NO3-与NO2-为电子受体,在硝酸盐还原酶(NR)、亚硝酸盐还原酶(NIR)、一氧化氮还原酶(NOR)、氧化亚氮还原酶(N2OR)等作用下,将硝酸盐或亚硝酸盐逐步还原为N2的过程。研究表明,相比于硝酸盐还原酶,亚硝酸盐还原酶竞争电子能力较弱,导致亚硝酸盐还原速率远远低于硝酸盐还原速率,硝酸盐的大量存在也会抑制亚硝酸盐还原,因此出现了亚硝态氮的积累〔16-17〕。随着反应时间延长,累积的亚硝态氮被逐步消耗,72 h时,经EBT-1、EBT-4、EBT-9处理后出水总氮分别为13.37、45.53、157.48 mg/L,此时三者中EBT-1对总氮去除率最高,为98.79%,出水总氮低于生活垃圾填埋场污染控制标准(GB 16889—2008)水污染物排放浓度限值(总氮≤40 mg/L)。综上,EBT-1的平均反硝化速率最高,高达15.09 mg/(L·h),因此,选取菌株EBT-1进行后续研究。
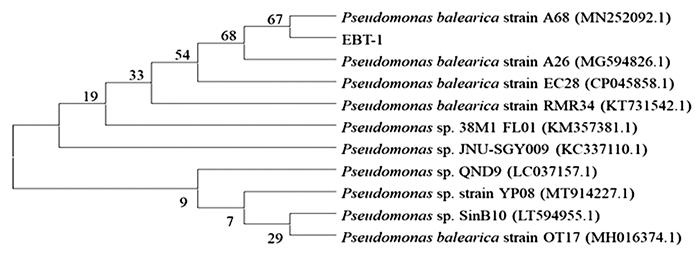
对菌株EBT-1进行分子生物学鉴定,结果如图 3所示。
图3
EBT-1基因序列与假单胞菌(Pseudomonas)相似性高达99%以上,且与巴利阿里假单胞菌(Pseudomonas balearica strain A68)亲缘关系最近,故鉴定EBT-1为巴利阿里假单胞菌(Pseudomonas balearica)。假单胞菌是一类被广泛发现的反硝化细菌,许多研究报道其具有异养硝化-好氧反硝化性能〔18-19〕。随着研究的不断深入,越来越多的假单胞菌被发现在极端环境下具有脱氮性能,王兆阳〔20〕等从活性污泥中筛选得到一株好氧反硝化假单胞菌Pseudomonas sp. GL19,其具有耐低温、嗜碱(pH 6~10)、高效脱氮特性,可实现同步硝化反硝化。韩永和〔21〕从排污淤泥中筛选获得的施氏假单胞菌Pseudomonas stutzeri A-13对盐度的耐受达到了10%,且对初始质量浓度分别为620、570、545 mg/L的NO3--N、NO2--N、氨氮去除率分别达到了99.7%、90.7%和67.7%,TN最高去除率达到了86.1%。本研究通过对垃圾渗滤液生化处理系统中活性污泥的富集驯化,获得了能够对高盐高氮负荷(总氮1 110 mg/L)垃圾渗滤液膜浓缩液进行深度脱氮的反硝化功能菌株Pseudomonas balearica EBT-1。
2.2 温度、C/N及菌液投加体积对EBT-1脱氮速率的影响
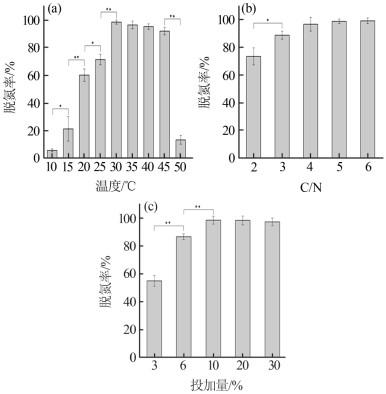
温度会严重影响微生物生长代谢及其酶活力,一般硝化-反硝化适宜温度为25~37 ℃〔22〕。通过调控反应温度,考察温度对EBT-1脱氮性能的影响,结果如图 4(a)所示。温度在10~30 ℃之间,EBT-1的脱氮效率随着温度的升高显著增加;30 ℃时,脱氮率达到最大值98.8%;30~45 ℃时,脱氮率随温度的变化不显著,保持在90%以上;50 ℃时,EBT-1脱氮率显著降低,仅为13.38%。由此可见,低温时反硝化酶活力受到抑制,但伴随着温度的升高,抑制作用随之减小;而高温直接使酶失活,导致反硝化活力显著降低〔23〕。EBT-1处理垃圾渗滤液膜浓缩液适宜温度为30~45 ℃,最适温度为30 ℃。
图4
在反硝化过程中,碳源既是保障菌体内源呼吸的有机物,又是NO3-、NO2-还原的电子供体,C/N对反硝化过程有重要影响〔24〕。本研究以葡萄糖为碳源,探究不同C/N对EBT-1处理垃圾渗滤液膜浓缩液脱氮效率的影响,结果如图 4(b)所示。当C/N在2~5之间时,随着C/N的增加,EBT-1对膜浓缩液的脱氮率随之增加。其中C/N为4时,去除率为96.68%,出水总氮已经达到生活垃圾填埋场污染控制标准。较高的C/N有利于反硝化反应的进行,但碳源过多可能会导致有机物整合入微生物酶结构中,影响酶的活性,从而降低总氮的去除效果〔25〕。另外,考虑实际工程中,较高的C/N意味着需要投加更多的碳源,增加生物脱氮运行成本。综合技术达标及运行经济性,最优的C/N为4。
投加量是保障功能菌株脱氮效能的重要影响因素,对实际工程应用也有重要指导意义。研究表明,在一定范围内增大接种量可以大幅提高脱氮效率〔26〕。不同投加体积下EBT-1对膜浓缩液脱氮效率的影响如图 4(c)所示,在膜浓缩液总氮负荷为1 110 mg/L,C/N为4的条件下,EBT-1菌液投加体积为待处理液体积的3%~10%时,投加体积的增加显著提高了系统的脱氮率;投加体积为待处理液体积的10%~30%时,对EBT-1脱氮效率无显著影响。由此可知,在营养物质一定的条件下,投加体积的增加只能短时间内增强反硝化速率,不能提高最终的总氮去除率。这是因为微生物在碳源、氮源充足条件下,生物量越大,脱氮速率越快;但在营养物质有限的条件下,增加微生物投加量的同时也加大了其内源呼吸的营养消耗、增强了微生物之间的物质竞争,对进一步提高污染物去除率并无显著效果〔27〕。综上,在C/N为4时,EBT-1处理垃圾渗滤液膜浓缩液的最佳菌液投加体积为待处理液体积的10%。
2.3 EBT-1对盐度及重金属的耐受性
2.3.1 EBT-1对盐度的耐受性
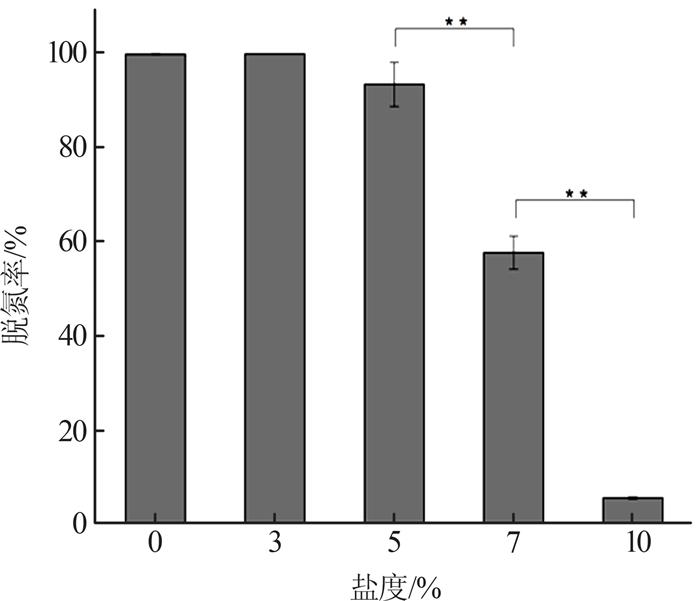
图5
由图 5可知,当盐度在0%~5%时,盐度的增加对EBT-1的脱氮效率并无显著影响,总氮去除率均可达到93%以上;盐度在5%~10%时,EBT-1反硝化能力受到部分抑制,7%盐度条件下脱氮率为57.5%,总氮去除率显著降低(p < 0.01);当盐度为10%时,EBT-1反硝化反应几乎被完全抑制,总氮去除率仅为5.5%。综上,EBT-1耐受盐度范围为0%~5%。随着环境盐度的增加,越来越多的耐盐微生物被发现,假单胞菌是较为广泛的耐盐菌属之一。曲洋等〔29〕从高盐废水的反应器污泥中筛选出一株耐盐异养硝化菌Pseudomonas sp. gy18及一株中度嗜盐异养硝化菌Halomonas sp. gs2,两株菌株适宜生长的盐度范围分别为0%~4%、2%~8%,适宜脱氮盐度范围分别为0%~3%、2%~8%,总氮去除率可达71.45%。
2.3.2 EBT-1对重金属的耐受性
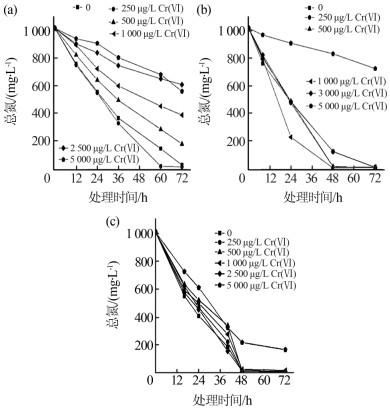
图6
由图 6可以看出,3种重金属离子对EBT-1的抑制顺序为Cr(Ⅵ) > Cu(Ⅱ) > Ni(Ⅱ)。由图 6(a)可知,当ρ〔Cr(Ⅵ)〕≤250 μg/L时,Cr(Ⅵ)对EBT-1脱氮具有促进作用;当250 μg/L<ρ〔Cr(Ⅵ)〕≤2 500 μg/L时,随着Cr(Ⅵ)浓度增加对EBT-1脱氮的抑制作用随之增强,至ρ〔Cr(Ⅵ)〕=2 500 μg/L时,与不含Cr(Ⅵ)的对照组相比,总氮去除率降低了57.44%;当ρ〔Cr(Ⅵ)〕提高至5 000 μg/L时,对EBT-1脱氮的抑制率并无显著增加。许多好氧反硝化菌对Cr(Ⅵ)具有耐受性,甚至可以去除一部分水中的Cr(Ⅵ)〔31-33〕。Xuan Yu等〔31〕对微生物基因进行研究时发现,Cr(Ⅵ)可以促进假单胞菌反硝化基因的表达,当加入适量浓度的Cr(Ⅵ)时,参与反硝化过程的亚硝酸盐还原酶基因nirK、一氧化氮还原酶基因norB和一氧化二氮还原酶基因nosZ的表达水平显著上调,原因是氧化态的铬可能诱导了反硝化过程中的氧化还原酶的活性。另一方面,Cr(Ⅵ)通过产生的自由基破坏微生物的DNA从而抑制其生长,对很多微生物都有极强的毒性〔34〕。因此,当Cr(Ⅵ)浓度较低时,Cr(Ⅵ)通过适宜的氧化性诱导反硝化酶,促进了反硝化速率;当Cr(Ⅵ)浓度升高后,体系中氧化性过强,抑制了EBT-1的生长,导致反硝化速率显著降低。本研究中,EBT-1对Cr(Ⅵ)离子的耐受范围为0~250 μg/L。
由图 6(b)可知,当ρ〔Cu(Ⅱ)〕≤3 000 μg/L时,Cu(Ⅱ)对EBT-1的脱氮速率无显著影响,总氮去除率均可达到99%以上;当ρ〔Cu(Ⅱ)〕达到6 000 μg/L时,相比于不添加Cu(Ⅱ)的对照组,脱氮速率受到抑制,降低了70.48%。与上述结果相似,Zeyang Lu等〔35〕在研究Cu(Ⅱ)对好氧反硝化菌株YF1的影响时,发现ρ〔Cu(Ⅱ)〕≤600 μg/L时,对反硝化效率几乎没有影响;当ρ〔Cu(Ⅱ)〕达到3 200 μg/L和6 400 μg/L时,与对照组相比,反硝化速率分别下降了31.1%和83.5%。本研究中,EBT-1对Cu(Ⅱ)离子的耐受范围为0~3 000 μg/L。
由图 6(c)可知,当ρ〔Ni(Ⅱ)〕≤2 500 μg/L时,Ni(Ⅱ)对EBT-1的脱氮速率无显著影响;当ρ〔Ni(Ⅱ)〕达到5 000 μg/L时,与不含Ni(Ⅱ)的对照组相比,Ni(Ⅱ)的存在使总氮的去除效率降低了16.2%。Ni(Ⅱ)通过抑制微生物的生长进而降低微生物的脱氮效率,不同微生物对Ni(Ⅱ)耐受浓度有所不同。Jingrui Yang等〔36〕研究表明,ρ〔Ni(Ⅱ)〕为1 000 μg/L时,轻微降低了异养硝化不动杆菌JR1对NH4+-N的去除率;当ρ〔Ni(Ⅱ)〕为5 000 μg/L时,氨氮去除率显著降低;当ρ〔Ni(Ⅱ)〕为10 000 μg/L时,脱氮过程完全停止。王萌萌等〔27〕在Ni(Ⅱ)对混合菌群的脱氮性能影响的研究中,发现ρ〔Ni(Ⅱ)〕低于10 000 μg/L时,对生物脱氮无抑制作用;ρ〔Ni(Ⅱ)〕高于10 000 μg/L时,脱氮效率显著降低,同时抑制了微生物的生长速率。本研究中,EBT-1对Ni(Ⅱ)离子耐受范围为0~2 500 μg/L。
2.4 EBT-1强化处理系统深度脱除垃圾渗滤液膜浓缩液中总氮
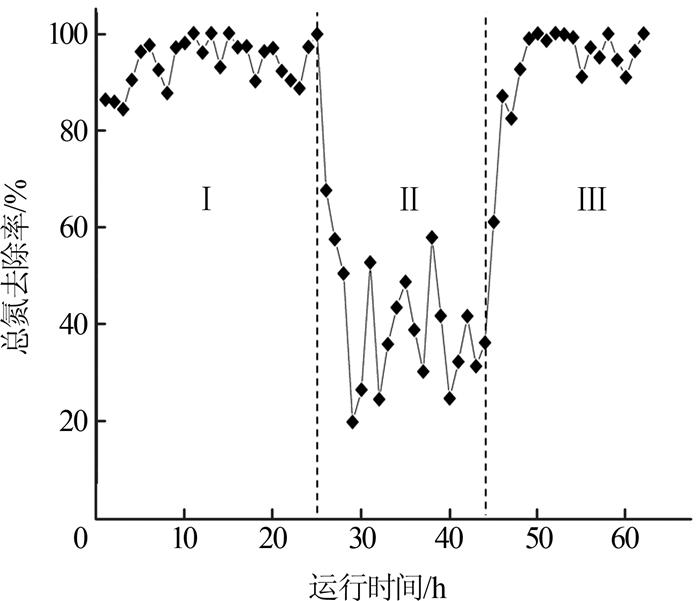
高效反硝化菌EBT-1强化反应器深度脱氮试验包括3个阶段,各阶段膜浓缩液中总氮去除率如图 7所示。
图7
由图 7可知,第Ⅰ阶段(稳定运行期),反应器对垃圾渗滤液膜浓缩液的总氮去除率稳定在84.30%~99.97%;第Ⅱ阶段(系统崩溃期),系统发生故障,污泥出现酸化,反硝化活力低,总氮去除率在30%~50%之间波动,持续运行19 d,系统仍无法恢复;第Ⅲ阶段(系统恢复期),向故障系统中投加高效脱氮菌剂EBT-1,随着运行时间增加系统脱氮率逐步提升,2 d后总氮去除率恢复到80%,4 d后恢复到92%,与系统崩溃期相比,总氮去除率提高了约2~3倍。6 d后总氮去除率达到99.97%,完全恢复到系统崩溃前的脱氮效率,并可实现出水的稳定达标。综上,EBT-1有效改善了污泥酸化中毒后的反硝化性能,故障系统的总氮去除率提高了40%以上,大大缩短了系统的恢复时间,实现了出水水质的稳定达标。EBT-1可有效利用污泥酸化液作为反硝化的碳源,迅速恢复系统的反硝化活力〔37-38〕,为垃圾渗滤液膜浓缩液的深度生物脱氮提供了高效的种质资源和生物强化方法。
3 结论
(1) 从垃圾渗滤液处理系统的活性污泥中筛选获得一株耐盐型高效脱氮的功能菌株巴利阿里假单胞菌EBT-1。
(2) 综合考虑出水的排放标准和技术经济性,EBT-1应用于垃圾渗滤液膜浓缩液深度脱氮的最适条件为:温度30 ℃、C/N为4、菌液投加体积为待处理液体积的10%。
(3) EBT-1为耐盐型反硝化功能菌,对盐度的耐受范围为0%~5%。Cr(Ⅵ)、Cu(Ⅱ)、Ni(Ⅱ)均会抑制EBT-1的反硝化作用,3种重金属离子的抑制顺序为Cr(Ⅵ) > Cu(Ⅱ) > Ni(Ⅱ)。EBT-1对Cr(Ⅵ)、Cu(Ⅱ)、Ni(Ⅱ)的耐受范围分别为0~250 μg/L、0~3 000 μg/L和0~2 500 μg/L。
(4) 外源投加高效反硝化菌EBT-1可快速恢复冲击条件下处理系统的反硝化效能,实现垃圾渗滤液膜浓缩液的高效脱氮和稳定达标排放。
参考文献
Characterization and removal of dissolved organic matter(DOM) from landfill leachate rejected by nanofiltration
[J].DOI:10.1016/j.wasman.2008.08.020 [本文引用: 1]
垃圾渗滤液反渗透浓缩液处理技术综述
[J].DOI:10.3969/j.issn.1009-6825.2013.11.102 [本文引用: 1]
Electro-Fenton treatment of concentrates generated in nanofiltration of biologically pretreated landfill leachate
[J].DOI:10.1016/j.jhazmat.2012.05.108 [本文引用: 1]
高级氧化+生化组合工艺处理炼化反渗透浓水
[J].DOI:10.3969/j.issn.1674-0254.2019.03.005 [本文引用: 1]
Incorporation of electrochemical advanced oxidation processes in a multistage treatment system for sanitary landfill leachate
[J].
水污染治理中生物强化技术应用研究
[J].DOI:10.3969/j.issn.1673-2251.2020.12.047 [本文引用: 1]
浅谈生物强化技术及其在水污染治理中的应用
[J].DOI:10.3969/j.issn.1673-2251.2016.02.050 [本文引用: 1]
A simple screening procedure for heterotrophic nitrifying bacteria with oxygen-tolerant denitrification activity
[J].DOI:10.1016/S1389-1723(03)80077-4 [本文引用: 1]
碳氮比对短程反硝化过程中N2O产生的影响
[J].DOI:10.3969/j.issn.0438-1157.2011.07.039 [本文引用: 1]
Removal of nitrate in simulated water at low temperature by a novel psychrotrophic and aerobic bacterium, Pseudomonas taiwanensis strain J
[J].
Nitrification of industrial and domestic saline wastewaters in moving bed biofilm reactor and sequencing batch reactor
[J].DOI:10.1016/j.jhazmat.2010.09.024 [本文引用: 1]
耐盐异养硝化菌qy18和中度嗜盐异养硝化菌gs2的脱氮特性与耐盐性研究
[J].DOI:10.3969/j.issn.1007-6336.2011.03.008 [本文引用: 1]
Simultaneous aerobic denitrification and Cr(Ⅵ) reduction by Pseudomonas brassicacearum LZ-4 in wastewater
[J].DOI:10.1016/j.biortech.2016.09.037 [本文引用: 2]
Simultaneous reduction of nitrate and Cr(Ⅵ) by Pseudomonas aeruginosa strain G12 in wastewater
[J].DOI:10.1016/j.ecoenv.2019.110001
Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5
[J].DOI:10.1016/j.biortech.2019.121360 [本文引用: 1]
Simultaneous ammonia and Cr(Ⅵ) removal by Pseudomonas aeruginosa LX in wastewater
[J].DOI:10.1016/j.bej.2020.107551 [本文引用: 1]
Aerobic denitrification by Paracoccus sp. YF1 in the presence of Cu(Ⅱ)
[J].DOI:10.1016/j.scitotenv.2018.12.225 [本文引用: 1]
Ammonium removal characteristics of an acid-resistant bacterium Acinetobacter sp. JR1 from pharmaceutical wastewater capable of heterotrophic nitrificationaerobic denitrification
[J].DOI:10.1016/j.biortech.2018.10.052 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号