污水处理厂(WWTPs)是控制水污染、保证人类可持续发展的重要基础设施。然而WWTPs是能源密集型的综合技术,随着水质排放标准、能源和资源投入的逐渐提高,推测WWTPs消耗的能源占全社会消耗能量的1%〔3〕。以A2/O、氧化沟、SBR及变形工艺为主的传统生物脱氮去除1 g NH4+-N、1 g NO3--N时,理论上需4.57 g O2、5.70 g COD,并产生1.25 g污泥、7.86 g CO2,过程相对复杂,耗能高、碳源需求量大、污泥产量大、消耗碱度〔4-5〕,并产生大量CO2、CH4和N2O等温室气体。在推进生态文明建设和出台“碳中和、碳达峰”政策的前提下,WWTPs污水处理的能源化、资源化、生态化、精细化、社会化与智慧化将成为重要的发展方向。Anammox反应为主流城镇WWTPs的发展提供了新思路,主流Anammox的实现将带来市政污水处理的革命性变革〔6〕。
与传统脱氮相比,厌氧氨氧化菌(AAOB)驱动的Anammox反应具有无需外加碳源、运行成本低、耗氧量低和污泥产率低等优点〔7-8〕,是迄今为止最简捷的污水生物脱氮途径,但AAOB世代周期较长,对环境因素变化敏感。接种AAOB富集物是在规模化WWTPs中建立Anammox并实现快速脱氮的有效方法〔9-10〕。调节亚硝酸盐剂量和溶解氧可促进AAOB的生长,在77 d内实现规模化Anammox工艺的启动〔11〕。西安某大型WWTP升级改造后为国内首个主流Anammox处理工艺〔12〕,WWTPs中AAOB的存在为实现Anammox反应提供了关键基础,但AAOB的多样性特性在主流WWTPs处理工艺的不同生物单元中鲜见分析和报道。笔者采用高通量测序技术研究了主流WWTPs不同处理工艺不同单元的生物污泥中AAOB的多样性,以期为推动实现主流Anammox工艺提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
E.Z.N.ATM Mag-Bind Soil DNA Kit,OMEGA;Qu-bit3.0 DNA检测试剂盒,Life;2×Hieff® Robust PCR Master Mix、Hieff NGSTM DNA Selection Beads,Yeasen。
Pico-21台式离心机,Thermo Fisher;DYCZ-21电泳槽,北京六一仪器厂;FR-1000凝胶成像系统,上海复日科技有限公司;Q32866 Qubit® 3.0荧光计,Invitrogen;PCR仪,北京东胜创新生物科技有限公司。
1.2 样品采集
污泥样品分别取自汉江流域上游4个不同污水处理厂的生物单元,每个污泥样品采集3次,采样时间为2020-10-23至2020-10-29,所有采集的污泥样品置于聚乙烯密封袋中并排尽空气密封,立即用冰盒储存带回实验室于-80 ℃保存,用于DNA提取和分子生物学实验。处理厂1、处理厂2、处理厂3、处理厂4采用工艺分别为氧化沟、A2/O、A2/O和间歇进水循环式活性污泥工艺(CAST),其中处理厂1的厌氧泥、好氧泥分别编号ak1、ak7,处理厂2的厌氧泥、缺氧泥、好氧泥分别编号ak2、ak4、ak8,处理厂3的厌氧泥、缺氧泥、好氧泥分别编号ak3、ak5、ak9,处理厂4的生物污泥编号ak6。
1.3 微生物总DNA提取、PCR扩增和Illumina测序
污泥样品的微生物总DNA提取严格按照OMEGA试剂盒E.Z.N.A Mag-Bind Soil DNA Kit试验步骤进行。PCR进行2轮扩增。第1轮扩增,用Qubit3.0DNA检测试剂盒对基因组DNA精确定量后,确定PCR反应加入的模板DNA量,PCR扩增引物A438f(5′-GTCRGGAGTTADGAAATG-3′)和A684r(5′-ACCAGAAGTTCCACTCTC-3′)〔13-16〕。反应条件:94 ℃ 3 min;94 ℃ 30 s,49 ℃ 20 s,72 ℃ 30 s,5个循环;94 ℃ 20 s,50 ℃ 20 s,72 ℃ 30 s,24个循环;72 ℃ 5 min,10 ℃。30 μL PCR反应体系,2×Hieff® Robust PCR Master Mix 15 μL,Bar-PCR primer F 1 μL,Primer R 1 μL,模板PCR产物10~20 ng,ddH2O 12~ 13 μL。第2轮扩增,引入Illumina桥式PCR兼容引物。反应条件:95 ℃ 3 min;94 ℃ 20 s,64 ℃ 20 s,72 ℃ 30 s,6个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,6个循环;72 ℃ 5 min,10 ℃。30 μL PCR反应体系,2×Hieff® Robust PCR Master Mix 15 μL,Bar-PCR primerF 1 μL,Primer F 1 μL,第1轮PCR产物10~20 ng,dd H2O 12~13 μL。为得到均匀的长簇效果和高质量测序数据,使用Qubit3.0荧光定量仪进行文库浓度精确定量,利用Illumina MiSeq 2000进行测序。
1.4 序列数据分析
所有测序原始数据用Prinseq软件进行质控,采用Usearch软件进行Operational taxonomic units(OTUs)聚类分析,并用RDP classifier贝叶斯算法在97%相似水平对OTU进行分类〔17〕,运行软件Mothur(http://www.mothur.org/)中的summary. Single命令,计算生物相关指数,包括丰富度指数(Chao1/Ace)、覆盖率指数(Good’s coverage)和多样性指数(Shannon/Simpson指数)。利用R软件基于主坐标分析(PCoA)进行β多样性分析。用Origin、Excel等进行微生物的α多样性和β多样性的相关图绘制。
2 结果与分析
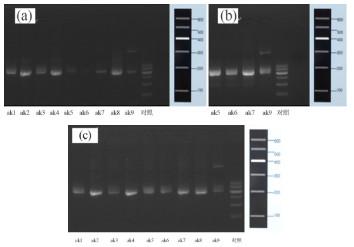
2.1 PCR扩增产物分析
图1
以提取的总DNA为模板,通过两轮PCR扩增,结果表明主流WWTPs氧化沟、A2/O和CAST工艺各生物单元(除ak5、ak6、ak7、ak9条带较弱外)均得到扩增产物,产物大小约为200 bp,初步表明不同WWTPs厌氧、缺氧和好氧单元存在AAOB。
2.2 AAOB多样性分析
所有污泥样品测序原始数据经过质控过滤后得到高质量序列,平均长度在215~245 bp,与通过2%琼脂糖凝胶电泳检测PCR扩增产物大小基本一致。AAOB群落的α多样性指数见表 1。
表1 AAOB群落α多样性指数
Table 1
| 样品 | 序列数 | OTUs | Shannon | Chao1 | Ace | Simpson | 覆盖率 |
| ak1 | 70 251 | 36 | 2.02 | 42 | 48.03 | 0.24 | 0.99 |
| ak2 | 81 476 | 42 | 0.61 | 43 | 43.51 | 0.76 | 0.99 |
| ak3 | 78 236 | 35 | 1.99 | 41 | 38.01 | 0.22 | 0.99 |
| ak4 | 78 239 | 44 | 0.79 | 46 | 46.22 | 0.70 | 0.99 |
| ak5 | 80 964 | 48 | 2.25 | 48 | 48 | 0.19 | 1 |
| ak6 | 80 862 | 19 | 1.93 | 19 | 0 | 0.21 | 1 |
| ak7 | 66 281 | 94 | 2.10 | 94 | 94.20 | 0.26 | 0.99 |
| ak8 | 85 993 | 93 | 1.16 | 98 | 95.06 | 0.54 | 0.99 |
| ak9 | 56 402 | 43 | 2.19 | 44 | 43.87 | 0.20 | 0.99 |
由表 1可见,有效序列在56 402~85 993,样品OTUs在19~94,覆盖率均达到0.99,表明未被检出的生物种类较少,得到的α多样性指数可靠性较高。
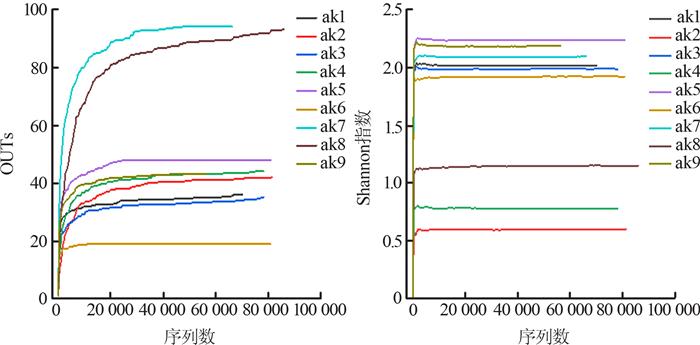
图 2为AAOB群落组成丰富度稀疏曲线。
图2
由图 2可见,随着测序深度的增加,OTUs和Shannon指数均逐渐增加并趋于饱和,说明所用样品的序列数能够充分展示样品中的生物多样性,与序列高覆盖率反映的结果一致。样品ak1、ak2、ak3、ak4、ak5、ak6、ak7、ak8、ak9独有的OTUs分别为5、5、7、7、8、0、57、28、15,共有的OTUs仅为8;9个污泥样品Shannon指数在0.61~2.25,Simpson指数在0.19~0.76,Chao1指数在19~98,说明WWTPs中AAOB生物多样性较低。
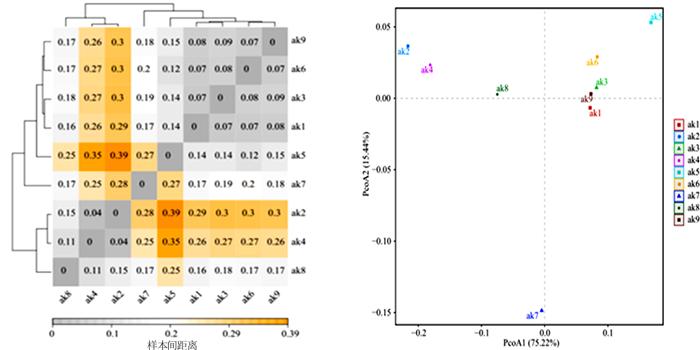
聚类和PCoA β多样性分析均能描述不同样品间群落的差异,若2个样品距离较近,表示这2个样品的物种组成较相似。AAOB群落组成聚类和PCoA分析如图 3所示。
图3
图3
AAOB群落组成聚类分析和PCoA分析
Fig.3
Cluster analysis and PCoA analysis of AAOB community composition
图 3表明,样品ak6、ak9、ak3、ak1不在同一象限内,但聚类在一起且距离较近;样品ak2和ak4聚类在一起且距离较近;ak8虽与ak2、ak4聚类在一起且在同一个象限内,但距离较远;样品ak7未与其他任何样品聚类且单独分布在一个象限。表明相同WWTPs的不同生物单元AAOB可以聚类在同一象限内。样品ak6、ak9、ak3、ak1,样品ak2、ak4的AAOB组成相似度较高,样品ak7的AAOB组成与其他样品相似度较低。
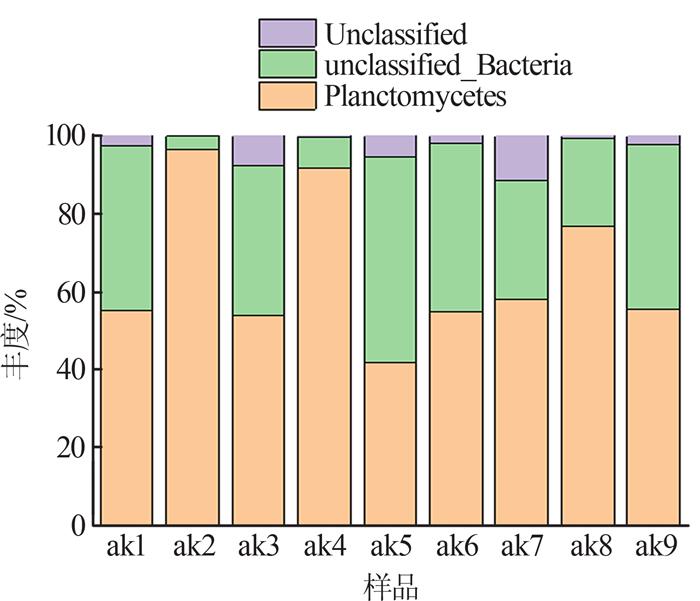
2.3 AAOB群落结构门水平上的组成和丰度
为进一步了解WWTPs生物单元中的AAOB群落组成和丰度,对质控后的序列用RDPclassifier软件进行生物分类,图 4为AAOB群落结构在门水平上的组成和丰度。
图4
图4
AAOB群落结构在门水平上的组成
Fig.4
Composition of AAOB community structure at phylum level
由图 4可知,AAOB生物分类归Planctomycetes门〔27-28〕,ak1、ak2、ak3、ak4、ak5、ak6、ak7、ak8、ak9中Planctomycetes门的丰度分别为55.438%、96.565%、53.982%、91.686%、41.873%、54.927%、58.269%、76.795%、55.721%。未分类的细菌丰度在3.375%~ 52.879%,未明确分类地位的种属在0.060%~11.312%。WWTPs的A2/O、氧化沟和CAST工艺各生物单元中AAOB丰度不同,推测可能与各单元水质、工艺类型和运行参数有关。其中水质是决定因素之一,各工艺单元水中的NO2--N和NH4+-N浓度可决定AAOB为驱动的Anammox反应。目前主流WWTPs中以传统硝化和反硝化为主进行脱氮,AAOB在主流WWTPs各工艺单元中的存在为Anammox反应奠定了基础,如何实现主流城镇污水Anammox反应将是未来研究的热点和焦点。
鲍林林等〔29〕、王衫允等〔30〕分别应用分子生物学技术研究北运河沉积物和白洋淀富营养化湖泊湿地AAOB的群落特征,先用Planctomycetes引物Pla46f和630r进行扩增,再将所得产物作为模板,由特异性引物Amx368f和Amx820r进行AAOB的16S rRNA基因扩增,结果发现两者Anammox物种发育多样性较低,主要为Planctomycetes门的Candidatus Brocadia。洪义国等〔16〕利用引物A438f和A684r分析了不同生境中AAOB的群落结构特点,结果表明,AAOB在红树林、海湾和河口生境中的多样性水平较高,在污泥和红壤中的多样性水平明显较低。未分类的细菌丰度在3.375%~52.879%,未明确分类地位的种属在0.060%~11.312%。
2.4 AAOB群落结构属水平上的组成和丰度
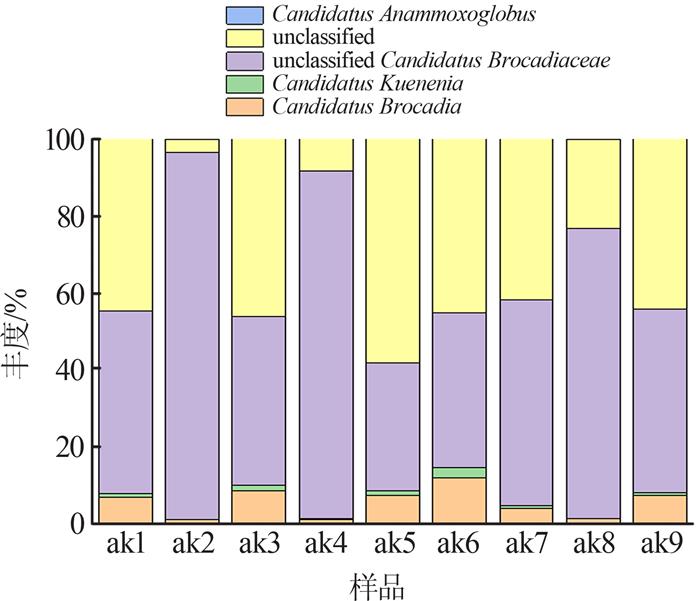
AAOB群落结构在属水平上的组成和丰度如图 5所示。
图5
图5
AAOB群落结构在属水平上的组成
Fig.5
Composition of AAOB community structure at genus level
由图 5可见,主流城镇WWTPs中检测出Candidatus Brocadia、Candidatus Kuenenia、unclassified Candidatus Brocadiaceae和Candidatus Anammoxoglobus 4种AAOB。样品ak1、ak2、ak3、ak4、ak5、ak6、ak7、ak8、ak9中Candidatus Brocadia的丰度分别为6.816%、1.199%、8.678%、1.224%、7.421%、11.996%、3.908%、1.287%、7.303%;Candidatus Kuenenia丰度分别为1.100%、0.017%、1.414%、0.087%、1.089%、2.742%、0.739%、0.093%、0.839%;unclassified Candidatus Brocadiaceae丰度分别为47.522%、95.346%、43.890%、90.374%、33.363%、40.189%、53.621%、75.412%、47.560%。Candidatus Anammoxoglobus仅在样品ak2、ak8中存在,丰度分别为0.002 5%和0.002 3%;Candidatus Brocadia和Candidatus Kuenenia在ak6中均较高,而unclassified Candidatus Brocadiaceae在ak2中高达95.346%;未明确分类地位的种属在9个样品中的丰度为3.435%~58.127%,除在ak2、ak4低于10%外,在其余7个样品中的比例均较高,推测还存在多种未被鉴定的新种属。
Candidatus Brocadia和Candidatus Kuenenia共存于多种环境中〔31-32〕。污水厂和反应器工程生态系统中的AAOB种属具有相似的分布特征,以Candidatus Brocadia和Candidatus Kunenenia为主〔33-35〕。而本研究在主流WWTPs的不同处理工艺不同生物单元中检测到Candidatus Brocadia、Candidatus Kuenenia和unclassified Candidatus Brocadiaceae,以unclassified Candidatus Brocadiaceae为主,与前述研究结果不同,这可能与环境特征差异有关。
各种天然和人造生态系统中报道的AAOB已有19种,分属为6个属,分别为Candidatus Brocadia、Candidatus Kuenenia、CandidatusJettenia、Candidatus Scalindua、Candidatus Anammoximicrobium和Candidatus Anammoxoglobus〔37〕。不同AAOB的最适温度、最适pH、耐受盐度、亚硝酸盐抑制浓度、基质亲和力常数、氧化有机物能力和倍增时间差异较大。
3 结论
(1)PCR扩增产物分析表明,主流城镇WWTPs A2/O、氧化沟和CAST工艺各生物单元均存在AAOB,扩增产物大小约为200 bp。
(2)AAOB多样性分析表明,主流城镇WWTPs中AAOB多样性较低,相同WWTPs的不同生物单元可以分布在同一象限内,不同WWTPs的不同生物单元既有相似也有差异。
(3)AAOB群落结构组成和丰度表明,主流城镇WWTPs中Planctomycetes丰度在41.873%~96.565%之间,存在Candidatus Brocadia、Candidatus Kuenenia、unclassified Candidatus Brocadiaceae和Candidatus Anammoxoglobus 4种AAOB,优势AAOB为unclassified Candidatus Brocadiaceae,丰度在33.363%~95.346%之间。
参考文献
Autotrophic ammonia removal processes: Ecology to technology
[J].DOI:10.1080/10643389.2011.556885 [本文引用: 1]
Anammox start-up strategies: The use of local mixed activated sludge seed versus Anammox seed
[J].DOI:10.2166/wst.2018.431 [本文引用: 1]
Complex microbial nitrogen-cycling networks in three distinct anammox-inoculated wastewater treatment systems
[J].DOI:10.1016/j.watres.2019.115142 [本文引用: 1]
In situ startup of a full-scale combined partial nitritation and anammox process treating swine digestate by regulation of nitrite and dissolved oxygen
[J].DOI:10.1016/j.biortech.2020.123837 [本文引用: 1]
Microbial diversity reveals the partial denitrification-anammox process serves as a new pathway in the first mainstream Anammox plant
[J].DOI:10.1016/j.scitotenv.2020.142917 [本文引用: 1]
More refined diversity of anammox bacteria recovered and distribution in different ecosystems
[J].DOI:10.1007/s00253-013-4756-6 [本文引用: 1]
A comparison of two 16S rRNA gene-based PCR primer sets in unraveling anammox bacteria from different environmental samples
[J].
Anaerobic ammonium oxidation in acidic red soils
[J].
高通量测序分析多种典型生境中厌氧氨氧化细菌的多样性分布特征
[J].
Anaerobic ammonium oxidation by anammox bacteria in the Black Sea
[J].DOI:10.1038/nature01472 [本文引用: 1]
Development of high-rate anaerobic ammonium-oxidizing(anammox) biofilm reactors
[J].DOI:10.1016/j.watres.2007.01.050
两种悬浮填料在ASBBR厌氧氨氧化系统中的性能比较与微生物解析
[J].
A unique bacteriohopanetetrol stereoisomer of marine anammox
[J].DOI:10.1016/j.orggeochem.2020.103994 [本文引用: 1]
北运河沉积物中主要脱氮功能微生物的群落特征
[J].DOI:10.3969/j.issn.1000-6923.2016.05.035 [本文引用: 1]
Anaerobic ammonium-oxidizing bacteria in marine environments: Widespread occurrence but low diversity
[J].DOI:10.1111/j.1462-2920.2007.01266.x [本文引用: 1]
A holistic analysis of ANAMMOX process in response to salinity: From adaptation to collapse
[J].
Ecological niche differentiation among anammox bacteria
[J].DOI:10.1016/j.watres.2020.115468 [本文引用: 1]





 津公网安备 12010602120337号
津公网安备 12010602120337号